Гастроинтестинальная стромальная опухоль (ГИСО) – Bayer Pharmaceuticals Россия
ГИСО является наиболее распространенной формой саркомы (типа рака, который образуется из клеток соединительной ткани), развивающейся в желудочно-кишечном тракте. Чаще всего поражается желудок (около 70% случаев) и тонкий кишечник (20–30% случаев)1.
Ежегодно во всем мире ГИСО диагностируется у 11–20 человек на миллион населения, а в Европе, по оценкам специалистов, заболеваемость составляет 15 человек на миллион населения в год.
ГИСО представляет опасность для жизни, если опухоль распространилась на другие органы (метастазы) или не может быть удалена хирургическим путем. ГИСО, выявленные на ранней стадии заболевания, удаляются хирургически, однако у 40% пациентов развивается рецидив опухоли с последующим метастазированием.
ГИСО может не вызывать каких-либо заметных симптомов до тех пор, пока опухоли не достигнут определенного размера. Таким образом, ГИСО часто диагностируется только на более поздних стадиях заболевания, т.
Терапия ГИСО
Лечение ГИСО зависит от ряда факторов, включая общее состояние здоровья пациента, а также от размера и расположения опухоли. Хирургическое вмешательство является основным вариантом лечения ГИСО при ее очаговом течении или распространении только на соседнюю ткань. Более крупные опухоли или расположенные в тех участках ЖКТ, где их удаление может быть затруднено без ухудшения состояния пациента в дальнейшем, часто подвергаются таргетным видам терапии. Таргетные препараты являются ингибиторами роста и работают, блокируя сигналы роста, предотвращая размножение клеток ГИСО.
Для лечения ГИСО в тех случаях, если опухоль не может быть удалена хирургическим путем и/или уже метастазировала, были одобрены три таргетных препарата.
Препараты Bayer для терапии ГИСО
Компания Вayer разработала таргетный препарат, одобренный и используемый во многих странах мира, включая США, Японию, ЕС и РФ, для лечения пациентов с ГИСО, не поддающимися хирургическому лечению или при наличии метастазов, и у которых болезнь прогрессирует на терапии иматинибом и сунитинибом или при непереносимости данного вида лечения.
Регистрационное удостоверение препарата для лечения ГИСО было выдано по результатам международного клинического исследования III фазы, в которое были включены пациенты с неоперабельными или метастатическими ГИСО после прогрессирования на стандартной терапии или при непереносимости данного вида лечения
1. Филоненко Д. А. и соавторы, Применение регорафениба у больных диссеминированными стромальными опухолями желудочно-кишечного тракта, Медицинский Совет, 2018, №10, 10.21518/2079-701X-2018-10-12-16
А. и соавторы, Применение регорафениба у больных диссеминированными стромальными опухолями желудочно-кишечного тракта, Медицинский Совет, 2018, №10, 10.21518/2079-701X-2018-10-12-16
2. Demetri GD et al. Lancet. 2013;381:295-302
3. Mucciarini C et al. BMC Cancer. 2007;7:230
Онкология
ГАУЗ «Республиканский клинический онкологический диспансер» МЗ РТ, Казань
Реферат. ГИСО являются разновидностью мезенхимальных опухолей, представляют наиболее часто развивающиеся мезенхимальные злокачественные опухоли желудочно-кишечного тракта. Однако лишь в последние десятилетия в литературе появились публикации, описывающие ГИСО, их диагностику и лечение. Проведен поиск литературных источников в доступных медицинских журналах до 2009 г. с использованием ключевых слов: ГИСО, клетки Cajal, лечение, Imatinib, РТК (рецепторы тиразинкиназы). В последние годы высказано предположение, что ГИСО развиваются из мезенхимальных стромальных клеток. Частота их развития составляет около 10—12 случаев на 1 млн жителей ежегодно.
Ключевые слова: ГИСО, клетки Cajal, лечение, Imatinib, РТК (рецепторы тиразинкиназы)
Введение
Гастроинтестинальные стромальные опухоли (ГИСО) являются разновидностью мезенхимальных опухолей, представляют наиболее часто встречающиеся мезенхимальные злокачественные опухоли желудочно-кишечного тракта (ЖКТ). ГИСО являются РТК-продуцирующими и РТК-сигнализирующими (рецептор тиразинкиназы CD117) мезенхимальные опухоли. При большинстве ГИСО происходит активная мутация РТК или PDGFR-альфа (Platelet Derived Growth Factor Receptor афгш) [1]. Они составляют менее 1% всех опухолей ЖКТ. Сначала считалось, что данные опухоли развиваются из клеток Cajal мезодермы.
Эпидемиология
Частота развития ГИСО составляет около 10—20 случаев на 1 млн населения ежегодно. Малигнизацию оценивают в 20—30% [7—9]. Однако точная частота развития ГИСО не известна из-за незавершенной классификации [10]. Более чем в 90% случаев ГИСО поражают взрослых пациентов старше 40 лет. Средний возраст составляет 63 года. Однако описаны случаи ГИСО в любом возрасте, включая детский. Частота заболевания у мужчин и женщин одинаковая, хотя опубликовано сообщение о преимущественном поражении мужчин [7]. Частота патологии не зависит от географии, этнической и расовой принадлежности. Наиболее часто локализацией ГИСО является желудок (50—60%) и тонкая кишка (30—40%). 5—10% ГИСО исходят из толстой и прямой кишки, 5% развиваются в пищеводе. Другими редкими локализациями являются брыжейка, брюшина и сальник, хотя опубликованы случаи ГИСО желчного пузыря, поджелудочной железы, печени и мочевого пузыря. В случаях, когда ГИСО развиваются вне ЖКТ, опухоль определяют как экстрагастроинтестинальная стромальная опухоль (ЭГИСО) [11].
Клиническая презентация
Клиническая симптоматика ГИСО неопределенная. Более того, лишь у 70% больных заболевание проявляется симптоматикой, у 20% — протекает бессимптомно, в 10% случаев диагноз устанавливают на аутопсии [6, 7]. Симптоматика неспецифическая, поэтому в 50% случаев ГИСО к моменту диагностики развиваются метастазы. Клиническими симптомами являются образование брюшной полости или кровотечение [12]. Как было сказано ранее, в 10% случаев заболевание протекает бессимптомно из-за малых размеров опухоли (менее 2 см), диагноз устанавливают случайно [13]. Наиболее частым симптомом является кровотечение в просвет вследствие эрозии стенки органов ЖКТ. Внутрибрюшное кровотечение проявляется болями в животе и требует проведения неотложной операции. Внутреннее кровотечение проявляется рвотой с кровью, меленой и анемией. Другим симптомом служит пальпируемое образование брюшной полости. У большинства больных развиваются симптомы раздражения блуждающего нерва, такие как тошнота, рвота, дискомфорт в животе, потеря веса, отсутствие аппетита.
Диагностика
Различают следующие типы дифференцирования ГИСО: от абсолютно дифференцированных опухолей с мышечным, невральным и ганглиозным фенотипом до случаев с незавершенным или смешанным дифференцированием. Сегодня с применением иммуногис-тохимии стало понятно, что ГИСО-клетки относятся к мультипотенциальным мезенхимальным стволовым клеткам. ГИСО позитивны к тирозинкиназе [16, 17]. Встречают различные размеры ГИСО, от нескольких миллиметров до 30 см и более, в среднем 5—8 см. Макроскопически ГИСО отличаются экзофитным ростом, при операции обнаруживают образование, исходящее из желудка, выпирающее в брюшную полость и смещающее другие органы [18]. В 50% случаев выявляют изъязвление слизистой оболочки. ГИСО являются светло-серыми округлыми опухолями, как правило, с псевдокапсулой. Менее часто визуально определяют зоны геморрагии, кистозную дегенерацию и некротические изменения [19].
Встречают различные размеры ГИСО, от нескольких миллиметров до 30 см и более, в среднем 5—8 см. Макроскопически ГИСО отличаются экзофитным ростом, при операции обнаруживают образование, исходящее из желудка, выпирающее в брюшную полость и смещающее другие органы [18]. В 50% случаев выявляют изъязвление слизистой оболочки. ГИСО являются светло-серыми округлыми опухолями, как правило, с псевдокапсулой. Менее часто визуально определяют зоны геморрагии, кистозную дегенерацию и некротические изменения [19].
Различают многочисленные гистологические характеристики ГИСО. ГИСО желудка являются солидными образованиями, часто с гиалиновой стромой. ГИСО тонкой кишки в большинстве случаев длинные, тонкие и выглядят как параганглиомы. Другими характеристиками являются эозинофильная структура, содержащая коллаген, который окрашивают PAS (periodic acid-Schiff-краситель). ГИСО толстой кишки и ано-ректальные опухоли имеют черты опухолей тонкой кишки, в то же время ГИСО пищевода более похожи на опухоли желудка. Как правило, при ГИСО желудка представлена перинуклеарная вакуолизация и тесные взаимоотношения между ИКС (интерстициальные клетки Cajal) и гладкими мышечными клетками. При ГИСО тонкой кишки клетки чаще длинные и тонкие, чем эпителиоидные, поэтому часто диагностируют параганглиому [12].
Как правило, при ГИСО желудка представлена перинуклеарная вакуолизация и тесные взаимоотношения между ИКС (интерстициальные клетки Cajal) и гладкими мышечными клетками. При ГИСО тонкой кишки клетки чаще длинные и тонкие, чем эпителиоидные, поэтому часто диагностируют параганглиому [12].
Часто диагностика ГИСО запоздалая из-за неопределенности клинической картины (нередко более 6 мес после появления симптоматики) [10]. Несмотря на проведение нескольких диагностических исследований, таких как контрастная рентгенография ЖКТ, компьютерная томография и ангиография, патологию не верифицируют. Дооперационная чрес-кожная биопсия противопоказана, так как связана с высоким риском разрыва опухоли или диссеминации [20]. В нескольких исследованиях показана высокая диагностическая точность (80—85%) аспирационной биопсии под УЗ-контролем. В недавнем исследовании было установлено, что при эндоскопической ультра-сонографии (ЭУСГ) могут быть получены такие характеристики опухоли, как размеры, неровные границы, рост за пределами просвета органа, гетерогенная структура, которые являются предсказательными моментами злокачественной природы ГИСО [22]. Необходимо отметить, что несмотря на то что ГИСО всегда являются потенциально злокачественными опухолями, в ряде случаев их поведение доброкачественное. В другом исследовании [23] оценивали дооперационные ЭУСГ-критерии 35 субэпителиальных верхних желудочно-кишечных поражений. 26 опухолей были лейомиомами и 9 — лейомиосаркомами. Это исследование проведено в 1997 г. до признания ГИСО самостоятельной патологией. В этом исследовании злокачественную природу поражения устанавливали на основании размеров опухоли, неровных внешних границах опухоли, эхогенных очагов и кистозных изменений.
Необходимо отметить, что несмотря на то что ГИСО всегда являются потенциально злокачественными опухолями, в ряде случаев их поведение доброкачественное. В другом исследовании [23] оценивали дооперационные ЭУСГ-критерии 35 субэпителиальных верхних желудочно-кишечных поражений. 26 опухолей были лейомиомами и 9 — лейомиосаркомами. Это исследование проведено в 1997 г. до признания ГИСО самостоятельной патологией. В этом исследовании злокачественную природу поражения устанавливали на основании размеров опухоли, неровных внешних границах опухоли, эхогенных очагов и кистозных изменений.
В исследовании из Франции оценивали ЭУСГ-критерии 56 хирургически резецированных верхних ЖКТ-поражений. Авторы установили, что неровные внешние границы опухоли, кистозные очаги и злокачественное поражение лимфатических узлов указывают на злокачественную опухоль или стромальную опухоль [24]. Несмотря на то что ЭУСГ-признаки предполагают ГИСО и определяют показания к резекции, дооперационная диагностика малигномы базируется на данных цитологии, гистологии и иммуногистохи-мии.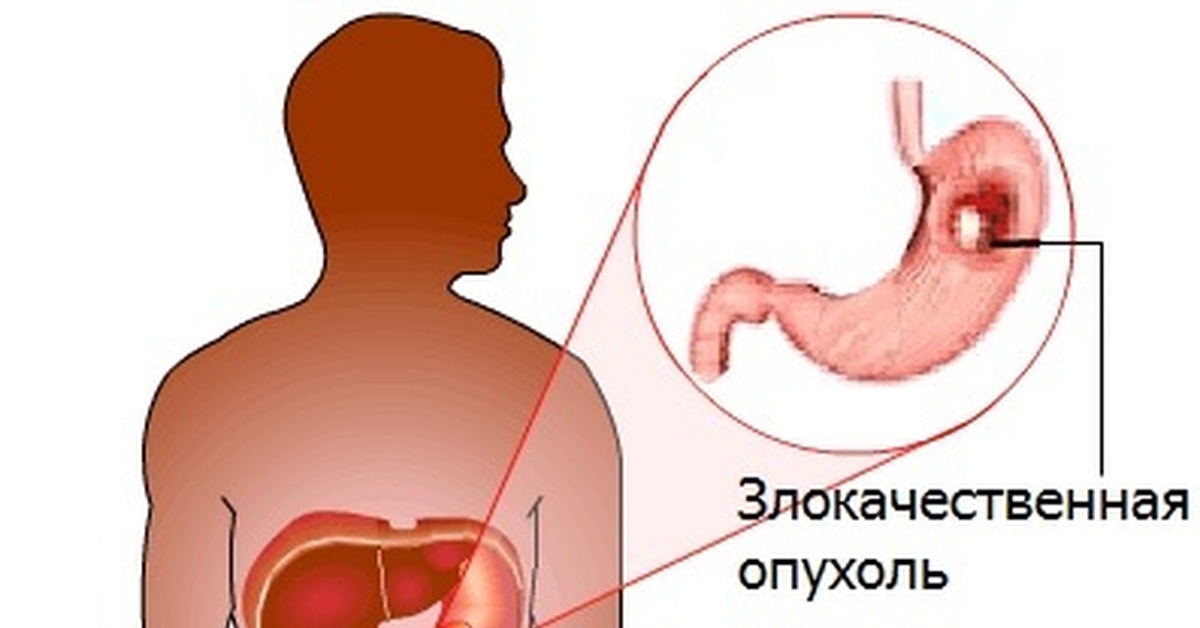 Внедрение аспирационной биопсии под контролем ЭУСГ повысило возможности эндоскопической ультрасонографии в диагностике ГИСО, однако на основании данных аспирационной биопсии сложно определить злокачественный потенциал ГИСО. При изучении аспиратов может быть установлена лишь митотическая активность поражения. Интересны иммуногистохимические исследования аспиратов под ЭУСГ-контролем в определении злокачественности опухоли. В опубликованном исследовании 17 больных с резецированными ГИСО было показано, что анализы мутации гена С-тирозинкиназы имеют предсказательное значение в определении злокачественной природы поражения [25].
Внедрение аспирационной биопсии под контролем ЭУСГ повысило возможности эндоскопической ультрасонографии в диагностике ГИСО, однако на основании данных аспирационной биопсии сложно определить злокачественный потенциал ГИСО. При изучении аспиратов может быть установлена лишь митотическая активность поражения. Интересны иммуногистохимические исследования аспиратов под ЭУСГ-контролем в определении злокачественности опухоли. В опубликованном исследовании 17 больных с резецированными ГИСО было показано, что анализы мутации гена С-тирозинкиназы имеют предсказательное значение в определении злокачественной природы поражения [25].
В другом исследовании было установлено, что чувствительность и диагностическая ценность аспи-рационной биопсии под ЭУСГ-контролем сравнима с результатами иных процедур, таких как биопсия поражения поджелудочной железы и лимфатических узлов. Более традиционная инструментальная биопсия трудно выполнима из-за субэпителиальной локализации очага и сопряжена с повышенным риском перфорации. Не определено значение аспирационной биопсии под ЭУСГ-контролем в получении достаточного для диагностики биопсийного материала. Необходимо проведение дополнительных исследований. Тем не менее сегодня аспирационная биопсия под ЭУСГ-контролем является методом выбора безопасной тканевой диагностики ГИСО. Известно, что предсказательными факторами адекватного получения тканевого материала при ГИСО являются размер опухоли 5—10 см, округлая или овальная форма и специфичность сонографических признаков. Дуоденальная локализация, размер более 10 см, неправильная форма и неясные сонографические характеристики связаны с неадекватным забором ткани и соответственно с отрицательной цитологической диагностикой. Размер опухоли является одним из двух наиболее точных критериев малигнизации ГИСО (по данным Fletcher и соавт.) [12]. ГИСО позитивны на CD117 в 90—95% случаев. В 71% случаев выявляют мутации С-тирозинкиназы [26].
Не определено значение аспирационной биопсии под ЭУСГ-контролем в получении достаточного для диагностики биопсийного материала. Необходимо проведение дополнительных исследований. Тем не менее сегодня аспирационная биопсия под ЭУСГ-контролем является методом выбора безопасной тканевой диагностики ГИСО. Известно, что предсказательными факторами адекватного получения тканевого материала при ГИСО являются размер опухоли 5—10 см, округлая или овальная форма и специфичность сонографических признаков. Дуоденальная локализация, размер более 10 см, неправильная форма и неясные сонографические характеристики связаны с неадекватным забором ткани и соответственно с отрицательной цитологической диагностикой. Размер опухоли является одним из двух наиболее точных критериев малигнизации ГИСО (по данным Fletcher и соавт.) [12]. ГИСО позитивны на CD117 в 90—95% случаев. В 71% случаев выявляют мутации С-тирозинкиназы [26].
Прогностические факторы
Клиническое поведение ГИСО неопределенное: от доброкачественного до высокозлокачественного, исход не предсказуем. Были изучены многочисленные прогностические факторы, такие как размер опухоли, гистологические, иммуногистохимические, молекулярно-генетические показатели. Однако предсказать злокачественный потенциал поражения сложно. Поэтому сегодня нет определенной системы стадирования ГИСО. Предложены различные предсказательные параметры злокачественности опухоли. Сегодня основными предсказательными факторами злокачественного поведения являются размер и количество митозов [26]. ГИСО во всех случаях имеют злокачественный потенциал, даже тогда, когда являются доброкачественными. Опухоли менее 5 см, как правило, имеют наименьший риск, в то время как поражения более 5 см являются злокачественными [27]. Даже при размерах менее 5 см, невозможно предсказать доброкачественную опухоль, так как часто они метастазируют. Менее 5 митозов в 50 высокоактивных полях (ВАП), как правило, характеризует доброкачественную ГИСО. Менее 5 митозов в 50 ВАП при стромальных дуоденальных опухолях является показателем доброкачественности, в то время как при ГИСО подвздошной кишки пределом является 5 митозов в 50 ВАП.
Были изучены многочисленные прогностические факторы, такие как размер опухоли, гистологические, иммуногистохимические, молекулярно-генетические показатели. Однако предсказать злокачественный потенциал поражения сложно. Поэтому сегодня нет определенной системы стадирования ГИСО. Предложены различные предсказательные параметры злокачественности опухоли. Сегодня основными предсказательными факторами злокачественного поведения являются размер и количество митозов [26]. ГИСО во всех случаях имеют злокачественный потенциал, даже тогда, когда являются доброкачественными. Опухоли менее 5 см, как правило, имеют наименьший риск, в то время как поражения более 5 см являются злокачественными [27]. Даже при размерах менее 5 см, невозможно предсказать доброкачественную опухоль, так как часто они метастазируют. Менее 5 митозов в 50 высокоактивных полях (ВАП), как правило, характеризует доброкачественную ГИСО. Менее 5 митозов в 50 ВАП при стромальных дуоденальных опухолях является показателем доброкачественности, в то время как при ГИСО подвздошной кишки пределом является 5 митозов в 50 ВАП. Важно отметить, что 50 ВАП является минимальным числом ВАП, необходимым для определения точного индекса пролиферативной активности [28]. Однако при ГИСО желудка размером 5—10 см, как правило, прогноз хороший, так как число митозов или уровень Ki67 низкий. С другой стороны, опухоли тонкой кишки более 5 см имеют агрессивное поведение независимо от числа митозов. Таким образом, ГИСО более 10 см независимо от локализации являются потенциально злокачественными.
Важно отметить, что 50 ВАП является минимальным числом ВАП, необходимым для определения точного индекса пролиферативной активности [28]. Однако при ГИСО желудка размером 5—10 см, как правило, прогноз хороший, так как число митозов или уровень Ki67 низкий. С другой стороны, опухоли тонкой кишки более 5 см имеют агрессивное поведение независимо от числа митозов. Таким образом, ГИСО более 10 см независимо от локализации являются потенциально злокачественными.
В многочисленных исследованиях было показано, что некоторые характеристики, такие как склерозирование, являются благоприятным прогностическим фактором, в то время как гиперклеточные саркоматозные проявления предсказывают агрессивное поведение опухоли. В крупном исследовании Miettinen и соавт. [29] установлено, что при опухолях желудка неблагоприятными прогностическими характеристиками являются диффузная ядерная атипия и коагуляционный некроз, в то время как разрушение нуклеарных волокон является признаком хорошего прогноза. Иммуногистохимические маркеры могут иметь важное предсказательное значение злокачественного поведения ГИСО. В многочисленных исследованиях установлено, что повышенная экспрессия маркеров клеточного цикла (MIB-1 или Ki67) является плохим прогностическим признаком [30]. Р16 является геном супрессии опухоли, который уменьшает клеточный цикл, останавливая клетки в G1 до S-фазы. В некоторых исследованиях установлено, что Р16 является неблагоприятным прогностическим фактором злокачественности ГИСО, однако в других исследованиях установлено благоприятное прогностическое значение Р16 [31—32].
В многочисленных исследованиях установлено, что повышенная экспрессия маркеров клеточного цикла (MIB-1 или Ki67) является плохим прогностическим признаком [30]. Р16 является геном супрессии опухоли, который уменьшает клеточный цикл, останавливая клетки в G1 до S-фазы. В некоторых исследованиях установлено, что Р16 является неблагоприятным прогностическим фактором злокачественности ГИСО, однако в других исследованиях установлено благоприятное прогностическое значение Р16 [31—32].
Национальный институт здоровья (НИЗ) в 2001 г. установил, что необходимо классифицировать ГИСО по признаку риска агрессивного поведения, независимо от злокачественной или доброкачественной природы опухоли. Основная рекомендация классификации ГИСО в категории риска базируется на размерах опухоли и количестве митозов, при этом ни одно поражение не может быть признано доброкачественным. До недавнего времени у пациентов с ГИСО лишь размер опухоли и количество митозов были прогностическими характеристиками риска метастазирования и рецидивирования. Оценку риска злокачественности проводили на основании данных Национального института здоровья [12]. Определено, что при опухолях желудка прогноз более благоприятный, чем при опухолях других локализаций [33]. По классификации риска Hornick и Fletcher [34] одним из дополнительных факторов риска является локализация опухоли. При больших опухолях выявлена повышенная мутация Kit11, что является неблагоприятным прогностическим признаком [35]. Установлено, что при ГИСО желудка мутация Kit11 также является серьезным неблагоприятным прогностическим признаком [36].
Оценку риска злокачественности проводили на основании данных Национального института здоровья [12]. Определено, что при опухолях желудка прогноз более благоприятный, чем при опухолях других локализаций [33]. По классификации риска Hornick и Fletcher [34] одним из дополнительных факторов риска является локализация опухоли. При больших опухолях выявлена повышенная мутация Kit11, что является неблагоприятным прогностическим признаком [35]. Установлено, что при ГИСО желудка мутация Kit11 также является серьезным неблагоприятным прогностическим признаком [36].
Лечение ГИСО
Лечение локализованных ГИСО
Золотым стандартом лечения локализованных поражений является хирургическая резекция [37]. Размеры опухоли определяют выживаемость больных [38]. Региональная лимфаденэктомия не показана, так как ГИСО редко метастазируют в лимфатические узлы. Уровень резекции и ее объем определяют размер опухоли и ее локализация [39]. При поражении смежных органов показана en block расширенная резекция. Консистенция ГИСО мягкая и хрупкая, разрыв опухоли при ее мобилизации связан с высоким риском диссеминации по брюшине [37]. При радикальной резекции 5-летняя выживаемость достигает 48—65% [39]. Частичную резекцию выполняют лишь при огромных опухолях с паллиативной целью для контроля симптоматики или осложнений, таких как компрессия смежных органов, кровотечение и в ряде случаев болевой синдром [40]. Как было сказано ранее, при резектабельных опухолях хирургическая операция является предпочтительным методом лечения.
Консистенция ГИСО мягкая и хрупкая, разрыв опухоли при ее мобилизации связан с высоким риском диссеминации по брюшине [37]. При радикальной резекции 5-летняя выживаемость достигает 48—65% [39]. Частичную резекцию выполняют лишь при огромных опухолях с паллиативной целью для контроля симптоматики или осложнений, таких как компрессия смежных органов, кровотечение и в ряде случаев болевой синдром [40]. Как было сказано ранее, при резектабельных опухолях хирургическая операция является предпочтительным методом лечения.
Установлено, что лапароскопическая резекция связана с минимальным числом осложнений и летальных исходов [40]. При лапароскопической резекции должны быть оценены такие факторы, как размеры опухоли, ее локализация, инвазия в смежные структуры, а также хирургический опыт [41, 42]. При лапароскопической резекции необходимо соблюдать онкологические принципы, такие как радикальное удаление опухоли, профилактику ее разрыва и диссеминации [43, 44].
Лечение распространенных ГИСО (метастазирование и рецидивирование)
Стандартным методом лечения первичных ГИСО является радикальная хирургическая резекция с отсутствием опухолевого роста по резекционным линиям [40]. В некоторых случаях из-за размеров и локализации опухоли радикальная резекция не осуществима или ее выполнение связано с развитием серьезных функциональных осложнений.
При лечении распространенных и метастатических ГИСО эффективным препаратом является Imatinib mesylate. ГИСО имеют высокий риск метастазирова-ния. Наиболее часто опухоль метастазирует в печень (65%), брюшину (50%) и в оба эти органа (20%). ГИСО отличаются плохим ответом к традиционной химиотерапии (менее 10%), радиологическое лечение проводят лишь с целью обезболивания или в случаях внутрибрюшного кровотечения [26]. ГИСО малочувствительны к химиотерапии, за исключением введения Imatinib mesylate, также известный как STI57 [11, 45], который действует как избирательный ингибитор тирозинкиназы PDGFR-альфа и С-КК-рецепторов. Первоначально Imatinib был разработан как ингибитор PDGFR, его эффективность как ингибитора тиро-зинкиназы была изучена при лечении хронической миелоидной лейкемии [46].
Исследование эффективности Imatinib mesylate было проведено при лечении рецидивов и метастазов, резектабельных и нерезектабельных ГИСО в проспективном исследовании, которое показало ответ у 50% пациентов. Стабилизация заболевания зарегистрирована у 75—85% больных. Двухлетняя выживаемость при лечении Imatinib составила 70%, у 50% пациентов не было прогрессирования заболевания [2]. При прекращении введения Imаtinib через 1 год нередко возникает рецидивирование даже у больных в состоянии полной ремиссии [47]. Лечение прекращают лишь в случаях тяжелого прогрессиро-вания, толерантности и отказа пациента от его проведения. Как правило, больные хорошо переносят лечение, однако в ряде случаев развиваются легкие и умеренные побочные эффекты, такие как отек (обычно периорбитальный) [48], тошнота, мышечные судороги, диарея, головные боли, дерматиты, слабость, витилиго [49], гипотиреоидизм [50], пигментация кожи [51], боли в животе. У пациентов с большими опухолями могут развиться серьезные осложнения, включая желудочно-кишечные и интраабдоминаль-ные кровотечения [52], кардиотоксический эффект [53], полисерозит [54]. Другими побочными эффектами являются нейтропения, лейкопения и печеночная недостаточность [55].
Идеальная дозировка Imatinib не установлена, но современные исследования показали, что эффективность не повышается при увеличении дозы свыше 400 мг в день. Во всех исследованиях дозировок Imatinib установлено, что доза 400—800 мг в день безопасна, эффективна, хорошо переносима пациентами [44]. 1 февраля 2002 г. Imatinib одобрен FDA для лечения нерезектабельных и метастатических ГИСО. Более высокие дозировки сопровождаются симптоматикой интоксикации [46]. Наиболее частыми побочными симптомами введения препарата являются отек, сыпь, тошнота, диарея, миалгия, слабость, головная боль, боли в животе [56]. Известно, что прекращение приема Imatinib связано с повышением риска прогрессирования заболевания [57].
Несмотря на то что разработка Imatinib была революцией в лечении ГИСО, такая терапия не всегда бывает эффективной. У пациентов с первично-резистентными опухолями, как правило, бывают поражения с мутацией Kit9 или с невыявляемой мутацией киназы [28]. Первичная резистентность к Imatinib развивается у 15% больных [39]. У ряда пациентов развивается прогрессирование опухоли в течение 6 мес после первого хорошего эффекта Imatinib [55], т.е. вторичная резистентность к Imatinib. У половины больных с хорошим первым ответом через 2 года развивается резистентность к Imatinib [57]. Механизмом резистентности в этих случаях является вторичная мутация Kit. Резистентные поражения проявляются увеличением опухолевых очагов. Первичная и вторичная резистентность к Imatinib является основной клинической проблемой лечения заболевания. Необходимы дополнительные исследования разработки новых препаратов для лечения Imatinib-резистентных ГИСО [2].
Лекарственное лечение ГИСО
Применение Imatinib в качестве адъювантной терапии после радикальных первичных резекций ГИСО находится на стадии изучения. The American College of Surgeons Oncology Group (ACOSOG) провели проспективное исследование больных после радикальной резекции опухоли [42]. В течение 12 мес вводили 400 мг/день Imatinib [26]. Получены обнадеживающие результаты. Однако в другом сравнительном исследовании при применении Imatinib и плацебо при адъювантной терапии существенной разницы выживаемости в двух группах не установлено [2, 28]. Необходимы дополнительные клинические и экспериментальные исследования. Использование тирозинкиназы повышает выживаемость при распространенных ГИСО, однако полный ответ происходит редко. Более того, установлено, что у большинства больных с хорошим первичным ответом на ингибиторы тиразинкиназы развивается резистентность и прогрессирование заболевания в среднем через 2 года. Ответ на Imatinib у пациентов с ГИСО зависит от наличия и генной локализации Kit-мутаций [1]. Более того, применение Imatinib при неоадъювантной терапии, с или без адъювантной терапии позволяет контролировать микрометаста-зирование, так как ГИСО склонны к диссеминации. Продолжительность и дозировка Imatinib при неоадъювантном лечении не установлена. Однако у 5% больных установлен полный клинический ответ на Imatinib.
Пациентам с локально-резистентными опухолями, с поражениями, прогрессирующими на фоне лечения Imatinib, показана операция. Резекция клонов заболевания, резистентных к лекарственному лечению, может повысить выживаемость пациентов с метастатическим процессом [60]. В заключение отметим, что гистологический ответ на Imatinib не коррелирует с клиническим ответом. На клинические исходы стабильных пациентов с ГИСО не влияют продолжительность приема Imatinib, гистологический ответ и размеры опухоли.
В моделях ГИСО была изучена терапевтическая эффективность некоторых других композиций, отличающихся от ингибиторов киназы, таких как JM domain (компонент органоплатины) [61, 62], HSP90 ингибитор [63], 17AAG, малые молекулярные ингибиторы IGF1R. Возможно, в ближайшем будущем будут проведены клинические исследования IGF1R таргетной терапии при Imatinib-рефрактерных ГИСО [64].
Выживаемость и наблюдение
До применения Imatinib в лечении ГИСО 5-летняя выживаемость после хирургической резекции локальных форм составляла 40—75%. Средняя выживаемость при рецидивировании ГИСО после резекции до использования Imatinib была 15 мес [60]. Прогноз после радикальной резекции ГИСО низкого риска был хорошим. Однако при ГИСО высокого риска результат был неудовлетворительным с 5-летней выживаемостью 0—30%. Однако после внедрения молекулярной таргетной терапии выживаемость с применением Imatinib значительно повысилась [65]. Биологическое поведение ГИСО и выживаемость непредсказуемы, независимо от того, является опухоль доброкачественной или злокачественной. В большинстве случаев ГИСО рецидивируют в течение 3—5 лет после диагностики и лечения, показано наблюдение [60]. Согласно указаниям National Comprehensive Cancer Network, контрольная КТ брюшной полости и таза должна проводиться каждые 3—6 мес в течение 3—6 лет и далее ежегодно. По данным Novitsky и соавт. [7], в большинстве случаев рецидивы развиваются в течение 2 лет после хирургической резекции. Они проводят физикальное обследование каждые 3—4 мес в течение первых 2 лет, каждые 6 мес в последующие 2 года и затем ежегодно. Рентгенография грудной клетки, КТ брюшной полости и анализы крови проводят ежегодно [26]. Верхнюю фиброэндоскопию проводят через 6 мес и через 1 год после операции. Затем ежегодно. Если при наблюдении выявляют какие-либо изменения, проводят ПЭТ, МРТ, КТ грудной клетки [28].
Заключение
Гастроинтестинальные стромальные опухоли являются наиболее частыми мезенхимальными опухолями ЖКТ. В большинстве случаев ГИСО характеризуется повышением мутаций Kit протоонкогена, наиболее часто вовлекается exon 11, менее часто — exon 9, редко — exon 13 или exon 17 [66]. При ГИСО без мутации Kit может быть повышенная мутация PDGFR-альфа-гена, что является альтернативным онкогенным механизмом [67]. Методом выбора лечения первичных ГИСО остается радикальная хирургическая резекция [20].
Значительно изменило методику лечения ГИСО внедрение Imatinib mesylate — пероральный ингибитор тирозинкиназы. Этот препарат ингибирует Kit и PDGFR-альфа-тирозинкиназу и другие компоненты тип-3 группы тирозинкиназы [68, 69]. После разработки молекулярной таргетной терапии с Imatinib значительно повысилась эффективность лечения метастатических и рецидивных ГИСО, увеличилась выживаемость [26]. Чаще развиваются ГИСО желудка и тонкой кишки. Прогноз у пациентов со злокачественными ГИСО желудка значительно лучше, чем при злокачественной ГИСО тонкой кишки. Выявлена статистически значимая корреляция между возрастом и злокачественным потенциалом ГИСО [70]. При больших размерах локализованных ГИСО показана предоперационная терапия с использованием Imatinib с последующей хирургической резекцией [5]. Основным показанием для первичной терапии Imatinib являются местно-распространенные нерезектабельные ГИСО всех локализаций. Известно, что главным предсказательным фактором ответа опухоли на лечение Imatinib является состояние мутации. Но даже в неблагоприятных случаях статуса мутации Kit/PDGFR-альфа показано предоперационное лечение Imatinib со средним уменьшением объема опухоли на 34%. Малочувствительные типы мутации, такие как exon 9 или непредсказуемый тип мутации Kit/PDGFR-альфа не являются противопоказанием для доопера-ционного лечения Imatinib. Исключение составляют типы мутации с известной полной резистентностью (например, D842 V в exon 18 PDGFR-альфа-гене). Показан мониторинг эффективности лечения и его ранняя переоценка [72].
Литература
1. Agaram, N.P. Pathologic and Molecular Heterogeneity in Imatinib-Stable or Imatinib- Responsive Gastrointestinal Stromal Tumors / N.P. Agaram, P. Besmer, C.C. Wong [et al.] // Clin. Cancer Res. — 2007. — Vol. 13(1). — P.170—181.
2. Joensuu, H. Gastrointestinal stromal tumor (GIST) / H. Joen-suu // Annals of Oncology. — 2006. — Vol. 17(10). — P.280—286.
3. Mazur, M.T. Gastric stromal tumors: Reappraisal of histogenesis / M.T. Mazur, H.B. Clark // Am. J. Surg. Pathol. — 1983. — Vol. 7. — P.507—519.
4. Hirota, S. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors / S. Hirota, K. Isozaki, Y. Moriyama [et al.] // Science. — 1998. — Vol. 279. — P.577—580.
5. Andtbacka, R.H. Surgical resection of gastrointestinal stromal tumor after treatment with imatinib / R.H. Andtbacka, C.S. Ng, C.L. Scaife [et al.] // Ann. Surg. Oncol. — 2006. — Vol. 14. — P.14—24.
6. Heinrich, M.C. PDGFRA activating mutations in gastrointestinal stromal tumors / M.C. Heinrich, C.L. Corless, A. Duensing [et al.] // Science. — 2003. — Vol. 299. — P.708—710.
7. Kim, K.M. Gastrointestinal Stromal Tumor Committee; The Korean Gastrointestinal Pathology Study Group. Gastrointestinal Stromal Tumors in Koreans: Incidence and the Clinical, Pathologic and Immunohistochemical Findings / K.M. Kim, D.W. Kang, W.S. Moon [et al.] // J. Korean Med. Sc. — 2005. — Vol. 20. — P.977—984.
8. Tryggvason, G. Gastrointestinal stromal tumors in Iceland, 1990—2003: The Icelandic GIST study, a population-based incidence and pathologic risk stratification study / G. Tryggvason, H.G. Gislason, M.K. Magnusson, J.G. Jonasson // Int. J. Cancer. — 2005. — Vol. 117. — P289—293.
9. Goettsch, W.G. Incidence of gastrointestinal stromal tumours is underestimated: Results of a nation-wide study / W. // Am. J. Gastroenterol. — 2005. — Vol. 100. — P.162—168.
11. Miettinen, M. Gastrointestinal stromal tumors — definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis / M. Miettinen, J. Lasota // Virchows. Archiv. — 2001. — Vol. 438. — P.1—12.
12. Fletcher, C.D. Diagnosis of gastrointestinal stromal tumors: A consensus approach / C.D. Fletcher, J.J. Berman, C. Corless [et al.] // Hum. Pathol. — 2002. — Vol. 33. — P.459—465.
13. Nilsson, B.P. Gastrointestinal stromal tumors: The incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era / B.P. Nilsson, P. Bumming, J.M. Meis-Kindblom [et al.] // Cancer. — 2005. — Vol. 103. — P.821—829.
14. Motegi, A. PKC theta, a novel immunohistochemical marker for gastrointestinal stromal tumors (GIST), especially useful for identifying KIT-negative tumors / A. Motegi, S. Sakurai, H. Nakayama [et al.] // Pathol. — 2005. — Vol. 55. — P.106—112.
15. Corless, C.L. Biology of gastrointestinal stromal tumors / C.L. Corless // J. Clin. Oncol. — 2004. — Vol. 22. — P.3813—3825.
16. Yan, B.M. Epidemiology of gastrointestinal stromal tumors in a defined Canadian Health Region: a population-based study / B.M. Yan, G.G. Kaplan, S. Urbanski [et al.] // Int. J. Surg. Pathol. — 2008. — № 16. — P.241—250.
17. Corless, C.L. PDGFRA Mutations in Gastrointestinal Stromal Tumors: Frequency, Spectrum and In Vitro Sensitivity to Imatinib / C.L. Corless, A. Schroeder, D. Griffith [et al.] // J. Clin. Oncol. — 2005. — Vol. 23. — P.5357—5364.
18. Rubin, B.P. A knock-in mouse model of gastrointestinal stromal tumor harboring kit K641E / B.P. Rubin, C.R. An-tonescu, J.P. Scott-Browne [et al.] // Cancer Res. — 2005. — Vol. 65. — P.6631—6639.
19. Akahoshi, K. Preoperative diagnosis of gastrointestinal stromal tumor by endoscopic ultrasound — guided fine needle aspiration / K. Akahoshi, Y. Sumida, N. Matsui [et al.] // World Gastroenterol. — 2007. — № 13(14). — P.2077—2082.
20. Jamali, F. Disease progression following Imatinib failure in gastrointestinal stromal tumors: Role of surgical therapy / F. Jamali, S. Darwiche, N. El-Kinge [et al.] // The Ona)logist. — 2007. — Vol. 12. — P.438—442.
21. DeMatteo, R.P. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival / R.P. DeMatteo, J.J. Lewis, D. Leung [et al.] // Ann. Surg. — 2000. — Vol. 231. — P.51—58.
22. Shah, P. Predicting Malignant Potential of Gastrointestinal Stromal Tumors Using Endoscopic Ultrasound / P. Shah, F. Gao, S.A. Edmundowicz [et al.] // Dig. Dis. Sci. — 2009. — Vol. 54. — P.1265—1269.
23. Chak, A. Endosonographic differentiation of benign and malignant stromal cell tumors / A. Chak, M.I. Canto, T. Rosch [et al.] // Gastrointest. Endosc. — 1997. — Vol. 45. — P.468—473.
24. Palazzo, L. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours / L. Palazzo, B. Landi, C. Cellier [et al.] // Gut. — 2000. — Vol. 46. — P.88—92.
25. Kinoshita, K. Endoscopic ultrasonography-guided fine needle aspiration biopsy in follow-up patients with gastrointestinal stromal tumours / K. Kinoshita, K. Isozaki, S. Tsutsui [et al.] // Eur. J. Gastroenterol. Hepatol. — 2003. — Vol. 15(11). — P.1189—1193.
26. Gupta, P. Gastrointestinal stromal tumor / P. Gupta, M. Tewari, H. Shulka // Surg. Oncol. — 2008. — Vol. 17(2). — P.129—138.
27. Van Oosterom, A.T. European Organisation for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group. Safety and efficacy of imatinib (STI571) in metastatic gastrointestinal stromal tumours: a phase I study / A.T. van Oosterom, I. Judson, J. Verweij [et al.] // Lancet. — 2001. — Vol. 358. — P.1421—1423.
28. Safdar, A. Role of c-kit/SCF in cause and treatment of gastrointestinal stromal tumors (GIST) / A. Safdar, A. Sher // GENE. — 2007. — Vol. 401. — P.38—45.
29. Miettinen, M. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up / M. Miettinen, L.H. Sobin, J. Lasota // Am. J. Surg. Pathol. — 2005. — Vol. 29. — P.52—68.
30. Singer, S. Prognostic value of KIT mutation type, mitotic activity, and histologic subtype in gastrointestinal stromal tumors / S. Singer, B.P. Rubin, M.L. Lux [et al.] // J. Clin. Oncol. — 2002. — Vol. 20. — 3P.898—905.
31. Schneider-Stock,R. Loss of pl6 protein defines high-risk patients with gastrointestinal stromal tumors: a tissue microarray study / R. Schneider-Stock, C. Boltze, J. Lasota [et al.] // Clin. Cancer Res. — 2005. — Vol. 11. — P.638—645.
32. Steigen, S.E. Diagnostic and prognostic markers for gastrointestinal stromal tumors in Norway / S.E. Steigen, B. Bjerkehagen, H.K. Haugland [et al.] // Mod. Pathol. — 2008. — Vol. 21. — P.46—53.
33. Emory, T.S. Prognosis of gastrointestinal smooth-muscle (stromal) tumors: dependence on anatomic site / T.S. Emory, L.H. Sobin, L. Lukes [et al.] // Am. J. Surg. Pathol. — 1999. — Vol. 23. — P.82—87.
34. Hornick, J.L. The role of KIT in the management of patients with gastrointestinal stromal tumors / J.L. Hornick, C. D. Fletcher // Hum. Pathol. — 2007. — Vol. 38. — P.679—687.
35. Taniguchi, M. Effect of c-kit mutation on prognosis of gastrointestinal stromal tumors / M. Taniguchi, T. Nishida, S. Hirota [et al.] // Cancer Res. — 1999. — Vol. 59. — P.4297—4300.
36. Steigen, S.E. Mutation s in gastrointestinal stromal tumors-a population-based study from Northern Norway / S.E. Steigen, T.J. Eide, B. Wasag [et al.] // APMIS. — 2007. — Vol. 115. — P.289—298.
37. Verweij, J. Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial / J. Verweij, P.G. Casali, J. Zalcberg [et al.] // Lancet. — 2004. — Vol. 364. — P.1127—1134.
38. Rankin, C. Dose effect of imatinib in patients with metastatic GIST — Phase III Sarcoma Group Study S0033 / C. Rankin, M. von Mehren, C. Blanke // ProcAm. Soc. Clin. Oncol. — 2004. — Vol. 23. — P.815.
39. Parfitt, J. Gastrointestinal stromal tumors: A contemporary review / J. Parfitt, C. Streutker, R. Riddell, D. Driman // Pathology — Research and Practice. — 2006. — Vol. 202. — P.837—847.
40. Blay, J.Y. GIST consensus meeting panelists. Consensus meeting for the management of gastrointestinal stromal tumors. Report of the GIST Consensus Conference of 20—21 March 2004, under the auspices of ESMO / J.Y. Blay, S. Bonvalot, P. Casali, [et al.] // Ann. Oncol. — 2005. — Vol. 16. — P.566—578.
41. Tamborini, E. A new mutation in the KIT ATP pocket causes acquired resistance to imatinib in a gastrointestinal stromal tumor patient / E. Tamborini, L. Bonadiman, A. Greco [et al.] // Gastroenterology. — 2004. — Vol. 127. — P.294—299.
42. Li, F.P. Familial gastrointestinal stromal tumor syndrome: phenotypic and molecular features in a kindred / F.P. Li, J.A. Fletcher, M.C. Heinrich [et al.] // J. Clin. Oncol. — 2005. — Vol. 23. — P.2735—2743.
43. Zalcberg, J.R. EORTC Soft Tissue and Bone Sarcoma Group, the Italian Sarcoma Group; Australasian Gastrointestinal Trials Group. Outcome of patients with advanced gastrointestinal stromal tumors (GIST) crossing over to a daily imatinib dose of 800 mg after progression on 400 mg — an international, intergroup study of the EORTC, ISG and AGITG / J.R. Zalcberg, J. Verweij, P.G. Casali [et al.] // ProcAm. Soc. Clin. Oncol. — 2004. — Vol. 23. — P.815.
44. Demetri, G.D. Phase 3, multicenter, randomized, double-blind, placebo-controlled trial of SU11248 in patients following failure of imatinib for metastatic GIST / G.D. Demetri, A.T. van Oosterom, M. Blackstein [et al.] // ProcAm. Soc. Clin. Oncol. — 2005. — Vol. 23. — 308 p.
45. Dematteo, R.P. Clinical management of gastrointestinal stromal tumors: before and after STI-571 / R.P. Dematteo, M.C. Heinrich, W.M. el-Rifai [et al.] // Hum. Pathol. — 2002. — Vol. 33. — P.466—477.
46. Abdulkader, I. Pathological changes related to imatinib treatment in a patient with a metastatic gastrointestinal stromal tumour / I. Abdulkader, J. Cameselle-Teijeiro, J. Forteza // Histopathology. — 2005. — Vol. 46. — P.470—472.
47. Blay, J.Y. Prospective multicentric randomized phase III study of imatinib in patients with advanced gastrointestinal stromal tumors comparing interruption versus continuation of treatment beyond 1 year: the French Sarcoma Group / J.Y. Blay, A. Le Cesne, I. Ray-Coquard [et al.] // J. Clin. Oncol. — 2007. — Vol. 25. — P.1107—1113.
48. Dogan, S.S. Ocular Side Effects Associated with Imatinib Mesylate and Perifosine for Gastrointestinal Stromal Tumor / S.S. Dogan, B. Esmaeli // Hematol. Oncol. Clin. North. Am. — 2009. — Vol. 23(1). — P. 109—114.
49. Cerchione, C. Vitiligo-like lesions in an adult patient treated with Imatinib Mesylate / C. Cerchione, R. Fabbricini, F. Pane, L. Luciano // Leukemia Research. — 2009. — Vol. 33. — P.104—105.
50. Wolter, P. The clinical implications of sunitinib-induced hypothyroidism: a prospective evaluation / P. Wolter, C. Stefan, B. Decalionne [et al.] // British Journal of Cancer. — 2008. — Vol. 99. — P.448—454.
51. Alexandrescu, D.T. Persistent cutaneous hyperpigmentation after tyrosine kinase inhibition with imatinib for GIST / D. T. Alexandrescu, C.A. Dasanu, H. Farzanmehr, L. Kauffman // Dermatology Online Journal. — 2008. — № 4(7). — P.7.
52. Yokoyama, A. Two cases of primary unresectable and/or recurrent gastrointestinal stromal tumors of small intestine presenting hemoperitoneum caused by administration of imatinib mesylate / A. Yokoyama, N. Dairaku, M. Kusano [et al.] // Nippon Shokakibyo Gakkai Zasshi. — 2008. — Vol. 105. — P.1619—1626.
53. Chintalgattu, V. Cardiovascular Effects of Tyrosine Kinase Inhibitors Used for Gastrointestinal Stromal Tumors / V. Chintalgattu, S.S. Patel, A.Y. Khakoo // Hematol. Oncol. Clin. North. Am. — 2009. — № 3(1). — P.97—107.
54. Kelly, K. Serosal inflammation (pleural and pericardial effusions) related to tyrosine kinase inhibitors / K. Kelly, R. Swords, D. Mahalingam [et al.] // Targ. Oncol. — 2009. — № 4. — P.99—105.
55. Demetri, G.D. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors / G.D. Demetri, M. von Mehren, C.D. Blanke [et al.] // N. Engl. J. Med. — 2002. — Vol. 347. — P.472—480.
56. Loughrey, M.B. Gastrointestinal stromal tumor treated with neoadjuvant imatinib / M.B. Loughrey, C. Mitchell, M. Mann [et al.] // J. Clin. Pathol. — 2005. — Vol. 58. —779—781.
57. Pauwels, P. Changing phenotype of gastrointestinal stromal tumours under imatinib mesylate treatment: potential diagnostic pitfall / P. Pauwels, M. Debiec-Rychter, M. Stul [et al.] // Histopathoiogy. — 2005. — Vol. 47. — P.41—47.
58. Basu, S. Gastrointestinal stromal tumors (GIST) and laparoscopic resection / S. Basu, S. Balaji, D. Bennett, N. Davies // Surg. Endosc. — 2007. — Vol. 21. — P.1685— 1689.
59. Efremidou, E. Perforated GIST of the small intestine as a rare cause of acute abdomen: Surgical treatment and adjuvant therapy. Case report / E. Efremidou, N. Liratzopoulos, M. Papageorgiou, K. Romanidis // J. Gastrointestine Liver Dis. — 2006. — Vol. 15(3). — P.297—299.
60. Tsukuda, K. The outcome of gastrointestinal stromal tumors (GISTs) after a surgical resection in our institute / K. Tsukuda, R. Hirai, T. Miyake [et al.] // Surgery today. — 2007. — Vol. 37. — P.953—957.
61. Rossi, F. Oncogenic Kit signaling and therapeutic intervention in a mouse model of gastrointestinal tumor / F. Rossi, I. Ehlers, V. Agosti [et al.] // Proc. Natl. Acad. Sci. USA. — 2006. — Vol. 103. — P.12843—12848.
62. Sommer, G. Gastrointestinal stromal tumors in a mouse model by target mutation of the Kit receptor tyrosine kinase / G. Sommer, V. Agosti, I. Ehlers [et al.] // Proc. Natl. Acad. Sci. USA. — 2003. — Vol. 100. — P.6706—6711.
63. Bauer, S. Heat shock protein 90 inhibition in imatinib-resistant gastrointestinal tumor / S. Bauer, L.K. Yu, G.D. Demetri, J.A. Fletcher // Cancer Res. — 2006. —Vol. 66. — P.9153— 9161.
64. Tarn, C. Insulin-like growth factor 1 receptor is a potential therapeutic target for gastrointestinal stromal tumors / C. Tarn, L. Rink, E. Merkel [et al.] // PNAS. — 2008. — Vol. 105. — P.8387—8392.
65. Ponsaing, L. Therapeutic procedures for submucosal tumors in the gastrointestinal tract / L. Ponsaing, M.B. Hansen // World J. Gastroenterol. — 2007. — Vol. 13(24). —P.3316—3322.
66. Kim, T.W. Prognostic significance of c-kit mutation in localized gastrointestinal stromal tumors / T.W. Kim, H. Lee, Y.K. Kang [et al.] // Clin. Cancer Res. — 2004. — Vol. 10. — P.3076—3081.
67. Debiec-Rychter, M. Gastrointestinal stromal tumours (GISTs) negative for KIT (CD117 antigen) immunoreactivity / M. Debiec-Rychter, B. Wasag, M. Stul [et al.] // J. Pathol. — 2004. — Vol. 202. — P.430—438.
68. Buchdunger, E. Abl protein-tyrosine kinase inhibitor STI571 inhibits in vitro signal transduction mediated by c-kit and platelet derived growth factor receptors / E. Buchdunger, C.L. Cioffi, N. Law [et al.] // J. Pharmacol. Exp. Ther. — 2000. — 295. — P.139—145.
69. Kim, T. Kinase Mutations and Efficacy of Imatinib in Korean Patients with Advanced Gastrointestinal Stromal Tumors / T. Kim, M.H. Ryu, H. Lee [et al.] // The Oncologist. — 2009. — Vol. 14. — P.540—547.
70. Rabin, I. Gastrointestinal Stromal Tumors: A 19 Year Experience / I. Rabin, B. Chikman, R. Lavy [et al.] // IMAJ. — 2009. — Vol. 11. — P.98—102.
71. Fiore, M. Preoperative imatinib mesylate for unresectable or locally advanced primary gastrointestinal stromal tumors (GIST) / M. Fiore, E. Palassini, E. Fumagalli [et al.] // EJSO. — 2009. — Vol. 35. — P.739—745.
72. Holdsworth, C.H. CT and PET: early indicators of response to imatinib mesylate in patients with gastrointestinal stromal tumor / C.H. Holdsworth, R.D. Badawi, J.B. Manola [et al.] // AJR. — 2007. — Vol. 189. — P.W324—W330.
Подслизистые образования желудка: новый инструмент для дифференциальной диагностики гастроинтестинальных стромальных опухолей и лейомиом при компьютерной томографии с контрастным усилением | Мартиросян
1. Hamilton S.R., Lauri A.A. WHO classification of tumours. Pathology and genetics of tumours of the digestive system. 2000.
2. Burkill G.J., Badran M., Al-Muderis O., Meirion Th.J., Judson I.R., Fisher C., Moskovic E.C. Malignant gastrointestinal stromal tumor: distribution, imaging features, and pattern of metastatic spread. Radiology. 2003; 226 (2): 527–532. http://doi.org/10.1148/radiol.2262011880
3. Rodriguez S.A., Faigel D.O. Endoscopic diagnosis of gastrointestinal stromal cell tumors. Curr. Opinion Gastroenterol. 2007; 23 (5): 539–543. http://doi.org/10.1097/MOG.0b013e32829fb39f
4. Kang H.C., Menias C.O., Gaballah A.H., Shroff S., Taggart M.W., Garg N., Elsayes K.M. Beyond the GIST: mesenchymal tumors of the stomach. Radiographics. 2013; 33 (6): 1673–1690. http://doi.org/10.1148/rg.336135507
5. Goh P.M., Lenzi J.E. Benign tumors of the duodenum and stomach. Surgical Treatment: Evidence-Based and Problem-Oriented. Zuckschwerdt, 2001.
6. Casali P.G., Abecassis N., Bauer S., Biagini R., Bielack S., Bonvalot S., Boukovinas I., Bovee J.V., Brodowicz T., Broto J.M., Buonadonna A. Gastrointestinal stromal tumours: ESMO–EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2018; 29 (Suppl. 4): iv68–78.
7. Lee M.J., Lim J.S., Kwon J.E., Kim H., Hyung W.J., Park M.S., Kim M.J., Kim K.W. Gastric true leiomyoma: computed tomographic findings and pathological correlation. J. Comput. Assist. Tomogr. 2007; 31 (2): 204–208. http://doi.org/10.1097/01.rct.0000237812.95875.bd
8. Mchirgui L., Noomene R., Chammakhi C. J., Daghfous M.H. Gastrointestinal Stromal Tumors: Correlation of Multislice CT Findings to Histopathologic Features and Preliminary Validation of New Scoring System. Open J. Radiol. 2016; 6 (1): 29. http://doi.org/10.4236/ojrad.2016.61005
9. Choi J.W., Choi D., Kim K.M., Sohn T.S., Lee J.H., Kim H.J., Lee S.J. Small submucosal tumors of the stomach: differentiation of gastric schwannoma from gastrointestinal stromal tumor with CT. Korean J. Radiol. 2012; 13 (4): 425–433. http://doi.org/10.3348/kjr.2012.13.4.425
10. Choi Y.R., Kim S.H., Kim S.A., Shin C.I., Kim H.J., Han J.K., Кim S.H. Choi B.I. Differentiation of large (≥5 cm) gastrointestinal stromal tumors from benign subepithelial tumors in the stomach: radiologists’ performance using CT. Eur. J. Radiol. 2014; 83 (2): 250–260. http://doi.org/10.1016/j.ejrad.2013.10.028
Стромальная опухоль желудочно-кишечного тракта uMEDp
Введение
Гастроинтестинальные стромальные опухоли (gastrointestinal stromal tumours, GIST) являются наиболее частыми мезенхимальными опухолями желудочно-кишечного тракта (ЖКТ). Считается, что GIST происходят из клеток Кахала (Cajal), которые отвечают за моторику ЖКТ. В пользу этого говорит не только схожее гистологическое строение на ультраструктурном уровне, но и экспрессия гена c-kit как клетками Кахала, так и стромальными опухолями. Экспрессия гена c-kit, определяемая с помощью моноклонального антитела CD117, считается суррогатным маркером GIST. В 95% случаев GIST являются антиген-позитивными по CD117, однако при отрицательной реакции и исключении лейомиосаркомы может потребоваться молекулярно-генетический анализ с целью выявления антиген-негативной опухоли.
В 2001 г. для лечения больной с диссеминированной формой GIST впервые был применен препарат Гливек (иматиниб), который оказался чрезвычайно эффективным и вскоре стал широко применяться в качестве монотерапии заболевания, которое считалось нечувствительным к химиолучевому лечению. Практически сразу начали проводиться исследования по изучению эффективности Гливека в адъювантном и неоадъювантном режимах. В 2011 г. на съезде Американского общества клинической онкологии (American Society of Clinical Oncology, ASCO) было сообщено об эффективности 3-летней адъювантной терапии Гливеком у больных с высоким риском прогрессирования. Многочисленные исследования также показали, что основные гистологические характеристики (размер опухоли, локализация, митотический индекс), а также молекулярно-генетический статус являются важными факторами прогноза.
Так, например, пациенты с метастатической формой болезни и мутацией в 9-м экзоне гена c-kit получают выгоду в плане безрецидивной выживаемости, если сразу получают двойную дозу лекарства. Пациенты с крайне редкой мутацией D842V полностью нечувствительны к Гливеку. Несмотря на высокую эффективность терапии Гливеком, минорная часть больных демонстрирует первичную резистентность, а у большинства пациентов даже после многолетней успешной терапии наступает вторичная резистентность. В качестве выбора при прогрессировании патологического процесса дозу Гливека повышают с 400 до 800 мг либо осуществляют переход на препарат второй линии Сутент. Эффективность Сутента после приема Гливека составляет около 3–4 мес. и, как оказалось, также зависит от мутационного статуса. В качестве ингибиторов тирозинкиназ также исследуются нилотиниб, дазатиниб, сорафениб, регорафениб, ваталаниб, мазитиниб, пазопаниб, креноланиб. Ряд препаратов с иным механизмом действия проходят исследования II фазы [1, 2].
Основной механизм патогенеза развития GIST – мутации в генах c-kit и тромбоцитарного фактора роста (PDGFRA)
В 1998 г. S. Hirota и соавт. опубликовали в журнале Science статью «Доминантно-негативные мутации c-kit при гастроинтестинальных стромальных опухолях у человека» [3]. Среди 58 опухолей мезенхимального происхождения с помощью иммуногистохимического метода было выявлено 49 GIST. Также было показано, что экспрессия CD117 наблюдается не только на клетках опухоли, но и на клетках Кахала, что позволило высказать предположение о происхождении GIST именно из этих клеток. В 5 из 6 образцов опухолей авторы выявили мутацию в гене c-kit. В последующем подтвердилось, что мутация гена c-kit – это основной механизм развития GIST. В сентябре 1998 г. в Хельсинки, Финляндия, прошел первый международный симпозиум по изучению GIST, на котором присутствовали 23 делегата. На симпозиуме было высказано предположение о потенциальной эффективности ингибиторов c-kit при GIST.
Белок KIT, кодируемый геном c-kit, является членом семейства тирозинкиназ. В эту же группу входят альфа- и бета-рецепторы тромбоцитарного фактора роста (PDGFRA и PDRGFRB), рецептор колониестимулирующего фактора макрофагов (CSF1R) и рецептор цитокина Fl. Лигандом для KIT служит стволовый клеточный фактор (SCF). Результатами взаимодействия являются гомодимеризация рецептора и запуск киназной активации. При развитии GIST происходит независимая от наличия лиганда активация, что и приводит к развитию опухоли. Наиболее частая мутация происходит в 11-м экзоне гена, который кодирует внутриклеточный домен. При этом возможны различные типы мутаций: делеции, вставки, замены или комбинации. С делециями связан худший прогноз, для других типов мутаций характерно более благоприятное течение заболевания [4, 5].
Приблизительно в 10% случаев мутации происходят в 9-м экзоне гена c-kit, который кодирует внеклеточный домен белка. Киназный домен при мутации в 9-м экзоне похож на киназный домен при диком типе GIST, что предполагает чувствительность к терапии последних. Интересно, что мутации в 9-м экзоне встречаются практически исключительно в опухолях тонкой и толстой кишки, в опухолях желудка частота мутации – около 1% [6]. Мутации в экзонах 13 и 17 составляют 1–2% случаев. Предполагается, что данные экзоны отвечают за физиологическое подавление функции внутриклеточных доменов. Очевидно, что мутация гена является ключевой и начальной стадией заболевания. В дальнейшем запускается каскад самых различных сигнальных путей (MAPK, PI3K-AKT, MYC, mTOR). Исследования на клеточных линиях показали, что, в частности, подавление путей PI3K более эффективно по сравнению с ингибированием МАРК и mTOR [7].
Мутации в гене тромбоцитарного фактора роста встречаются в 5–10% случаев. Как и в случае с активацией рецептора KIT на мембране клеток, рецептор PDGFRA начинает активироваться без своего лиганда PDGFA, в результате чего запускается каскад реакций, схожих с реакциями, имеющими место при активации KIT [8]. Для подтверждения диагноза GIST панель иммуногистохимической реакции включает, кроме CD117, маркеры DOG1 и PKC-тета [9, 10].
В 10–15% случаев GIST не удается выявить мутации в генах c-kit и PDGFRA, таким образом, речь идет о диком типе этих генов. В то же время иммуногистохимически определяется экспрессия CD117, что говорит о запуске сигнальных путей, механизм которого не совсем ясен. В клинической практике часто проводится скрининг только на мутации в 11-м и 9-м экзонах, при отсутствии мутации формально предполагается дикий тип, а исследование на мутацию в 13-м или 17-м экзонах не проводится. Морфологически и макроскопически опухоли с диким типом ничем не отличаются от мутантных опухолей. В то же время тщательные исследования показали, что при диком типе выявляются другие механизмы активации и прогноз течения заболевания при этих опухолях также отличен от GIST с мутациями. Наиболее часто (в половине случаев) при диком типе выявляется повышенная экспрессия рецептора инсулинового фактора роста (IGF1R), который действует через сигнальные пути МАРК и PI3-AKT.
Интересно, что повышенная экспрессия IGF1R выявляется при забрюшинных саркомах и саркоме Юинга. Мутации в гене BRAF, которые более характерны для меланомы и рака щитовидной железы, выявляются при диком типе GIST в 13% случаев [11]. В ряде случаев при диком типе GIST удается обнаружить мутацию в гене сукцинатдегидрогеназы (SDH), который кодирует четыре субъединицы (SDHA, SDHB, SDHC, SDHD). Функция этого фермента – участие в цикле Кребса. Мутация указанного гена повышает риск развития не только GIST, но и синхронных параганглиом (синдром Карнея – Стратакиса, Carney – Stratakis syndrome) [12]. Механизм развития GIST при мутации гена сукцинатдегидрогеназы остается не совсем ясным, но предполагается, что фермент снижает активность пролилгидроксилазы, которая, в свою очередь, регулирует активность фактора, индуцируемого гипоксией (hypoxia-inducible factor, HIF1-альфа). В свою очередь HIF1-альфа является активатором для IGF2 и VEGF. Классификация GIST в зависимости от локализации мутации и чувствительность опухолей к препаратам представлены в таблице 1.
Эпидемиология гастроинтестинальных стромальных опухолей
До открытия мутации гена c-kit и использования маркера CD117 GIST расценивались как лейомиосаркомы. Согласно классификации и стадированию злокачественных опухолей, лейомиосаркомы желудка и тонкой кишки были отнесены к злокачественным опухолям указанных органов и, соответственно, «растворились» среди диагнозов «рак желудка» и опухолей тонкой кишки. Точная заболеваемость была неизвестна [13]. За последние годы во многих странах, особенно в тех, где ведутся канцер-регистры и часто сохраняются парафиновые блоки и стекла удаленных образцов, удалось прояснить эпидемиологию GIST. Так, наиболее полноценные исследования проведены в скандинавских странах (Норвегия, Швеция, Финляндия, Дания) [14, 15]. В этих странах ретроспективно были пересмотрены блоки «лейомиом» и «лейомиосарком» и в подавляющем большинстве случаев диагноз был изменен на GIST. Оказалось, что в среднем заболеваемость составляет 10–15 человек на 1 млн населения. В других европейских странах этот показатель был ниже, что, скорее всего, было связано с меньшим охватом населения скринингом и более низким уровнем доступности медицинской помощи.
Кроме того, тщательное морфологическое исследование образцов желудка у больных, умерших от других заболеваний, позволило обнаружить так называемые микро-GIST, размерами до 1–2 мм. В 2006 г. в журнале Human Pathology была опубликована статья японских морфологов, в которой говорилось о высокой частоте встречаемости GIST в желудке [16]. Авторы исследовали 100 желудков, удаленных по поводу рака. В 35 желудках были обнаружены 50 микроскопических опухолей, которые оказались положительными на экспрессию KIT и/или CD34. Большинство опухолей (90%) локализовалось в проксимальных отделах желудка, в 2 случаях GIST выявлены мутации гена c-kit. В 28 желудках выявлена 51 лейомиома. В 12 желудках обнаружено сочетание микроскопических GIST и лейомиом. Средний размер опухоли составил 1,5 мм. Авторы предположили, что GIST, по крайней мере его микроскопические формы, распространены гораздо шире, чем принято полагать. Вероятно, что в большинстве случаев они не достигают клинически значимых размеров и в ряде случаев склонны к спонтанной регрессии.
Кроме того, стоит подчеркнуть, что такая высокая частота встречаемости ни в коей мере не означает истинного распространения GIST желудка, поскольку исследование проведено на выборке рака желудка, где механизмы канцерогенеза в определенной мере сами по себе могут способствовать появлению стромальных опухолей. В Северной Америке самое крупное исследование по эпидемиологии GIST проведено E.A. Perez и соавт. [17]. В работу были включены базы данных регистра SEER (Surveillance, Epidemiology and End Results database), который охватывает около 17% населения США, и база данных онкологического регистра Флориды (Florida Cancer Data System), охватывающая около 6% населения Америки. Данные SEER обработаны с 1992 по 2005 г., регистра Флориды – с 1984 г. Было установлено, что в 1994 г. 93% опухолей расценивались как гладкомышечные опухоли и только 6% – как GIST. В 2002 г. уже 82% составляли GIST и только 17% – гладкомышечные опухоли. Пропорция GIST желудка была еще выше – 96% для SEER и 93% для популяции Флориды. Заболеваемость GIST увеличилась с 0,028 на 100 тыс. населения в 1992 г. до 0,688 на 100 тыс. населения в 2005 г. Авторы подчеркнули, что повышение заболеваемости связано как с явным улучшением диагностики, так и с улучшением скрининга. После 2000 г. опухоли желудка составляли 47% случаев, опухоли тонкой кишки – 34%. Интересно, что заболеваемость GIST у афроамериканцев выше, чем у белого населения.
Таргетная терапия метастатических форм GIST
В 2001 г. в журнале The New England Journal of Medicine вышло короткое сообщение под названием «Эффект тирозинкиназного ингибитора STI571 у пациентки с метастатической формой гастроинтестинальной стромальной опухоли». Автор статьи H. Joensuu из Хельсинки, Финляндия, привел клинический случай, когда пациентка лечилась от метастатической формы GIST. Больная 50 лет, многократно оперированная по поводу метастазов «лейомиосаркомы» желудка, в течение 2 лет безуспешно получала терапию препаратами месна, доксорубицин, ифосфамид, дакарбазин, талидомид и интерферон. В марте 2000 г. больная дала согласие на лечение препаратом STI571 (Гливек, иматиниб) в дозе 400 мг в сутки. Уже через 2 недели от начала лечения было зафиксировано уменьшение самого крупного метастаза в печени со 112 до 67 см2. К февралю 2001 г. отмечалась дальнейшая положительная динамика болезни, не появилось новых очагов и исчезли 6 из 28 печеночных метастазов [18]. Позднее больную из Финляндии назовут «пациент zero», а 2001 г. – началом эры таргетной терапии GIST. Именно с 2001 г. начались многочисленные международные исследования по эффективности Гливека в лечении GIST, а Норвегия, Швеция и Финляндия с присоединившейся Германией организовали скандинавскую группу, которая провела длительное исследование по адъювантной терапии стромальных опухолей.
Гливек начал применяться в 90-е годы прошлого столетия в качестве ингибитора тирозинкиназ для лечения хронического миелолейкоза благодаря способности ингибировать онкопротеин BCR-ABL. Впоследствии наблюдение, что белки BCR-ABL и KIT имеют структурную схожесть, инспирировало проведение исследований по использованию Гливека на клеточных линиях, в том числе и на клетках GIST [19]. Практически сразу же были инициированы протоколы по исследованию эффективности двойной дозы Гливека при метастатических формах заболевания. В целом Гливек был эффективен у 70–85% пациентов, медиана времени до прогрессирования составила 20–24 мес. [20].
Одно из первых рандомизированных исследований второй фазы (B2222 study) по изучению применения Гливека при метастатических формах GIST включало 147 больных [21]. Больные рандомизированы на группы, получавшие по 400 и 600 мг Гливека в сутки. В целом у 54% пациентов наблюдался частичный ответ, у 28% – стабилизация болезни. Медиана времени до объективного ответа составила 13 мес. По частоте ответа на лечение и его токсичности различий в группах не было установлено. В дальнейшем у 2 пациентов был отмечен полный эффект. Медиана времени до прогрессирования и общая выживаемость во всей группе составили 24 и 57 мес. соответственно. Различий в медиане до прогрессирования и общей выживаемости в зависимости от дозы препарата выявлено не было. Пятилетняя выживаемость у пациентов, ответивших на лечение, составила 55%, в то время как у пациентов с первичной резистентностью – только 9% [22]. Исследование В222 послужило основанием для одобрения Гливека Управлением по контролю за пищевыми продуктами и лекарственными препаратами США (Food and Drug Administration, FDA) в 2002 г. в качестве препарата первой линии при метастатических формах GIST.
Практически одновременно с исследованием В2222 стартовали два крупных международных протокола третьей фазы: Европейско-Австралийское (EORTC 6205) и Североамериканское (S0030) исследования по изучению эффективности применения двойной дозы Гливека (800 мг) в сравнении со стандартной дозой (400 мг) при метастатических формах GIST. Европейское исследование включало 946 пациентов, рандомизация проводилась на две группы: 400 и 800 мг в сутки с cross-over-дизайном в случае прогрессирования на дозе 400 мг. Токсичность 3–4-й степени наиболее часто наблюдалась при высокой дозе Гливека (32% и 50% соответственно), в этой же группе чаще отмечены снижение дозы и перерыв в приеме. Первичной целью Европейского протокола являлось время до прогрессирования, Североамериканского (включившего 746 больных) – общая выживаемость. В Европейском исследовании выявлено достоверное улучшение безрецидивной выживаемости при медиане наблюдения 25 мес., которое не привело к достоверному улучшению общей выживаемости при медиане наблюдения 40 мес. [23].
В Североамериканском протоколе не было установлено достоверных различий ни относительно безрецидивной, ни относительно общей выживаемости при медиане наблюдения 54 мес. [24]. Интересно, что в обоих исследованиях была продемонстрирована почти одинаковая стабилизация болезни при cross over – 29% и 28% соответственно. В Европейском исследовании мутационный статус опухоли был оценен у 377 больных. Установлена лучшая безрецидивная и общая выживаемость у пациентов с мутацией в 11-м экзоне по сравнению с мутацией в 9-м экзоне и диким типом. У пациентов с мутацией в 9-м экзоне отмечен лучший эффект в отношении безрецидивной выживаемости по сравнению с другими подгруппами больных. В Североамериканском исследовании мутационный статус оценен у 397 больных. Были получены схожие результаты, однако повышенная доза Гливека у больных с мутацией в 9-м экзоне не отразилась на улучшении безрецидивной и общей выживаемости. В 2010 г. M. van Glabbeke опубликовал результаты метаанализа, объединив Европейско-Австралийское и Североамериканское исследования [20].
Автор подчеркнул, что, несмотря на схожие критерии отбора, в Североамериканском протоколе пациенты были более старшего возраста и с худшим общесоматическим статусом, более низкими показателями лейкоцитов, нейтрофилов, тромбоцитов, с лучевой терапией в анамнезе, но меньшей предшествующей химиотерапией по сравнению с Европейским протоколом. Метаанализ показал небольшое, но достоверное улучшение времени до прогрессирования при двойной дозе Гливека (p = 0,04 Wald test), но отсутствие различий в таком показателе, как общая выживаемость (p = 0,97). Субпопуляционный анализ показал достоверное улучшение времени до прогрессирования при применении у пациентов с мутацией в 9-м экзоне (p = 0,017), которое, однако, не трансформировалось в достоверное улучшение общей выживаемости (p = 0,15). Медиана времени до прогрессирования у всех пациентов составила 19 мес., у пациентов с мутацией в 9-м экзоне при двойной дозе Гливека – 19 мес., при дозе 400 мг – только 6 мес. Одним из заключений автора метаанализа явилось предположение, что неоадъювантная терапия у пациентов с мутацией в 9-м экзоне при местнораспространенных опухолях обоснована в плане уменьшения опухоли в размерах и улучшения результатов хирургического лечения.
Высокая эффективность Гливека породила убеждение, что возможно полное излечение больных с GIST: возникло желание прекратить прием препарата после успешной длительной ремиссии. В 2002 г. французскими исследователями инициировано рандомизированное исследование III фазы BFR14, которое поставило вопрос о продолжительности приема Гливека у больных с метастатической формой болезни. Больные были рандомизированы на группы постоянного приема препарата (C-group, continuous) и окончания приема через год успешного лечения Гливеком (S-group, stop). Дизайн подразумевал возобновление приема Гливека в S-группе в случае прогрессирования. В исследование было включено 58 пациентов. В последующем этот протокол трансформировался в рандомизацию С- и S-групп через 3 года (50 пациентов) и через 5 лет (25 пациентов). В stop-группе каждый раз после окончания приема Гливека достоверно быстрее наступало прогрессирование [25–27]. Так, через 5 лет после рандомизации ни у одного из 12 пациентов, вошедших в С-группу, не отмечено рецидивов, в S-группе – 7 рецидивов из 20 (р = 0,0317). Авторы сделали вывод, что пациенты с метастатической болезнью должны получать Гливек постоянно до прогрессирования либо до наступления непереносимости препарата. Достоверных различий в общей выживаемости между двумя группами не было. Таким образом, окончание приема лекарства даже после длительного успешного применения ассоциируется с быстрым прогрессированием болезни.
Нео- и адъювантная терапия GIST
Первый опыт применения Гливека при GIST во всех странах показал высокую эффективность препарата. Первые протоколы изучали метастатические формы болезни, затем почти одновременно были инициированы исследования по адъювантной и неоадъювантной терапии. К 2011 г. были накоплены данные, показавшие 25%-ную выживаемость за 9 лет при метастатической форме болезни [1] и эффективность трехлетней адъювантной терапии после радикальных операций [28, 29].
Основной целью предоперационной терапии большинство авторов считали уменьшение размеров опухоли. В частности, теоретически оправдана неоадъювантная терапия при локализации GIST в двенадцатиперстной и прямой кишке. Ретроспективный анализ 46 пациентов с первичными и рецидивными опухолями показал, что при применении Гливека в предоперационном режиме увеличивался шанс на полное удаление опухоли [30]. В рамках исследования пациентам выполняли компьютерную томографию каждые 2–3 мес. для оценки степени уменьшения опухоли. Одиннадцать из 46 больных получали терапию до операции с медианой 11,9 мес. При медиане наблюдения 19,5 мес. у 11 больных не наблюдалось признаков заболевания. В другом проспективном исследовании из 36 пациентов у 33 при медиане 11 мес. в предоперационном режиме размер опухоли в среднем уменьшился с 10,5 до 5,5 см. При этом 83% изначально неоперабельных пациентов стали операбельными [31]. Очевидно, что целесообразность применения Гливека до операции должна оцениваться вместе с хирургом и должна учитываться возможность уменьшить размеры опухоли, особенно при ее локализации в непосредственной близости к кардии, в двенадцатиперстной и прямой кишке.
Эффективность применения таргетной терапии при метастатических формах GIST не могла не инициировать исследования по адъювантной терапии GIST. Одно из самых крупных рандомизированных (плацебоконтролируемое, двойное слепое) исследований по адъювантной терапии GIST (ACOSOG Z9001) было проведено в США. С 2002 по 2007 г. в исследовании участвовали 230 клиник США и Канады. Критериями включения были следующие показатели: опухоль более 3 см в диаметре, радикальная (либо R1) операция, возраст пациента более 18 лет, CD117-положительная опухоль. При возникновении рецидива болезни «ослепление» прекращалось и больным из плацебо-группы предлагалось лечение Гливеком. Рандомизация была проведена у 713 пациентов.
В группе лечения Гливеком наблюдалось 30 событий и 5 летальных исходов от разных причин без рецидива. В группе плацебо зафиксировано 70 событий, при этом 69 возвратов болезни, 1 летальный исход без рецидива, 7 летальных исходов после развития рецидива болезни, 5 – от прогрессирования GIST, 2 – от других причин. Надо отметить, что первые промежуточные результаты этого исследования были опубликованы в 2007 г. При этом было установлено, что адъювантная терапия Гливеком в течение года способствовала улучшению показателей безрецидивной выживаемости с 83% в контрольной группе до 97% в группе лечения. Отсутствие различий в общей выживаемости объяснялось коротким сроком наблюдения и назначением терапии Гливеком в случае развития рецидива болезни. В 2009 г. опубликованы результаты трехлетнего наблюдения за больными [32]. Интересно, что даже в группе низкого риска рецидива были зафиксированы случаи рецидивов заболевания.
В группе высокого риска рецидива (опухоли более 10 см в диаметре) адъювантная терапия показала наиболее высокую эффективность, тем не менее после окончания приема Гливека у больных с высоким риском рецидива вновь стали отмечаться рецидивы заболевания. При сравнении с группой исторического контроля адъювантная терапия достоверно улучшала не только безрецидивную, но и общую выживаемость у больных с высоким риском рецидива. Исследователи предположили, что пациентам с высоким риском показана более продолжительная терапия Гливеком в адъювантном режиме. Учитывая высокую эффективность Гливека в улучшении безрецидивной выживаемости, в декабре 2008 г. в США и в 2009 г. в Европе и России препарат одобрен в качестве адъювантной терапии при CD117-положительных гастроинтестинальных стромальных опухолях. Субпопуляционный анализ, представленный на ASCO в 2010 г., показал, что наибольшую выгоду от адъювантной терапии в плане улучшения безрецидивной выживаемости получают больные с мутацией в 11-м экзоне [33].
В европейском исследовании (EORTC 62024) около 900 пациентов после радикальной операции по поводу GIST с высоким и промежуточным риском рецидива заболевания рандомизировали в 2 группы: группа больных, получавших адъювантную терапию 400 мг Гливека в сутки в течение 2 лет, сравнивалась с группой наблюдения, пациенты которой получали плацебо. Кроме того, планировалось изучить общую и безрецидивную выживаемость. Набор больных начался в 2004 г. и закончился в 2008 г. Результаты исследования ожидаются в ближайшее время.
В скандинавском исследовании (Scandinavian Sarcoma Group) совместно с Германией изучалась эффективность адъювантнтой терапии в течение 1 года и 3 лет после радикальной операции у пациентов с высоким риском рецидива. Исследование началось в 2004 г. и длилось семь лет. Пациенты были рандомизированы в 2 группы: курс лечения проводился в течение одного года и в течение трех лет. Включение больных в исследование осуществлялось согласно критерию С. Fletcher: размер опухоли больше 10 см или митотический индекс больше 10 в 50 полях зрения при большом увеличении; размеры опухоли больше 5 см и митотический индекс больше 5, разрыв опухоли. Опухоль должна была быть позитивной по экспрессии CD117. Оценивались безрецидивная выживаемость (время от рандомизации до рецидива болезни или смерти), общая выживаемость и безопасность лечения. Всего в исследование было включено 400 пациентов.
Безрецидивная выживаемость в группе трехлетней адъювантной терапии была значительно больше по сравнению с группой однолетней адъювантной терапии (рПервичная и вторичная резистентность к Гливеку
В терапии GIST различают первичную и вторичную резистентность. Отсутствие чувствительности к Гливеку в течение первых 6 мес. считается первичной резистентностью. Она отмечается приблизительно у 10% больных. Первые же протоколы анализировали эффективность терапии в зависимости от мутационного статуса. Было отмечено, что тип мутации влияет на первичную резистентность: при мутации в 11-м экзоне – 5%, в 9-м экзоне – 16%, при диком типе – 2–3% [34]. В то же время относительная резистентность опухолей с мутацией в 9-м экзоне может быть связана с недостаточной дозой Гливека [20]. Исследования in vitro и клинические результаты показали, что больные с мутацией D842V абсолютно не чувствительны к Гливеку и в случае метастатической болезни имеют плохой прогноз. Пациенты с другими мутациями в гене PDGFRA в большинстве случаев чувствительны к терапии и демонстрируют продолжительный эффект на Гливеке. Поскольку при диком типе найдены иные механизмы прогрессии, то предполагается, что эффект может наступить от других таргетных препаратов: ингибиторов VEGFR – для педиатрических GIST, сукцинатдегидрогеназы – для SDH-мутантных, BRAF – для BRAF-мутантных GIST [35].
Несмотря на высокую эффективность терапии Гливеком при отсутствии первичной резистентности, у подавляющего большинства больных развивается вторичная резистентность к препарату. Вторичные мутации развиваются в том же самом гене, что и первичные мутации. При диком типе вторичные мутации не выявляются. Большинство вторичных мутаций KIT представлены точечными заменами одного нуклеотида, которые локализуются в тирозинкиназных доменах KIT и PDGFRA и в киназ-связывающих доменах KIT (15-й и 16-й экзоны). Как правило, вторичные мутации отличаются от первичных. Эти мутации могут определяться как единичные или как несколько клонов со специфической мутацией в одном опухолевом узле. С клинической точки зрения важно отметить, что количество вторичных мутаций может достигать 7 у одного пациента в различных метастазах [36]. Выраженная гетерогенность опухолевых клонов заставила отказаться от пункции метастазов при прогрессировании опухоли на фоне Гливека с целью определения «мишени» при прогрессировании. При диком типе привлекательной мишенью может быть IGF1R, гиперэкспрессия которого наблюдается при данном виде GIST и не зависит от KIT-мутации [37].
Препараты второй линии терапии и новые подходы
Для пациентов с первичной или вторичной резистентностью к Гливеку единственным препаратом второй линии лечения является сунитиниб (Сутент). Сунитиниб – пероральный ингибитор тирозинкиназ с эффективностью в отношении KIT, рецептора сосудистого фактора роста (VEGFR), тромбоцитарного фактора роста (PDGFR), рецептора макрофагального колониестимулирующего фактора (CSF-1R). Исследования ранних фаз по применению Сутента показали эффективность в отношении GIST с большинством видов мутаций [38]. Последние данные показали, что медианы до прогрессирования и общей выживаемости были дольше у пациентов с мутацией в 9-м экзоне и диким типом по сравнению с пациентами с мутацией в 11-м экзоне [39]. В крупном рандомизированном исследовании III фазы изучалась эффективность Сутента в сравнении с плацебо среди 312 пациентов с первичной резистентностью или непереносимостью Гливека.
Медиана времени до прогрессирования (TTP) составила 27,3 недели для пациентов, получающих Сутент, и 6,4 недели для группы плацебо (p
P. Rutkowski и соавт. в недавнем сообщении представили данные одноцентрового исследования, включавшего 137 пациентов с метастатической формой GIST Сутентом после прогрессирования на фоне терапии Гливеком [41]. Одногодичная выживаемость больных составила 42%. Общая выживаемость, рассчитанная от начала приема Гливека и Сутента, составила соответственно 74 недели и 51 месяц. Лучший ответ на терапию Сутентом отмечен у больных с мутацией в 9-м экзоне и при диком типе (медиана выживаемости 65,5 и 50,5 недели) по сравнению с мутацией в 11-м экзоне или PDGFRA (36,8 и 9 недель соответственно). Кроме того, вторым независимым фактором прогноза, достоверно влияющим на безрецидивную и общую выживаемость в одно- и многофакторном анализе, явилась артериальная гипертензия: пациенты, у которых фиксировался данный побочный эффект терапии Сутентом, жили достоверно дольше.
Ингибиторы тирозинкиназ нового поколения активно применяются для лечения хронического миелолейкоза и уже одобрены в качестве препаратов первой или второй линии терапии. Соответственно, оправдана попытка их применения и для лечения гастроинтестинальных стромальных опухолей. Нилотиниб (Тасигна) – пероральный ингибитор тирозинкиназ, активный в отношении KIT, PDGFRA и BCR-ABL, оказывающий схожее с Гливеком и Сутентом действие. Концентрация препарата внутри клетки в 7–10 раз выше, чем концентрация Гливека [42]. Нилотиниб исследовался в качестве препарата третьей линии терапии после иматиниба и сунитиниба [43]. В целом препарат показал хорошую переносимость, побочные эффекты – анорексия, тошнота и рвота, диарея. В качестве препарата первой линии лечения нилотиниб проявил эффективность у 12 из 14 пациентов: в виде частичного эффекта и стабилизации у 43% больных [44]. Ожидаются результаты прямого сравнения эффективности иматиниба и нилотиниба, однако, по-видимому, такого выраженного эффекта, как от препаратов, применяемых для лечения хронического миелолейкоза в качестве препаратов нового поколения, ожидать уже не приходится.
Другие таргетные препараты, ингибирующие тирозинкиназы (но не VEGFR), – мазатиниб и дазатиниб. Ингибиторы тирозинкиназ, активные не только в отношении KIT и PDGFR, но и подавляющие VEGFR: сорафениб, мотезаниб, ваталаниб – проходят исследования второй фазы. Бевацизумаб – моноклональное антитело, блокирующее VEGFR, – изучается в качестве дополнения к Гливеку в III фазе исследования. Изучаются и лекарства с непрямым механизмом действия – ингибиторы белка теплового шока (IPI-504) и механизма PI3K/AKT/mTOR (эверолимус). Многообразие вышеуказанных таргетных препаратов говорит о следующем. Несмотря на эффективность одного таргетного препарата (Гливек), рано или поздно опухоль находит новые пути развития. Возникает необходимость блокирования этих путей другими таргетными агентами (табл. 2). Поскольку потенциальных путей «ускользания» заболевания достаточно много, список возможных лекарств также расширяется, либо нужно отдавать предпочтение препарату с множественным механизмом действия, но тогда понятие «таргетная терапия» в известной мере размывается. Кроме того, множественный механизм действия неизбежно ведет за собой более тяжелые побочные эффекты препарата.
Заключение
Десятилетний опыт применения таргетной терапии гастроинтестинальных стромальных опухолей продемонстрировал небывалый успех в онкологии. Впервые в диагностике и лечении солидных опухолей удалось не только выявить ключевой механизм патогенеза, но и подобрать высокоточное «оружие» к «мишени» (англ. target – мишень). Применение Гливека улучшило выживаемость больных с метастатической формой болезни в три раза. Предоперационная терапия позволила улучшить результаты лечения при местнораспространенных формах. Адъювантная терапия снизила риск рецидива и увеличила общую выживаемость пациентов. Стромальные опухоли обладают выраженной гетерогенностью по мутационному статусу, который является фактором прогноза и, по возможности, должен выполняться всем больным. Развитие вторичных мутаций и прогрессирование на фоне лечения препаратом первой линии диктуют необходимость изменения тактики лечения и поиска новых путей блокады опухолевой прогрессии.
Лапароскопическое удаление гастроинтестинальной стромальной опухоли (gist) желудка
Гастроинтестинальные стромальные опухоли (GIST) являются одними из наиболее частных мезенхимальных опухолей желудочно-кишечного тракта, составляя 1-3% всех новообразований желудка и кишечника. Диагностика этих опухолей сложна и выбор метода лечения является дискутабельным до настоящего времени.
Мы представляем случай GIST желудка у пациента 70 лет, который обратился в клинику с жалобами на ощущение тяжести в эпигастии, тошноты, отрыжку съеденной пищей. При эндоскопическом исследовании по задней стенке антрального отдела желудка обнаружено округлой формы подслизистое образование размерами до 5х4 см, которое практически полностью перекрывает выход их желудка. Слизистая оболочка над образованием не изменена. При эндосонографии в подслизистом слое стенки желудка выявлено изоэхогенное образование овальной формы с четким контуром и гиперэхогенной капсулой, однородное, с анэхогенными трубчатыми структурами до 0,3 см, размер образования — 36х30мм. Взята тонкоигольная биопсия, патогистологически – подозрение на GIST.
Для уточнения расположения, природы образования и выявления поражения регионарных лимфоузлов и отдаленных метастазов выполнены МСКТ брюшной полости и грудной клетки и МРТ брюшной полости. На МСКТ в области выходного отдела желудка выявлено внутрипросветное экзофитное гиперваскулярное образование округлой формы с ровными контурами, несколько неоднородно накапливающее контрастное средство, размером до 53 мм, которое деформирует медиальный контур выходного отдела желудка. Также обнаружен одиночный перигастральный лимфоузел над дном желудка размером 12 мм по короткой оси. С помощью МРТ уточнено расположение и природа как основного образования, так и второго образования в субкардиальном отделе: По данным МРТ образование с четкими контурами, однородной структуры, по характеру сигнала и диффузии близкое характеру сигнала и диффузии селезенки. Вдоль малой кривизны в субкардиальном отделе определяется аналогичное экзофитное образование до 1,2 см.
В результате обследования установлен диагноз: GIST(?) антрального отдела и тела желудка, компенсированный стеноз выхода из желудка.
Больному выполнено лапароскопическое удаление опухолей желудка. Опухоль по малой кривизне, на 3 см ниже пищеводно-желудочного перехода на ножке, округлой формы, диаметром 1 см, отделена от желудка ультразвуковым скальпелем, извлечена через 12мм троакар, дефект в серозно-мышечной оболочке ушит. В антральном отделе опухоль по задней стенке размерами до 5 см. Антральный отдел мобилизован по большой кривизне, опухоль прорастает до серозного слоя, к ней идет питающая артерия от малой кривизны желудка, которая клиппирована и пересечена. Мышечную оболочку желудка рассекли ультразвуковым скальпелем до подслизистого слоя окаймляющим разрезом, отступив на 1 см от ее края, опухоль удалена в капсуле подслизисто с сохранением целостности слизистой оболочки. Серозно-мышечный слой ушит отдельными узловыми швами викрилом в поперечном направлении. Макропрепарат удален через разрез в правой боковой области живота до 4 см в пластиковом контейнере.
Послеоперационный период проходил без особенностей. Выписан на 4 сутки после операции. Патогистологическое и иммуногистохимическое исследование: гастроинтестинальная стромальная опухоль (GIST) без экспрессии CD 117 c-kit. Пролиферативный индекс Ki67 (IVAK-2) — 11%. Обследован через 4 месяца после операции – рецидива опухоли и прогрессирования болезни нет.
Вывод: Гастроинтестинальные стромальные опухоли желудка требуют комплексного обследования для определения лечебной тактики. Лапароскопическое удаление таких опухолей является способом выбора хирургического лечения.
Опубликована в «Клінічна хірургія». – 2012. — №10 (додаток). – С. 35.
Видео с презентацией по это ссылке.
СТРОМАЛЬНЫЕ ОПУХОЛИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА (ГИСО): ОПЫТ ДИАГНОСТИКИ И ЛЕЧЕНИЯ | Богомолов
1. Богомолов Н.И. Редкая причина гастродуоденального кровотечения // Забайкальский медицинский вестник. — 2006. — № 2. — С. 57-58. Bogomolov NI. (2006). Rare reason of gastroduodenal bleeding [Redkaya prichina gastroduodenal’nogo krovo-techeniya]. Zabaykal’skiy meditsinskiy vestnik, (2), 57-58.
2. Богомолов Н.И., Кузнецова И.А., Чарторижская Н.Н., Прохоров Н.Б., Пахольчук П.П., Орлов А.А., Мартиросян Г.Ч., Синицын А.С., Скажутина Л.Н., Мусорина В.П., Курносов В.Д. GIST — гастроинтестинальные стромальные опухоли: опыт диагностики и лечения // Забайкальский медицинский вестник. — 2010. -№ 2. — С. 32-35. Bogomolov NI, Kuznetsova IA, Chartorizhskaya NN, Prokhorov NB, Pakholchuk PP, Orlov AA, Martirosyan GC, Sinitsyn AS, Skazhutina LN, Musorina VP, Kurnosov VD. (2010). GIST — gastrointestinal stromal tumors: experience of diagnostics and treatment [GIST — gastrointestinal’nye stromal’nye opukholi: opyt diagnostiki i lecheniya]. Zabaykal’skiy meditsinskiy vestnik, (2), 32-35.
3. Дубова Е.А., Щеголев А.И., Мишнев О.Д., Карма-зановский Г.Г. Гастроинтестинальные стромальные опухоли (лекция) // Медицинская визуализация. -2007. — № 1. — С. 25-31. Dubova EA, Shchegolev AI, Mishnev OD, Karmazanovs-kiy GG. (2007). Gastrointestinal stromal tumors (lecture) [Gastrointestinal’nye stromal’nye opukholi (lektsiya)]. Meditsinskaya vizualizatsiya, (1). 25-31.
4. Егоров В.И., Кармазановский Г.Г., Щеголев В.А., Дубова Е.А., Яшина Н.И., Осипова Н.Ю., Степанова Ю.А., Солодинина Е.Н. Значение предоперационной визуализации для выбора хирургической тактики при гастроинтестинальных стромальных опухолях двенадцатиперстной кишки // Медицинская визуализация. — 2007. — № 2. — С. 34-43. Egorov VI, Karmazanovskiy GG, Shchegolev VA, Dubova EA, Yashina NI, Osipova NYu, Stepanova YuA, Solodinina EN. (2007). Significance of preoperative visualization for choosing surgical tactics for gastrointestinal stromal duodenum tumors [Znachenie predoperatsionnoy vizualizatsii dlya vybora khirurgicheskoy taktiki pri gas-trointestinal’nykh stromal’nykh opukholyakh dvenadtsati-perstnoy kishki]. Meditsinskaya vizualizatsiya, (2), 34-43.
5. Егоров В.И., Кубышкин В.А., Вишневский В.А., Щеголев А.И., Кармазановский Г.Г., Яшина Н.И., Степанова Ю.А., Солодинина Е.Н., Дубова Е.А. Гастроинтестинальные стромальные опухоли двенадцатиперстной кишки // Хирургия. Журнал им. Н.И. Пирогова. -2007. — № 10. — С. 66-72. Egorov VI, Kubyshkin VA, Vishnevskiy VA, Shchego-lev AI, Karmazanovskiy GG, Yashina NI, Stepanova YuA, Solodinina EN, Dubova EA. (2007). Gastrointestinal stromal tumors of duodenum [Gastrointestinal’nye stro-mal’nye opukholi dvenadtsatiperstnoy kishki]. Khirurgiya. Zhurnal im. N.I. Pirogova, (10), 66-72.
6. Кригер А.Г., Старков Ю.Г., Кармазановский Г.Г., Берелавичус С.В., Горин Д.С., Солодкий А.В., Вет-шева Н.Н., Курушкина Н.А. Диагностика и тактика хирургического лечения гастроинтестинальной стро-мальной опухоли // Хирургия. Журнал им. Н.И. Пирогова. — 2014. — № 1. — С. 15-20. Kriger AG, Starkov YuG, Karmazanovskiy GG, Berelavichus SV, Gorin DS, Solodkiy AV, Vetsheva NN, Ku-rushkina NA. (2014). Diagnostics and tactics of surgical treatment of gastrointestinal stromal tumor [Diagnostika i taktika khirurgicheskogo lecheniya gastrointestinal’noy stromal’noy opukholi]. Khirurgiya. Zhurnal im. N.I. Pirogova, (1), 15-20.
7. Маландин А.Г., Меркулов И.А., Иванов Ю.В., Пастухов А.И. Гастроинтестинальные стромальные опухоли (GIST): особенности диагностики и лечения // Хирургия. Журнал им. Н.И. Пирогова — 2012. — № 3. — С. 32-41. Malandin AG, Merkulov IA, Ivanov YuV, Pastukhov AI. (2012). Gastrointestinal stromal tumors (GIST): features of diagnostics and treatment [Gastrointesti-nal’nye stromal’nye opukholi (GIST): osobennosti diagnostiki i lecheniya]. Khirurgiya. Zhurnal im. N.I. Pirogova, (3), 32-41.
8. Овчинников В.А., Абелевич А.И., Володин А.Н., Артифексова А.А., Кузнецов С.С. Гастроинтестинальные стромальные опухоли: клинические маски, диагностика, лечение // Хирургия. Журнал им. Н.И. Пирогова. — 2009. — № 7. — С. 63-65. Ovchinnikov VA, Abelevich AI, Volodin AN., Ar-tifeksova AA, Kuznetsov SS. (2009). Gastrointestinal stromal tumors: clinical masks, diagnostics, treatment [Gastrointestinal’nye stromal’nye opukholi: klinicheskie maski, diagnostika, lechenie]. Khirurgiya. Zhurnal im. N.I. Pirogova, (7), 63-65.
9. Патологическая анатомия: национальное руководство / Под. ред. М.А. Пальцева, Л.В. Кактурского, О.В. Зайратьянца. — М.: ГЭОТАР-Медиа, 2011. — 1264 с. Paltsev MA, Kakturskiy LV, Zayratyants OV. (eds.). (2011). Pathological anatomy: national guidelines [Pato-logicheskaya anatomiya: natsional’noe rukovodstvo]. Moskva, 1264 p.
10. Стромальные опухоли желудочно-кишечного тракта (GIST). Клиническая монография. — Тверь: ООО «Изд-во «Триада», 2006. — 40 с. Gastrointestinal stromal tumors (GIST). (2006). [Stromal’nye opukholi zheludochno-kishechnogo trakta (GIST)]. Tver, 40 p.
11. Hamilton S.R., Aaltonen L.A. (2002). World Health Organization classification of tumors. Tumors of the digestive system. Lyon, 314 p.
12. Mazur M.T., Clark H.B. (1983). Gastric stromal tumors: reappraisal of histogenesis. Am J Surg Pathol, 7, 507-519.
Особенности диагностики и лечения стромальных опухолей желудочно-кишечного тракта | Богомолов
1. Mazur M.T., Clark H.B. Gastric stromal tumors: reappraisal of histogenesis. Am J Surg Pathol 1983; 7:50719.
2. Патологическая анатомия: Национальное руководство /Гл. ред. М.А. Пальцев, Л.В. Кактурский, О.В. Зайратьянц. М.: ГЭОТАР-Медиа; 2011. 1264 с.
3. Стромальные опухоли желудочно-кишечного тракта (GIST). Тверь: Триада; 2006. 40 с. // http://www. triada.tver.ru.
4. Hamilton S.R., Aaltonen L.A. World Health Organization Classification of Tumors. Tumors of the digestive system / Ed. Lyon; 2002. 314 p.
5. Халиков Д.Д., Ахметзянов Ф.Ш., Петров С.В. Клинико-морфологическая характеристика гастроинтестинальных стромальных опухолей. Арх патол 2017;79(4): 48-55.
6. Дубова Е.А., Щеголев А.И., Мишнев О.Д., Кармазановский Г.Г. Гастроинтестинальные стромальные опухоли (лекция). Мед визуализация 2007; 1:25-31.
7. Егоров В.И., Кармазановский Г.Г., Щеголев В.А., Дубова Е.А., Яшина Н.И., Осипова Н.Ю., Степанова Ю.А., Солодинина Е.Н. Значение предоперационной визуализации для выбора хирургической тактики при гастроинтестинальных стромальных опухолях двенадцатиперстной кишки. Мед визуализация 2007;2:34-43.
8. Егоров В.И., Кубышкин В.А., Вишневский В.А., Щеголев А.И., Кармазановский Г.Г., Яшина Н.И., Степанова Ю.А., Солодинина Е.Н., Дубова Е.А. Гастроинтестинальные стромальные опухоли двенадцатиперстной кишки. Хирургия 2007;10:66-72.
9. Кригер А.Г., Старков Ю.Г., Кармазановский Г.Г., Берелавичус С.В., Горин Д.С., Солодкий А.В., Ветшева Н.Н., Курушкина Н.А. Диагностика и тактика хирургического лечения гастроинтестинальной стромальной опухоли. Хирургия 2014;1:15-20.
10. Маландин А.Г., Меркулов И.А., Иванов Ю.В., Пастухов А.И. Гастроинтестинальные стромальные опухоли (GIST): особенности диагностики и лечения. Хирургия 2012;3:32-41.
11. Овчинников В.А., Абелевич А.И., Володин А.Н. и др. Гастроинтестинальные стромальные опухоли: клинические маски, диагностика, лечение. Хирургия 2009; 7:63-5.
12. Кащенко В.А., Карачун А.М., Орлова Р.В. и др. Особенности хирургического подхода в лечении гастроинтестинальных стромальных опухолей. Вестн хир 2017;176(2):22-7.
13. Богомолов Н.И., Пахольчук П.П., Томских Н.Н., Гончаров А.Г., Гончарова М.А., Голякова А.С. Стромальные опухоли желудочно-кишечного тракта (ГИСО): опыт диагностики и лечения. Acta Biomed Scient 2017;2(6):52-8.
14. Богомолов Н.И. Редкая причина гастродуоденального кровотечения. Забайкальск мед вестн 2006;2:57-8.
15. Богомолов Н.И., Кузнецова И.А., Чарторижская Н.Н., Прохоров Н.Б., Пахольчук П.П., Орлов А.А., Мартиросян Г.Ч., Синицын А.С., Скажутина Л.Н., Мусорина В.П., Курносов В.Д. GIST — гастроинтестинальные стромальные опухоли: опыт диагностики и лечения. Забайкальск мед вестн 2010;2:32-5.
SIU SOM Гистология GI
SIU SOM Гистология GIЖелудок
Наиболее заметной тканью желудка является железистая железа толщиной . слизистая оболочка , наполненная желудочными железами, которые секретируют пищеварительные ферменты и кислота.
толстая слизистая оболочка желудка характеризуется плотно упакованными трубчатыми железами под поверхностью простого столбчатого эпителия.
поверхность вдавлена в многочисленные короткие желудочные ямы , которые свободно открываются в просвет. Вся поверхность состоит равномерно из поверхностных слизистых клеток, которые защитить желудок от самопереваривания.
Неспособность поверхностных слизистых клеток защитить желудок стенка может привести к язве . См. WebPath (низкий mag), WebPath (high mag), или Цветной Атлас Миликовски и Бермана по базовой гистопатологии , стр.240-241.
Желудочный железы составляют основную часть слизистой оболочки под ямками. Хотя lamina propria разделяет отдельные железы, большую часть объема слизистой оболочки занят секреторными клетками, в первую очередь париетальными ячейки и главные ячейки.
Подслизистая оболочка желудка относительно неспециализированный.
Наружная мышца желудка толще, чем где-либо в тракте.Гладкие мышечные волокна мускулистой мышцы может образовывать косой слой в дополнение к внутреннему кольцевому и внешние продольные слои, характеризующие остальную часть тракта. Множественные слои часто трудно различить микроскопически, потому что в любом заданном разделе будет вырезан только один из слоев (максимум) в поперечном сечении, а остальные будут более или менее наклонными.
Как и в других частях тракта, серозная оболочка желудка обычно без особенностей.
С их трубчатая форма и слизисто-секреторная поверхность, желудочные ямки имеют отчетливо железистый вид. Однако поскольку один одноклеточный тип, поверхность слизистых клеток , сплошной по всей поверхности желудка, обычно рассматриваются ямки не как железы, а как короткие выемки на поверхности эпителия.
внизу желудочные ямки, слизистая желудка заполнена плотно упакованными трубчатые железы, которые отличаются по региону (т.э., сердечная, фундальная, пилорическая). Гистологически большинство стенки желудка содержит желудочных желез (или фундальных желез). Эти состоят в основном из париетальных клеток и главные клетки. Фундальные железы также содержат клетки слизистой шеи и стволовые клетки.
Желудочный париетальные клетки (оксинтические клетки) секретируют кислоты, откачивая ионы хлора и водорода. Эти клетки уникальны не только по функциям, но и по внешнему виду под микроскопом.Теменная клетки могут быть найдены на любом уровне фундальных желез, но они наиболее обычен в среднем регионе.
Желудочный главные клетки секретируют пищеварительные ферменты и имеют типичный серозно-секреторный вид. Главные клетки могут быть найдены на любом уровне фундальных желез, но они чаще всего встречаются в нижней части, по направлению к мышечной слизистые оболочки.
слизистая клетки шеи — незаметные клетки с типичным слизисто-секреторным внешний вид.Эти клетки чаще всего встречаются в верхней части фундальные железы. Их конкретная функция остается неясной.
Стволовые клетки , расположены в верхней части желез, где они открываются в ямки, отвечает за восполнение клеток железы, а также поверхности слизистые клетки, защищающие поверхность желудка. Эти клетки трудно заметить и еще труднее идентифицировать при рутинном гистологическом исследовании. препараты.
микроскопический появление фундальных желез. В обычных разделах расположение секреторных клеток в трубчатые железы часто не так легко заметить. В может казаться, что все клетки перемешаны или связаны в шнуры, так как несколько причин:
- Сальники не совсем прямые и не совсем параллельные для другого.
- Клетки, из которых состоят железы, различаются по размеру и форме. и внешний вид.
- В железистой оболочке часто бывает мало или совсем нет свободного места. люмен.
Начиная с трубчатая организация часто не может быть четко видна, ориентация секреторные клетки также часто неясны. Тем не менее преобладающая секреторные клетки (париетальные клетки и главные клетки) могут быть распознаны как эпителиальные по их типичной круглой эухроматической ядра. Железистая структура обычно наиболее четко проявляется там, где преобладают главные клетки, глубоко в слизистой оболочке около слизистой оболочки.
Физическое лицо железы отделены друг от друга тонкой стромой пластинки propria. Собственная пластинка может быть распознан по сильно гетерохроматическим, неправильным или уплощенным ядрам его фибробластов и эндотелиальных клеток. Эта ламина propria содержит капилляры, которые питают железы и желудок поверхность и которые также поставляют материалы, необходимые для секреции.
The стык между пищеводом и желудком отмечен резкий переход из многослойного плоского эпителия пищевода слизистая оболочка до простого столбчатого эпителия слизистой оболочки желудка.
Слизистая оболочка желудка разделена, несколько произвольно, на три области: кардиальный желудок, фундальный желудок и пилорический желудок .
Эти анатомические области различаются гистологически в первую очередь. по длине и составу слизистых желез.
Сердечные железы относительно короткие по сравнению с фундальные и пилорические железы.
Фундальные железы описаны выше.
пилорический особенно обширны сальники . Эти железы функционально и структурно подобен железам Бруннера двенадцатиперстной кишки. Оба трубчатые слизистые железы, выделяющие щелочную слизь. Они остаются в слизистой оболочке в животе, но расширяются через мышечную ткань слизистые оболочки, чтобы заполнить подслизистую оболочку двенадцатиперстная кишка.
И сердечные, и пилорические железы преимущественно слизистая (я.е., несколько париетальных или главных клеток). Это делает функциональным чувство, так как слизь может помочь защитить прилегающие области тракта от повреждение желудочной кислотой и пищеварительными ферментами. Поверхность слизистые клетки защищают слизистую оболочку желудка, но пищевод и двенадцатиперстная кишка не имеют такой защиты.
пилорический желудок также характеризуется значительным утолщением muscularis externa, образуя пилорический сфинктер.
Связанные примеры:
Комментарии и вопросы: [email protected]
SIUC / Школа медицины / Анатомия / Дэвид Король
http://www.siumed.edu/~dking2/erg/stomach.htm
Последнее обновление: 17 мая 2010 г. / dgk
Гистология желудка: слизистая оболочка, железы и слои
Автор:
Эгле Пири
• Рецензент:
Никола Макларен, магистр наук
Последняя редакция: 31 мая 2021 г.
Время чтения: 12 минут.
Желудок — ключевая часть желудочно-кишечного тракта (ЖКТ), расположенная между пищеводом и двенадцатиперстной кишкой.Его функции — смешивать пищу с желудочной кислотой и расщеплять пищу на более мелкие частицы с помощью химического и механического переваривания.
Желудок может выполнять эти роли благодаря слоям стенки желудка. Это слизистая оболочка желудка, подслизистая, наружная мышечная и серозная оболочки. Все части желудочно-кишечного тракта имеют тенденцию следовать одной и той же схеме расположения слоев ткани, а это означает, что желудок — это, по сути, просто расширение желудочно-кишечной трубки. Эти слои лучше всего наблюдать при изучении микроанатомии или гистологии желудка.
| M ucosa | Поверхностные слизистые клетки: простой столбчатый эпителий Ямки желудка: поверхностные слизистые клетки Желудочные железы: париетальные, главные, энтероэндокринные клетки Собственная пластинка слизистой оболочки: соединительная ткань Гладкая мышечная оболочка: два слоя слизистой оболочки |
| S ubmucosa | Соединительная ткань, подслизистое (Мейснеровское) сплетение |
| M uscularis externa | Слои гладких мышц (продольные, круговые, косые), миэнтерическое сплетение (сплетение Ауэрбаха) |
| S erosa | Соединительная ткань, мезодерма |
| Мнемонический | М.СМС |
Возможно, гистологию не так легко переварить, но мы поможем вам погрузиться в эту тему и разбить ее на небольшие логические разделы. Соляная кислота не требуется! Если вы все еще находите это пугающим, почему бы сначала не освежить свои знания в области гистологии?
Стенка желудка
Строение желудкаСтенка желудка состоит из 4 слоев ткани. От глубокого (внешнего) до поверхностного (внутреннего) это серозная оболочка, наружная мышечная оболочка, подслизистая и слизистая оболочки.Это многослойное расположение следует одной и той же общей структуре во всех областях желудка и во всем желудочно-кишечном тракте. Наружный слой стенки желудка гладкий, непрерывный с париетальной брюшиной. Внутренняя стенка (слои слизистой и подслизистой оболочки) свернута в складки, известные как морщины , или желудочные складки, которые позволяют желудку раздуваться при попадании пищи. Болюс пищи поступает в желудок из пищевода. Затем различные тканевые слои стенки желудка объединяют свои функции для переваривания болюса в вязкую мясистую жидкость, называемую химусом.Химус направляется в двенадцатиперстную кишку тонкой кишки для дальнейшего переваривания и всасывания.
Вы можете легко вспомнить четыре слоя стенки желудка, используя мнемонику « M.S.M.S ». Это означает: M ucosa, S ubmucosa, M uscularis externa и S erosa.
Хотя желудок анатомически разделен на четыре области , гистологически мы идентифицируем только три; кардия, глазное дно и привратник. Это потому, что глазное дно и тело гистологически идентичны.Теперь давайте подробнее рассмотрим 4 слоя желудка, а также их региональные вариации.
Слизистая оболочка
Самый внутренний слой стенки желудка — слизистая оболочка желудка . Он образован слоем поверхностного эпителия и лежащими под ним собственной пластинкой и мышечной оболочкой. Поверхностный эпителий представляет собой простой столбчатый эпителий. Он выстилает внутреннюю часть желудка в виде поверхностных слизистых клеток и образует многочисленные крошечные впячивания, или желудочных ямок , которые выглядят как миллионы отверстий по всей слизистой оболочке желудка.Эти желудочные ямки важны, поскольку они связаны с различными железами желудка.
В желудке обнаружено 3 типа желез ; сердечные, желудочные и пилорические, названные в честь региона, в котором они обнаружены. Эти железы производят пищеварительные ферменты и слизистые выделения желудка. Желудочные железы дна / тела играют важную роль в производстве пищеварительного желудочного сока, в то время как сердечные и пилорические железы преимущественно производят слизистые выделения, которые защищают желудок от резкого воздействия пищеварительной кислоты и предотвращают самопереваривание желудка.
Поверхностные слизистые клетки
Поверхностные слизистые клетки, также известные как фовеолярный эпителий , представляют собой простой столбчатый эпителий, выстилающий просвет желудка. Они выделяют щелочную, очень вязкую слизь, которая плотно прилегает к клеточной поверхности.
Слизь защищает слизистую оболочку желудка, сводя к минимуму истирание частицами пищи и создавая физический барьер из соляной кислоты, которым постоянно омываются слизистые клетки.Без этих слизистых выделений желудочная кислота буквально прожигала бы дыры в стенке желудка! Они довольно слабо окрашивают срезы H&E из-за содержащегося в них муцина, потому что он не особенно хорошо улавливает ни одно из пятен.
Желудочные ямы
Ямки желудка образованы инвагинациями поверхностного эпителия. Желудочные ямки соединяются с желудочными железами и, таким образом, позволяют железистым продуктам доставляться в просвет желудка. Ямки выстланы тем же слизистым поверхностным эпителием, который обращен к просвету желудка.На гистологическом срезе они часто будут разрезаны поперечно, а не продольно, поэтому будут выглядеть как небольшие круглые отверстия, а не тубулярные инвагинации.
Желудочные железы
Желудочная железа и стенка желудка: гистологическая диаграммаЖелудочные железы открываются в основание желудочных ям. Они встречаются по всей внутренней поверхности желудка и делятся на 3 типа в зависимости от области, в которой они находятся. Собственно желудочные железы (основные железы) находятся на дне / теле желудка.Клетки этих желез вырабатывают около двух литров желудочного сока в день. Слизь, секретирующая пилорических желез , связана только с пилорическим антральным отделом, а сердечных желез расположены только в пределах кардиального отдела желудка.
Желудочные ямки и желудочные железы состоят из одних и тех же 5 типов клеток: клетки слизистой шеи, стволовые клетки, париетальные (оксинтические) клетки, главные (зимогенные) клетки и энтероэндокринные клетки. Вы можете увидеть эти клетки, а также вещества, которые они выделяют, обобщенные в таблице ниже.
| Клетки слизистой шеи | Секреция слизи (менее щелочная, чем у поверхностных эпителиальных слизистых клеток) Круглые ядра и апикальные секреторные гранулы ,00 Слизистые клетки короче поверхности |
| Стволовые клетки | Заменить поврежденные ячейки |
| Париетальные (оксинтические) клетки | Производство собственных факторов Секреция соляной кислоты (HCl) ,00 Ячейки большие круглые или пирамидальные Сильно ацидофильный (морилка) Центральные округлые ядра |
| Главные (зимогенные) клетки | Пепсиноген и секреция желудочной липазы В нижних отделах желудочных желез Базофильный (морилка) |
| Энтероэндокринные клетки | Гастрин (выделяется в кровь) Одиночные клетки (не образуют кластеров) |
Все 3 типа желез представляют собой длинные разветвленные трубчатые структуры, проходящие через всю толщину собственной пластинки.Однако их клеточный состав различается в зависимости от их местоположения и связанных с ними функций. Собственно желудочные железы очень богаты пищеварительными ферментами, продуцирующими париетальные и главные клетки, поскольку большая часть пищеварения происходит в теле и на дне желудка. Pyloric и cardiac железы в значительной степени лишены париетальных и главных клеток, но имеют большое количество клеток слизистой шеи. Это имеет смысл, поскольку эти сегменты являются переходными областями между желудком и другими частями желудочно-кишечного тракта.Таким образом, выделяемые ими слизистые выделения защищают пищевод и двенадцатиперстную кишку от разъедающего воздействия желудочного сока. Энтероэндокринные клетки разбросаны по всем типам желудочных желез.
Стволовые клетки сосредоточены в области железы, известной как перешеек или шейка. Это переходная зона между желудочными железами и желудочными ямами. Это позволяет стволовым клеткам перемещаться как вверх по желудочной ямке, так и вниз к желудочным железам, чтобы заменить поврежденные клетки.Поверхностные клетки и ямки желудка постоянно окружены очень суровой окружающей средой и поэтому имеют высокий клеточный оборот, составляющий всего 4-7 дней, в то время как обмен клеток в желудочных железах происходит медленнее. Перешеек также содержит клетки слизистой шеи и некоторые поверхностные слизистые клетки.
Собственная пластинка слизистой оболочки и мышечная оболочка слизистой оболочки
lamina propria — это слой соединительной ткани, расположенный глубоко от поверхностного эпителия. Он содержит кровеносные и лимфатические сосуды, лимфоидную ткань и окружает желудочные железы.
Слой muscularis mucosae состоит из двух тонких слоев гладкой мускулатуры. Он отделяет собственную пластинку от подлежащей подслизистой основы. Внутренний слой muscularis mucosae состоит из кольцевых волокон, в то время как волокна внешнего слоя расположены продольно. Его функция заключается в том, чтобы помочь изгнать секрет желудочных желез в просвет желудка.
Проверьте себя на гистологию верхних отделов желудочно-кишечного тракта с помощью этого индивидуального теста.
Подслизистая основа
Глубоко в слизистой оболочке находится толстый слой соединительной ткани, известный как подслизистая оболочка желудка .Его расположение означает, что он прочный, но гибкий и мобильный. Помимо богатой сосудистой сети и лимфатических сосудов, этот слой также удерживает подслизистое (Мейснеровское) сплетение. Нервные волокна этого сплетения несут парасимпатическую иннервацию к кровеносным сосудам и гладким мышцам стенки желудка. Парасимпатическая стимуляция связана с функциями «отдыха и пищеварения» и, следовательно, стимулирует пищеварение.
Muscularis externa
Желудочная muscularis externa , также известная как мышечная оболочка, представляет собой гладкую мышцу, расположенную глубоко в подслизистой оболочке.Он состоит из 3-х слоев: внутреннего косого, среднего кругового и внешнего продольного. Слой muscularis externa производит взбивание, необходимое для механического пищеварения. Когда эти слои сокращаются, они превращают слизистую и подслизистую в складки.
Вся эта гистология вызывает несварение желудка? Не принимайте антациды, потому что у Kenhub есть для вас кое-что получше! Если вы боретесь с гистологией, почему бы не попробовать эти гистологические викторины , которые помогут вам в обучении?
Расположение наружной мышечной мышцы варьируется в зависимости от области желудка.В cardia слои хорошо развиты, создавая сфинктер для предотвращения кислотного рефлюкса из желудка в пищевод. На глазном дне мышца развита слабо, так как в этой области происходит гораздо меньше взбалтывания. Тело состоит из всех трех мышечных слоев, за исключением передней и задней частей желудка, где продольный мышечный слой практически отсутствует. В пилорической области мускулистая наружная мышца хорошо развита для продвижения химуса в двенадцатиперстную кишку, в то время как его утолщенный круговой слой образует пилорический сфинктер.
Внутри наружной мускулатуры находится миэнтерическое сплетение (Ауэрбаха) , несущее симпатические и парасимпатические волокна к слоям гладких мышц. Нейроны этого сплетения связаны с гладкомышечными клетками через интерстициальные клетки Кахаля (МКК). Помимо передачи нервных сигналов, эти клетки действуют как внутренние водители ритма кишечника, контролирующие медленные сокращения стенки желудка, необходимые для взбивания пищи. Активность МКК контролируется вегетативной нервной системой.
Как мы упоминали ранее, в дополнение к миэнтериальному сплетению (сплетение Ауэрбаха) в наружной мышечной оболочке у нас есть подслизистое сплетение (сплетение Мейснера) в подслизистой оболочке. Если вам сложно вспомнить разницу между ними, может помочь мнемоника! Используйте SMP и MAPS , что означает:
- S ubmucosal
- M Eissner’s
- П аразимпатическая
- М Янтерей
- A uerbach’s
- П асимпатическая
- S симпатический
Вы можете больше узнать о мускулатуре живота, изучив следующие учебные материалы!
Сероза
Сероза желудкаСероза желудка — это самый внешний слой стенки желудка.Он состоит из слоя простого плоского эпителия, известного как mesothelium , и тонкого слоя подлежащей соединительной ткани. Мезотелий производит серозную жидкость, которая смазывает внешнюю стенку желудка и обеспечивает ее плавное движение в брюшной полости. Серозная оболочка переходит в париетальную брюшину. Он отсутствует в местах прикрепления большого и малого сальника к желудку, а также на небольшом надзаднем участке рядом с сердечным отверстием, где желудок прикрепляется к диафрагме через желудочно-диафрагмальную и гастропанкреатическую складки.
Пищеварительная система: Руководство по гистологии
Желудок
Строение желудка.
Пища начинает перевариваться и всасываться в желудке, хотя абсорбция в основном ограничена водой, алкоголем и некоторыми лекарствами. Желудок — это расширяемая мускулистая сумка, которую можно проглотить. еда внутри него, сокращая мышечный пилорический сфинктер. Пища может оставаться в желудке 2 часа и более. Еда сломана пух химически , желудочный сок , и механически , стягиванием трех слоев гладкой мышца в мышечном внешнем слое.Разбитая еда в конце этого процесса называется химус .
Желудочный сок секретируется железами слизистой оболочки желудка и содержит соляную кислоту, слизь s и протеолитические ферменты пепсин (расщепляющая белки) и липаза, (расщепляющая жиры).
Когда желудок пуст и не растянут, слизистая оболочка вздымается вверх в складки, называемые морщинистой . После еды эти складки расплющиваются, и живот может сильно вздуться.
Желудок имеет три анатомических области:
- кардиальный, который содержит слизистые секретирующие железы (называемые сердечными железами) и находится ближе всего к пищеводу
- глазное дно, тело или большая часть желудка, содержащая желудочные (фундальные) железы
- пилорический, выделяющий два типа слизи и гормон гастрин.
Сравните железы, присутствующие в этих трех регионах.
Привратник заканчивается у сфинктера привратника .Этот сфинктер расслабляется, когда формирование химуса завершается, и химус впрыскивается в двенадцатиперстную кишку.
Когда вы проработаете три области живота, проверьте свои знания.
Слои желудка.
Показывает изображение через стенку тела желудка при малом увеличении. Вы должны быть в состоянии идентифицировать три основных слоя, представленных здесь — слизистую оболочку , подслизистую оболочку и muscularis externa .
Слизистая оболочка полна желудочных желез и ямок, а также имеется заметный слой гладкой мускулатуры — слизистая оболочка muscularis. Сокращение этой мышцы помогает изгнать содержимое желудочных желез.
Слой muscularis externa состоит из трех слоев мышц. Внутренний косой слой, средний круговой и внешний продольный слой. Сокращение этих мышечных слоев способствует механическому расщеплению пищи.
Теперь посмотрите на этот электронный микроскоп, показывающий слои.
Переключить ярлыки
Это изображение также можно просмотреть с помощью программы просмотра Zoomify.
Соединение пищевода и желудка.
Строение пищевода был рассмотрен в теме «устно». Пищевод образует стык с желудком , который называется пищеводно-желудочный переход .
На фотографии справа показан этот перекресток.
Можете ли вы определить пищеводно-желудочного перехода , где заканчивается пищевод, а начинается желудок? Этот регион желудка называется «сердечной» областью.Как устроена слизистая в этом регионе поменять?
Желудочные железы на дне (теле) желудка
Эпителий слизистой оболочки глазного дна и тела Желудок образует инвагинации, называемые желудочными ямами . lamina propri a содержит желудочных желез , которые открываются в основания желудочных ям . Эти железы отвечают за синтез и секрецию желудочный сок .
Выстилка эпителия желудка и желудка pits полностью состоит из слизистых цилиндрических клеток . Эти клетки производят толстый слой слизи, который защищает слизистая желудка от кислоты и ферментов в просвете. Несмотря на это, эти клетки необходимо заменить через 4-6 дней.
На этой диаграмме показана структура желудочной железы , простой трубчатой железы.
Перешеек и шейка содержат делящиеся клетки (стволовые клетки), незрелые клетки и созревающие шейки слизистые клетки .Зрелые клетки перемещаются вверх, замещая поверхностные слизистые клетки. Эти слизистые клетки имеют очень бледную окраску.
Париетальные (оксинтические) клетки также сосредоточены в области перешейка, но также обнаруживаются в основании и шейке желез. Это большие бледно окрашенные клетки с центральным сферическим ядром. Можете ли вы идентифицировать их в этих разделах? (Они выглядят как «жареные яйца»). Париетальные клетки производят соляную кислоту и внутренний фактор , который необходим для абсорбции витамина B12 в терминальном отделе подвздошной кишки.
Главные / пептические / зимогенные клетки обнаружены в основании желудочных желез. У них сильно базофильная гранулярная цитоплазма, так как у них много rER для производства пептина, который секретируется (как предшественник пепсиногена), и базально расположенные ядра.
Нейроэндокринные клетки в основании желез секретируют серотонин и другие гормоны.
Посмотрите на это увеличенное изображение слизистой оболочки желудка с дна (основной части желудка), на котором видны многочисленные желудочные ямки.Можно ли идентифицировать париетальных клеток и пептических клеток , поверхностных слизистых клеток , желудочных ямок и оснований ямок .
Теперь взгляните на электронный микроскоп ямок желудка и желез на глазном дне.
Переключить ярлыки
Это изображение также можно просмотреть с помощью программы просмотра Zoomify.
Глотка, пищевод и желудок | гистология
Общие характеристики: Желудок разделен на четыре области: кардия, глазное дно, тело (тело) и привратник.Стенка желудка состоит из четырех обычных слоев, присутствующих в других частях желудочно-кишечного тракта. Слизистая оболочка относительно толстая и содержит множество трубчатых желез. Слизистая мышечная оболочка также толстая и на некоторых участках состоит из трех слоев гладкой мускулатуры, хотя это наслоение не всегда заметно. В подслизистой основе железы отсутствуют. В пустом сокращенном желудке слизистая оболочка превращается в продольные складки (морщинки) из-за сокращения слизистой оболочки мышечной оболочки и рыхлой консистенции подслизистой оболочки.Поверхность дополнительно подразделяется на борозды, желудочные ямки. Эти воронкообразные впячивания эпителия в основании непрерывны с трубчатыми железами. Наружная мышечная мышца состоит из 3 плохо очерченных слоев. Средний круговой слой мышечной ткани утолщен, образуя пилорический сфинктер, который является «анатомическим» сфинктером. Нижний (гастро) пищеводный сфинктер не имеет утолщения мышечной ткани, поэтому его называют «физиологическим» сфинктером.
На основании различий в типах желез, присутствующих в слизистой оболочке, в желудке можно выделить три гистологических области.Первая область вокруг кардии содержит сердечные железы. Вторая область, которая включает глазное дно и тело, содержит собственно желудочные железы (также называемые фундальными железами). Дистальный отдел желудка (привратник) содержит пилорические железы.
A. Сердечные железы (W pg 268, 14,6)
Slide 155 40x (желудочно-пищеводный переход, H&E) Просмотреть виртуальный слайд
Slide 160 40x (желудочно-пищеводный переход, PAS и лазурно-синий) Просмотреть виртуальный Слайд
Эти железы слизистой оболочки состоят в основном из слизистых клеток с бледно окрашивающейся цитоплазмой и базально расположенными ядрами.Присутствуют, но не видны, стволовые клетки и эндокринные клетки. На слайде , слайде 155 найдите сердечно-пищеводный переход (ширина на стр. 268, 14.6). Просмотр изображения. Обратите внимание на резкий переход от слизистой оболочки пищевода с его многослойным плоским эпителием к железистой слизистой оболочке желудка. Сердечные желудочные железы View Image присутствуют только в очень маленьком сегменте слизистой оболочки желудка, примыкающем к этому соединению. Это слизистые железы, состоящие из ОДНОРОДНОЙ популяции бледно-окрашенных столбчатых клеток с «пузырчатой» надъядерной цитоплазмой.По мере продвижения в желудок сердечные железы очень быстро замещаются собственно желудочными (или фундальными) железами, которые, как описано ниже, состоят из особенно ГЕТЕРОГЕННОЙ смеси основных базофильных клеток и эозинофильных париетальных клеток.
Поскольку сердечные желудочные железы в основном слизистые, их также можно продемонстрировать с помощью окрашивания PAS, как показано на слайде 160 . На этом слайде клетки, выстилающие желудочные ямки, очень интенсивно окрашиваются PAS из-за того, что они выделяют вязкую, богатую углеводами слизь.Секреция сердечных желез немного более водянистая, поэтому они не так сильно окрашиваются.
B. Желудочные железы (стр. 268-272, 14.7-13).
Слайд 155 40x (желудочно-пищеводный переход, H&E) Просмотр виртуального слайда
Слайд 160 40x (желудочно-пищеводный переход, PAS и лазурно-синий) Просмотр виртуального слайда
Слайд 156 20x (желудок, H&E) Просмотр Virtual Slide
Slide 156 40x (живот, H&E) Просмотр виртуального слайда
Slide 157 20x (живот, H&E) Просмотр Virtual Slide
Slide 157 40x (живот, H&E) Просмотр виртуального слайда
«Желудочные» или «фундальные» железы характерны для слизистой оболочки дна и тела желудка.При малом увеличении обратите внимание, что желудочные ямки здесь относительно более мелкие, а трубчатые желудочные или фундальные железы относительно намного длиннее, чем в кардии или привратнике. Обратите внимание, что высокие столбчатые клетки, выстилающие поверхность просвета и ямки, имеют базально расположенные ядра и слегка окрашивающую цитоплазму. Большинство этих клеток секретируют слизь, которая хранится в апикальной цитоплазме. Вы можете увидеть эти клетки в препарате желудка, окрашенные PAS (который окрашивает слизь и другие гликопротеины) на слайде 160 .На этом слайде слизистые клетки пищеварительных ямок окрашиваются довольно сильно. Также можно идентифицировать более светлые «слизистые клетки шеи», присутствующие в области шеи желудочных желез, и секретирующие слизь клетки сердечных желез, обнаруженные вблизи желудочно-пищеводного соединения.
Перемещаясь в тело фундальной железы, определите теменные и главные клетки на слайдах 155 Просмотр изображения [ОРИЕНТАЦИЯ], слайд 156 Просмотр изображения [ОРИЕНТАЦИЯ] и слайд 157 Просмотр изображения [ОРИЕНТАЦИЯ].Париетальные клетки большие, яйцевидные или пирамидальные, их широкая сторона прилегает к базальной мембране. Каждая клетка содержит круглое ядро, расположенное в центре, и обнаруживает слегка эозинофильную цитоплазму, которая кажется зернистой из-за присутствия множества митохондрий. Главные клетки присутствуют в нижней трети или половине желудочных желез. Апикальная цитоплазма этих клеток может казаться зернистой из-за наличия гранул зимогена, которые могут окрашиваться в ярко-красный цвет в препаратах H&E (как на слайде , слайд 157, ).Однако в других препаратах ( слайдов 155 и 156 ) пепсиноген был экстрагирован, и пустые секреторные гранулы напоминают многие стеклянные шарики в надъядерной цитоплазме. С другой стороны, основание цитоплазмы явно базофильное.
Другие клетки желудочных желез, такие как недифференцированные (стволовые) клетки и различные эндокринные клетки, НЕ будут изучаться на этом лабораторном занятии, так как их сложно идентифицировать в желудке, но вы должны знать об их общих характеристиках.Обратите внимание на присутствие большого количества лимфоцитов и плазматических клеток в собственной пластинке между желудочными железами, которые в некоторых областях агрегированы в лимфоидные узелки. Просмотреть изображение (которое будет изучено более подробно вместе с другими лимфатическими тканями, но вы должны хотя бы здесь можно их идентифицировать). Также обратите внимание, что пряди гладких мышечных волокон из внутреннего слоя слизистой оболочки muscularis проходят между железами по направлению к поверхности. Сокращение этих прядей может способствовать опорожнению желез.
C. Привратниковые железы (стр. 273, 14.14-15)
Slide 162 20x (гастро-дуоденальный переход, H&E) Просмотреть виртуальный слайд
Slide 162 40x (гастро-дуоденальный переход, H&E) Просмотреть виртуальный слайд
На слайде 162 вы можете увидеть переход от привратника желудка к двенадцатиперстной кишке тонкой кишки. Пилорическая область желудка характеризуется толстой стенкой из-за присутствия пилорической мышцы сфинктера, которая состоит в основном из внутреннего кругового слоя наружной мышцы.Сравните его толщину с толщиной стенки прилегающей двенадцатиперстной кишки (W стр. 273, 14,15). Пилорические железы Обзорное изображение в основании каждой желудочной ямки [ОРИЕНТАЦИЯ] также снова состоит из в основном ОДНОРОДНОЙ популяции слизистых клеток, которые по внешнему виду похожи на таковые в сердечных железах, хотя ямки намного глубже по сравнению с сердечными железами. Присутствуют, но не видны, стволовые клетки и эндокринные клетки. Иногда также могут быть обнаружены париетальные клетки. Обратите внимание, что основания пилорических желез примыкают к слизистой мышечной ткани, тогда как в двенадцатиперстной кишке вы увидите обильные железы (железы Бруннера) ГЛУБОКО к слизистой мышечной ткани (т.е.е. в СУБМУКОЗА).
На всякий случай, если вы беспокоитесь о том, чтобы отличить сердечные железы от пилорических желез, по общему признанию, очень трудно отличить эти две части друг от друга, основываясь только на обзорах с большим количеством изображений, но вы всегда можете использовать контекстную информацию, чтобы помочь вам: сердечные железы будут правильными рядом с желудочно-пищеводным соединением, тогда как пилорические железы находятся в гастро-дуоденальном соединении.
Фундальный желудок | Желудочно-кишечный тракт
Фундаментальный отдел желудка | Желудочно-кишечный трактРуководство по гистологии
доля
Закрывать
СЛАЙД ДЛЯ МИКРОСКОПА
НАЗВАНИЕ СЛАЙДА
MH 112 Фундаментальный отдел желудка
ТКАНИ
Фундальный отдел желудка
(человек)
ПЯТЕНЬ
Гематоксилин и эозин
ФИКСАТИВ
Формальдегид Ценкера
РАЗМЕР ИЗОБРАЖЕНИЯ
41915 x 13211 пикселей
2.1 ГБ
РАЗМЕР ФАЙЛА
94 МБ
УВЕЛИЧЕНИЕ
40x
РАЗМЕР ПИКСЕЛЯ
0,3171 мкм
ИСТОЧНИК
Медицинская школа
Университет Миннесоты
Миннеаполис, Миннесота
Закрывать
СПРАВКА
Для получения дополнительной информации см. HELP .
Каждый слайд показан с дополнительной информацией справа.Изображение можно изменить с помощью любой комбинации следующих команд.
Боковая панель
- Щелкните ссылок , чтобы перейти в конкретный регион.
- Щелкните изображений , чтобы открыть это представление.
- Используйте панель инструментов для изменения увеличения и панорамирования отображаемого изображения.
Мышь
- Нажмите, чтобы увеличить
- Дважды щелкните, чтобы уменьшить масштаб
- Alt-щелчок, чтобы уменьшить масштаб
- Alt-двойной щелчок, чтобы уменьшить масштаб до всего слайда
- Перетащите изображение на панораму
Клавиатура
- Shift или клавиша «A» для увеличения
- Ctrl или «Z» для уменьшения масштаба
- Клавиши со стрелками для панорамирования по изображению
- Клавиша ESC для уменьшения масштаба для всего слайда
Сенсорный
- Нажмите, чтобы увеличить
- Дважды нажмите, чтобы уменьшить
- Удерживайте Alt, чтобы уменьшить масштаб на весь слайд
- Перетащите изображение на панораму
Закрывать
ПОДЕЛИТЬСЯ
Ссылку на виртуальный слайд можно сохранить для последующего просмотра различными способами.
Буфер обмена
Адрес этого представления был скопирован в буфер обмена. Эту ссылку можно вставить в любую другую программу.
Закладка
Ссылку на закладку можно создать с помощью функции закладок ( Ctrl-D для Windows или Cmd-D для Mac) вашего браузера. Выберите имя для закладки и выберите папку, в которой вы хотите ее сохранить.
Электронная почта
Это представление можно отправить по электронной почте кому угодно.
Желудок — ветеринарная гистология
Глава 8: Желудочно-кишечный тракт
Существуют заметные межвидовые различия в желудочном отделе, примером которых является разница между однокомпонентным желудком (например, плотоядные животные) и многокомпонентным желудком жвачных животных (например, крупного рогатого скота). Для получения более подробной информации об этих структурах читателя отсылают к текстам по ветеринарной макроанатомии, но здесь будут отмечены особенности микроскопии.Тем не менее, основная функция желудка — это механическое и химическое расщепление пищеварительного тракта для подготовки к абсорбции в кишечнике.
Собаки и кошки
Домашние плотоядные животные (собаки и кошки) имеют однокамерный (простой) желудок, который полностью выстлан железистой слизистой оболочкой. Желудок делится на несколько сегментов. От орального до аборального это: кардия, глазное дно и привратник.
Железистый желудок назван так из-за высокой секреторной функции эпителия слизистой оболочки, который вырабатывает слизь, соляную кислоту и пепсин.Поверхность слизистой оболочки образована многочисленными вертикально ориентированными трубчатыми железами. На поверхности слизистая оболочка состоит из ямок желудка, которые представляют собой небольшие углубления слизистой оболочки, которые образуют связи между трубчатыми железами слизистой оболочки и просветом желудка. Ямки желудка в основном выстланы секретирующими слизь эпителиальными клетками, столбчатыми эпителиальными клетками с бледной или неокрашенной цитоплазмой (слизью) и базальными ядрами. Эти клетки производят слой слизи, покрывающий эпителиальную поверхность, защищая ее от механических и химических повреждений.
Ниже желудочных ямок и составляющих большую часть эпителия слизистой оболочки глазного дна находятся две специализированные популяции эпителиальных клеток. Париетальные клетки (оксинтические клетки) представляют собой полигональные эпителиальные клетки с обильной бледной эозинофильной цитоплазмой и круглыми центральными ядрами, расположенными в центральных областях слизистой оболочки фундального отдела. Париетальные клетки выделяют соляную кислоту, которая действует как основной химический эффектор пищеварения желудка. Главные клетки представляют собой эпителиальные клетки с низким столбчатым слоем с зернистой базофильной цитоплазмой и круглыми эксцентрическими ядрами.Главные клетки секретируют пепсиноген, который соляной кислотой быстро превращается в активную форму, пепсин. Пепсин — это протеолитический пищеварительный фермент (протеаза), способствующий пищеварению. Распределение компонентов железистого эпителия варьируется в зависимости от области железистого желудка. Дно содержит большое количество париетальных клеток, тогда как привратник богат клетками слизи, но содержит мало париетальных клеток.
Третий тип секреторных эпителиальных клеток, гастриновые клетки, расположены в основном внутри привратника.Клетки гастрина секретируют гастрин, гормон, вызванный присутствием пищеварительного тракта в желудке (например, при приеме пищи), который стимулирует секрецию пищеварительного фермента пепсина (то есть пепсиногена) и соляной кислоты главными и париетальными клетками соответственно. Клетки гастрина трудно различить обычными гистологическими методами.
Подобно другим отделам канальцев пищеварительного тракта, собственная пластинка лежит под слизистой оболочкой желудка. Снаружи от собственной пластинки находятся подслизистая оболочка желудка, мышечная оболочка и серозная оболочка.Слизистая оболочка желудка может содержать организованные лимфоидные агрегаты, которые включены в лимфоидную ткань, ассоциированную с желудочно-кишечным трактом (GALT; обсуждается позже).
РИСУНОК : Желудок Плотоядные
Классификация, гистология и применение молекулярной патологии
Рак кардии желудка и гастроэзофагеального соединения (GEJ)
Карцинома желудка клинически классифицируется как ранняя или продвинутая стадия, чтобы помочь определить соответствующее вмешательство, и гистологически на подтипы на основе основного морфологического компонента.Для классификации, основанной на анатомическом расположении, часто возникают трудности, когда опухоль расположена в проксимальном отделе желудка или кардии, особенно когда опухоль также включает гастроэзофагеальное соединение (GEJ). Это связано не только с общими гистологическими особенностями и иммунофенотипами между воспаленной слизистой оболочкой сердца желудка, вызванной инфекцией Helicobacter, и дистальной слизистой оболочкой пищевода, покрытой метапластическим столбчатым эпителием, вторичной по отношению к рефлюксной болезни, но и потому, что нет единого мнения относительно анатомического определения Кардия желудка (6,7).Для решения этой проблемы было предложено несколько классификаций. Схема, одобренная Международной ассоциацией рака желудка, разделяет рак желудка на тип I, тип II и тип III, чтобы представить опухоли дистального отдела пищевода, кардии и желудка, дистальнее кардии, соответственно (8). Эта классификация, однако, четко не определила критерии для каждого из этих анатомических мест. Совсем недавно седьмое издание классификации TNM Американского объединенного комитета по раку (AJCC) упростило классификацию карциномы проксимального отдела желудка на основе местоположения эпицентра опухоли и наличия или отсутствия поражения GEJ (9).Опухоль должна быть сгруппирована по стадиям как карцинома пищевода, если ее эпицентр находится в нижнем грудном отделе пищевода или GEJ, или в пределах 5 см проксимального отдела желудка (то есть кардии) с опухолевой массой, простирающейся в GEJ или дистальный отдел пищевода. Если эпицентр находится более чем на 5 см дистальнее GEJ или в пределах 5 см от GEJ, но не доходит до GEJ или пищевода, он классифицируется как карцинома желудка (9). Эта классификация, хотя патологам легко следовать, все же может столкнуться с некоторыми проблемами. Например, объемный рак сердца желудка с эпицентром на 4 см ниже GEJ все равно будет диагностирован и классифицирован как опухоль пищевода, если проксимальный конец опухоли заходит в GEJ только на 0.5 см (даже если дистальный конец опухоли находится на расстоянии 4 см от эпицентра, переходящего в желудок). Операционному хирургу, который видит опухоль in situ , может быть трудно принять эту опухоль как рак пищевода. Кроме того, недавнее ретроспективное исследование Huang et al . показывает, что карцинома сердца с поражением GEJ или дистального отдела пищевода более подходящим образом классифицируется и ставится на стадию рака желудка, а не пищевода, по крайней мере, в китайской популяции (10).В этом исследовании карциномы сердца были классифицированы в зависимости от глубины инвазии, статуса положительных лимфатических узлов и отдаленных метастазов, как опухоли желудка и пищевода. Когда стадия опухоли изучается и сравнивается с кумулятивной выживаемостью, результаты подтверждают, что более целесообразно группировать и стадировать рак сердца как желудочный по происхождению (10). Чтобы лучше отделить карциному сердца желудка от злокачественного новообразования пищевода или ГКП, очевидно, необходимы дополнительные исследования, такие как более крупный образец пациента, молекулярное профилирование опухоли, данные клинического наблюдения и определение местоположения опухоли после неоадъювантной терапии, чтобы определить, была ли начальная объемная опухоль имела более «желудочное» или более «гестальное / пищеводное» происхождение.
Ранняя и запущенная карцинома желудка
Ранняя карцинома желудка определяется как инвазивная карцинома, ограниченная слизистой и / или подслизистой оболочкой, с метастазами в лимфатические узлы или без них, независимо от размера опухоли (11). Большинство ранних карцином желудка имеют небольшой размер, от 2 до 5 см, и часто располагаются на меньшей кривизне вокруг angularis. Некоторая ранняя карцинома желудка может быть мультифокальной, что часто указывает на худший прогноз. В целом, ранняя карцинома желудка подразделяется на Тип I для опухоли с выступающим ростом, Тип II с поверхностным ростом, Тип III с выемочным ростом и Тип IV для инфильтрирующего роста с латеральным распространением.Опухоль типа II подразделяется на IIa (приподнятая), IIb (плоская) и IIc (депрессивная), как было предложено Японским эндоскопическим обществом (12). Более поздняя Парижская классификация подтвердила три общих модели поверхностных неопластических поражений желудочно-кишечного тракта. В целом и эндоскопически опухоль классифицируется как Тип 0-I для полиповидного роста (который подразделяется на 0-Ip для роста на ножке и 0-Is для сидячего роста), Тип 0-II для неполипоидного роста (который подразделяется на Тип 0 -IIa для слегка приподнятого роста, Тип 0-IIb для плоского роста и Тип 0-IIc для слегка подавленного роста) и Тип 0-III для вынутого нароста (13).Гистологически наиболее частые формы ранней карциномы желудка хорошо дифференцированы, в основном с трубчатой и папиллярной архитектурой. Различие между хорошо дифференцированной карциномой и дисплазией высокой степени или карциномой in situ может быть проблематичным, когда для гистологической оценки доступна только ткань слизистой оболочки. Интрамукозную инвазию не так просто подтвердить, как инвазивную карциному в подслизистую основу, где обычно очевидна стромальная десмоплазия. Различие между внутрислизистой карциномой и карциномой in situ или дисплазией высокой степени важно, поскольку внутрислизистая карцинома желудка, в отличие от внутрислизистой карциномы толстой кишки, действительно дает метастазы.Обычно полезными гистологическими признаками внутрислизистой инвазии являются отдельные опухолевые клетки в собственной пластинке и значительно сросшиеся неопластические железы различных размеров. Прогноз ранней карциномы желудка отличный, 5-летняя выживаемость достигает 90% (14). Напротив, прогрессирующая карцинома желудка, которая проникает в мышечную спроприю или за ее пределы, имеет гораздо худший прогноз с 5-летней выживаемостью около 60% или меньше (15). По внешнему виду развитая карцинома желудка может быть экзофитной, изъязвленной, инфильтративной или комбинированной.Основываясь на классификации Боррманна, общий вид прогрессирующей карциномы желудка можно разделить на тип I для полиповидного роста, тип II для грибкового роста, тип III для язвенного роста и тип IV для диффузно инфильтрирующего роста, который также называется linitisplastica в печатке. кольцевидная карцинома, когда большая часть стенки желудка вовлечена в инфильтрацию опухолевых клеток. Гистологически прогрессирующая карцинома желудка часто демонстрирует выраженную архитектурную и цитологическую гетерогенность с несколькими сосуществующими гистологическими паттернами роста.Различие между ранней и запущенной карциномой желудка перед резекцией имеет клиническое значение, поскольку помогает решить, оправдана ли неоадъювантная (дооперационная) терапия, которая, как было показано, улучшает выживаемость без болезней и общую выживаемость (16,17). Хотя макроскопический вид является информативным, наиболее точную дооперационную информацию о стадиях обычно получают с помощью эндоскопической ультрасонографии (EUS) и компьютерной томографии (КТ) (18).
Гистологическая классификация карцином желудка
Гистологически карцинома желудка демонстрирует заметную гетерогенность как на архитектурном, так и на цитологическом уровне, часто при сосуществовании нескольких гистологических элементов.За последние полвека гистологическая классификация карциномы желудка в значительной степени основывалась на критериях Лорена, в которых аденокарцинома кишечного типа и диффузного типа являются двумя основными гистологическими подтипами, плюс неопределенный тип как необычный вариант (18). Относительные частоты составляют примерно 54% для кишечного типа, 32% для диффузного типа и 15% для неопределенного типа (19). Есть указания на то, что рак желудка диффузного типа чаще встречается у женщин и молодых людей (20,21), тогда как аденокарцинома кишечного типа чаще связана с кишечной метаплазией и инфекцией Helicobacter pylori (22,23).
Классификация ВОЗ от 2010 г. выделяет четыре основных гистологических образца рака желудка: канальцевый, папиллярный, муцинозный и слабо когезионный (включая карциному из перстневых клеток), а также необычные гистологические варианты (24). Классификация основана на преобладающем гистологическом паттерне карциномы, который часто сосуществует с менее доминирующими элементами других гистологических паттернов.
Тубулярная аденокарцинома — наиболее распространенный гистологический тип ранней карциномы желудка (). Он имеет тенденцию к образованию полиповидных или грибовидных масс и гистологически демонстрирует нерегулярно растянутые, слившиеся или ветвящиеся канальцы различных размеров, часто с внутрипросветной слизью, ядерным и воспалительным мусором.
Тубулярная аденокарцинома. Неопластические железы неправильной формы сросшиеся с внутрипросветной слизью и мусором
Папиллярная аденокарцинома — еще один распространенный гистологический вариант, часто встречающийся при ранней карциноме желудка. Он имеет тенденцию поражать пожилых людей, возникает в проксимальном отделе желудка и часто связан с метастазами в печень и более высокой частотой поражения лимфатических узлов. Гистологически он характеризуется эпителиальными выступами, поддерживаемыми центральным фиброваскулярным ядром.
Муцинозная аденокарцинома составляет 10% карциномы желудка.Гистологически он характеризуется внеклеточными пулами муцина, которые составляют не менее 50% объема опухоли (). Опухолевые клетки могут образовывать железистую архитектуру и нерегулярные кластеры клеток, причем случайные разрозненные клетки-печатки могут плавать в слизистых пулах.
Муцинозная аденокарцинома. Кластеры и разрозненные опухолевые клетки, плавающие в обширных внеклеточных пулах муцина
Карцинома с кольцевыми клетками-печатками () и другие карциномы с плохой связью часто состоят из смеси клеток с перстневыми кольцами и клеток без перстней.Плохо связные опухолевые клетки без перстневого кольца — это те клетки, которые морфологически напоминают гистиоциты, лимфоциты и плазматические клетки. Эти опухолевые клетки могут образовывать микротребакулы неправильной формы или кружевные абортивные железы, часто сопровождающиеся выраженной десмоплазией стенки желудка и сильно вдавленной или изъязвленной поверхностью. Когда это происходит в антропилорической области с вовлечением серозной оболочки, карцинома имеет тенденцию к лимфоваскулярной инвазии и метастазам в лимфатические узлы. Поскольку клетка-печатка и другие плохо сцепляющиеся карциномы в антроплориальной области имеют склонность к проникновению в двенадцатиперстную кишку через подслизистый и субсерозный пути, включая субсерозные и подслизистые лимфатические пространства, особое внимание необходимо уделять этим путям, когда во время запрашивается замороженный участок дистального края хирургической резекции.Специальные красители, такие как иммуногистохимия цитокератина, могут помочь обнаружить морфологически скрытые клетки-печатки в собственной пластинке. Одним из важных дифференциальных диагнозов неопластических клеток с перстнями в слизистой оболочке желудка являются доброкачественные псевдо-перстневые кольцевые клетки, которые могут заметно имитировать карциному с перстневыми кольцами (). Эти клетки с псевдопечатным кольцом иногда могут демонстрировать цитологическую атипию даже при митозах. Однако эти клетки с псевдопечатным кольцом не обнаруживают инвазивного паттерна с окрашиванием ретикулином, которое выделяет клетки с псевдо-печаткой, заключенные в базальную мембрану с интактной ацинарной архитектурой (25).
Карцинома из перстневых клеток. Клетки карциномы перстневого кольца преимущественно находятся в поверхностной собственной пластинке
Клетки псевдо-перстневого кольца. Цитоплазма клеток с псевдопечатным кольцом вакуолизирована (A) и бледна (B) (фотографии любезно предоставлены доктором Кэролайн Хьюз)
Клетки с псевдопечатным кольцом заключены в базальную мембрану и сохраняют неповрежденную ацинарную структуру с помощью ретикулинового красителя (фото любезно предоставлено доктором Кэролайн Хьюз)
В дополнение к указанным выше четырем основным гистологическим подтипам, классификация ВОЗ также поддерживает другие необычные гистологические варианты, такие как аденосквамозная карцинома, плоскоклеточная карцинома, гепатоидная аденокарцинома, карцинома с лимфоидной стромой, хориетоклеточная карцинома , злокачественная рабдоидная опухоль, мукоэпидермоидная карцинома, карцинома панет-клеток, недифференцированная карцинома, смешанная адено-нейроэндокринная карцинома, опухоль энтодермального синуса, эмбриональная карцинома, чистая опухоль желточного мешка желудка и онкоцитарная аденокарцинома, все перечисленные в классификации Лорена для сравнения.
Таблица 1
Системы классификации аденокарциномы желудка
| ВОЗ (2010) | Lauren (1965) | |
|---|---|---|
| Папиллярная аденокарцинома | Аденокарцинома Аденокарцинома Карцинома из клеток с печатным кольцом И другая карцинома с плохой когезией | Диффузный тип |
| Смешанная карцинома | Неопределенный тип | |
| Аденоцинома с аденокарциномой 9095 с аденоциномой карциномы с аденоциномой карциномы Карциносаркома Париетально-клеточная карцинома Злокачественная рабдоидная опухоль Мукоэпидермоидная карцинома Клеточная карцинома Панета Недифференцированная карцинома Смешанная адено-нейроэндокринная карцинома Опухоль эндодермального синуса Эмбриональная опухоль Чистая опухоль желточного мешка Онкоцитарная аденокарцинома |
Карцинома желудка с лимфоидной стромой (медуллярная карцинома) является одним из редких подтипов.Это чаще встречается в проксимальном отделе желудка и обычно протекает менее агрессивно. Гистологически этот тип карциномы характеризуется резко очерченными продвигающимися краями, состоящими из нерегулярных гнезд или листов многоугольных опухолевых клеток, связанных с заметным лимфоидным инфильтратом в недесмопластической строме. Интересно, что более 80% карцином желудка с лимфоидной стромой являются положительными по вирусу Эпштейна-Барра (ВЭБ) (26,27), а ВЭБ выявляется только в злокачественных и диспластических клетках, но не в нормальных эпителиальных клетках (28).Открытие вселило надежду на нацеливание на опухолевые клетки, особенно после того, как исследования показали, что бортезомиб, ингибитор протеасом, может индуцировать киназу EBV, активируя экспрессию литического белка EBV в инфицированных опухолевых клетках, что, в свою очередь, делает инфицированные клетки более восприимчивыми к уничтожению с помощью прочие агенты (29). Другая группа карцином желудка с лимфоидной стромой — это карциномы, которые демонстрируют высокую микросателлитную нестабильность (30,31), возникающую в результате нарушения функции белков репарации несоответствия ДНК, обычно hMLh2 или hMSh3, но редко hMSH6 (30,32-34).Число лимфоцитов, инфильтрирующих опухоль, хотя и значительно выше, чем количество лимфоцитов, не связанных с микросателлитной нестабильностью, но ниже, чем при EBV-положительной карциноме (34). Эта группа рака обычно относится к кишечному типу по классификации Лорен и часто поражает пожилых людей с более низкой стадией pTNM и низким риском метастазирования в лимфатические узлы. Было высказано предположение, что высокий статус микросателлитной нестабильности и инфекция ВЭБ были переменными, которые улучшили прогноз рака.Однако эти утверждения не были подтверждены другими исследованиями. Более недавнее исследование показывает, что большое количество инфильтрирующих опухоль лимфоцитов является единственным благоприятным прогностическим фактором, не зависящим от ВЭБ-инфекции и высокого статуса микросателлитной нестабильности (34). Также в этом исследовании не было доказано, что ни положительность по ВЭБ, ни высокая микросателлитная нестабильность являются независимыми благоприятными прогностическими факторами. Интересно, что положительный статус EBV и высокий статус микросателлитной нестабильности, хотя оба имеют черту выдающихся инфильтрирующих опухоль лимфоцитов, редко бывают сопутствующими, что позволяет предположить, что они не связаны между собой и участвуют в различных основных путях канцерогенеза.
Микропапиллярная карцинома желудка — это недавно признанный гистологический вариант, характеризующийся небольшими папиллярными скоплениями опухолевых клеток без отчетливого фиброваскулярного ядра (). Микропапиллярные особенности часто отмечаются на глубоко продвигающемся крае опухоли, окруженном пустым пространством, имитирующим ретракционный артефакт. Микропапиллярная карцинома желудка, как и ее аналог в других органах, имеет тенденцию образовывать эндолимфатические опухолевые эмболы и метастазировать в лимфатические узлы. Однако общая выживаемость при микропапиллярной карциноме желудка, в отличие от таковой в других органах, по-видимому, существенно не отличается от обычной аденокарциномы желудка, хотя результат может быть связан с небольшой выборкой пациентов в этом исследовании (11 пациентов) (35).
