Что такое тромбоз или эмболия
Под тромбозом понимается закупорка сосуда сгустком крови; таким сосудом может быть вена или артерия. Типичными примерами закупорки артерий является инфаркт миокарда и апоплексия; тромбоз ножных вен является типичным примером закупорки венозной системы. Лечение артериальных тромбозов проводится соответствующими специалистами (кардиологами, неврологами).
Эмболия – это закупорка сосудов материалом, отделившимся от сгустка крови. Типичный пример – легочная эмболия, причиной которой становится оторвавшийся кусок тромба при наличии тромбоза ножных вен. Этот кусок тромба и закупоривает легочную артерию.Тромбоэмболии вен являются частыми событиями, которые с возрастом только учащаются. К тромбоэмболическим заболеваниям относятся: тромбоз ножных вен и/или эмболии легких, а также — поверхностные тромбозы (так называемые тромбофлебитиды) и тромбозы внутренних органов.
Причины
Причины венозных тромбозов многообразны. Различают так называемые идиопатические тромбозы, возникающие без каких-либо явных причин, и тромбозы, причины возникновения которых ясны. Причиной возникновения тромбоза может быть напр., неподвижность после операции, беременность или прием противозачаточных пилюль. Кроме того, тромбозы стали чаще возникать при злокачественных заболеваниях.
Склонность к тромбозам может усилиться в связи с изменениями системы свертываемости крови, причем такие изменения могут быть врожденными или приобретенными. Если такие изменения произошли, то речь идет о тромбофилии. Примерами таких изменений являются: АРС-резистентность при мутации фактора 5, мутация фактора 2, дефицит протеина С или протеина S, дефицит антитромбина, персистирующий повышенный фактор 8, подтверждение наличия волчаночного антикоагулянта (Lupus-Antikoagulans) и/или фосфолипидных антител.
Чаще всего, у пациентов с тромбозами находят мутацию фактора 5 и – фактора 2, причем риск гетерозиготной мутации (касающейся только одного гена) повышается незначительно.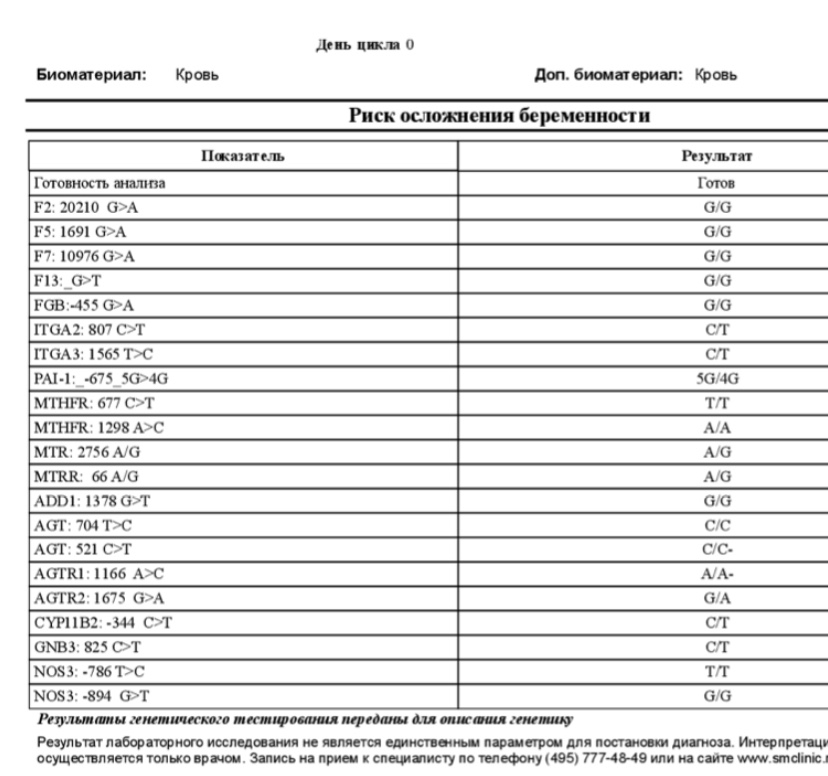 Если мутируют оба гена (так называемая гомозиготная мутация) то риск повышается, особенно – в сочетании с другими факторами. Явно высокому риску подвержены лица с дефицитом антитромбина III, протеина С и с наличием фосфолипидных антител, причем врожденный дефицит антитромбина и протеина С встречается очень редко.
Если мутируют оба гена (так называемая гомозиготная мутация) то риск повышается, особенно – в сочетании с другими факторами. Явно высокому риску подвержены лица с дефицитом антитромбина III, протеина С и с наличием фосфолипидных антител, причем врожденный дефицит антитромбина и протеина С встречается очень редко.
Диагноз
Диагностика тромбоза ножных вен основывается на анамнезе (например, наличии факторов риска), клинической симптоматике, определении уровня D-димеров и результатах визуализации. Клиническая симптоматика может быть очень разнообразной: от нехарактерных симптомов (например. «крепатуры») до отечности и болей одной стороны тела.
На основании симптоматики, тромбоз нельзя ни исключить, ни подтвердить наверняка. При нехарактерной симптоматике необходимо определить уровень D-димеров. D-димеры – продукты, возникающие в крови при растворении тромба, присутствие которых в крови можно определить с помощью разных лабораторных анализов. Но поскольку D-димеры могут появиться в процессе иных событий (например, после операции, при инфекции, во время беременности, при стрессе и мн. др.), то наличие высокого уровня D-димеров еще не означает наличия тромбоза. Если уровень D-димеров нормальный, то, при налички нехарактерных симптомов, тромбоз, скорее всего, можно исключить и отказаться от дальнейшей диагностики. С другой стороны, при типичной симптоматике, можно отказаться от определения уровня D-димеров и сразу же проводить дальнейшую диагностику. В качестве стандартной диагностики, в настоящее время признано компрессионное УЗИ ножных вен. Применение рентгена с использованием контрастного вещества (флебографии) на сегодняшний день необходимо только в исключительных случаях.
Дифференциальная диагностика
От уточнения наличия тромбофилии при остром тромбозе, в частности, если существует подтверждение события, вызвавшего его, можно отказаться, поскольку подтверждение тромбофилии не влияет на назначение изначальной терапии и определение продолжительности антикоагуляции (разжижения крови). При остром тромбозе также изменяются показатели тромбофильных маркеров, поэтому нельзя однозначно утверждать, является ли подтвержденное изменение врожденным, либо его следует оценивать на фоне острого тромбоза. При антикоагуляции маркумаром (Marcumar®) также невозможно провести полную диагностику тромбофилии, поскольку маркумар вызывает изменения различных факторов свертываемости крови. В целом, отношение к определению тромбофильных факторов, становится все более критическим, поэтому, при появлении тромбоза, не рекомендуется проводить общее исследование (general screening) на наличие тромбофилии, а рекомендуется индивидуальное консультирование.
При остром тромбозе также изменяются показатели тромбофильных маркеров, поэтому нельзя однозначно утверждать, является ли подтвержденное изменение врожденным, либо его следует оценивать на фоне острого тромбоза. При антикоагуляции маркумаром (Marcumar®) также невозможно провести полную диагностику тромбофилии, поскольку маркумар вызывает изменения различных факторов свертываемости крови. В целом, отношение к определению тромбофильных факторов, становится все более критическим, поэтому, при появлении тромбоза, не рекомендуется проводить общее исследование (general screening) на наличие тромбофилии, а рекомендуется индивидуальное консультирование.
Терапия
В настоящее время, терапия тромбоза, по возможности, проводится амбулаторно, причем в постельном режиме, как правило, нет необходимости. Проводится компрессионная терапия с помощью компрессионных чулок, а также изначальная терапия низкомолекулярным гепарином (NMH). Одновременно, для антикоагуляции, можно начать оральный прием маркумара, причем здесь необходимо проверить эффективность с помощью определения уровня INR. При тромбозе ножных вен, следует стремиться к показателям INR в пределах 2-3. При достижении желаемых показателей INR, прием NMH следует прекратить. Продолжительность антикоагуляции зависит от разных факторов и может варьироваться от 6 недель до пожизненной. Особая ситуация складывается с пациентками, заболевшими тромбозом во время беременности, либо ранее перенесшими тромбоз или легочную эмболию. В таких случаях следует принимать решение по индивидуальной терапии, а общих терапевтических рекомендаций в таких случаях давать нельзя.
Роль приобретенных и наследственных факторов тромбофилии в развитии осложнений беременности
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ.
Изучение осложнений течения беременности за последние годы, значительно расширили представления о наследственных и приобретенных формах тромбофилии, которые могут быть основной причиной осложненной беременности [41, 48, 86].
Среди аутоиммунных процессов, ведущих к нарушению течения беременности, основное место занимает АФС.
Частота обнаружения аКЛ в сыворотках крови здоровых людей варьирует от 0 до 14,0%, составляя в среднем 2,0-4,0% (в высоком титре менее 0,2%). В общей популяции АФС чаще выявляется у женщин. Антитела к фосфолипидам среди беременных с физиологическим течением беременности встречаются в 5,0-7,0% наблюдений [140, 187, 237].
Частота встречаемости аФЛ увеличивается с возрастом, возрастает у больных некоторыми воспалительными заболеваниями, аутоиммунными и инфекционными заболеваниями,- злокачественными новообразованиями, на фоне приема широко распространенных лекарственных препаратов (оральные контрацептивы, психотропные средства и др.) [234].
С другой стороны есть данные, что заболевание чаще развивается в молодом возрасте. АФЛ нередко встречается у детей и даже у новорожденных [55].
Антитела к фосфолипидам представляют собой семейство аутоантител, распознающих антигенные детерминанты анионных и нейтральных фосфолипидов, и комплексные соединения, образующиеся в процессе взаимодействия фосфолипидов и ф’осфолипидсвязывающих белков.
Клинические проявления АФС развиваются у 30,0% пациентов с В А и у 30,0-50,0% больных, имеющих умеренный или высокий уровень аКЛ [105, 108].
E. Oger et al. (1997) обнаружили увеличение IgG-aKJI и особенно IgM-аКЛ в общей популяции больных тромбозами глубоких вен голени у 60,0% женщин [263]. По данным других исследователей 50,0% беременных с ТЭО имеют повышенный уровень аФЛ [35, 44, 45].
В настоящее время не вызывает сомнений, что АФС играет ведущую роль в структуре акушерских осложнений, обусловленных патологией гемостаза. Будучи распространенной формой тромбофилии, АФС может значительно усугублять уже имеющуюся тромбофилию. Кроме того, АФС нередко сочетается с разнообразными, в том числе и мультигенными причинами тромбофилий, что вызывает декомпенсацию гемостаза в виде тромботических и тромбогеморрагических осложнений. фактора V; мутация гена MTHFR, приводящая к гипергомоцистеинемии; мутация протромбина.
фактора V; мутация гена MTHFR, приводящая к гипергомоцистеинемии; мутация протромбина.
Следует отметить, что выше изложенные генетические дефекты гемостаза относятся к наиболее опасным причинам развития артериальных и венозных тромбозов в клинической практике. Установлена четкая связь приобретенной и генетически обусловленной формами тромбофилии не только с рецидивирующими тромбозами, инфарктами миокарда, инсультами, но и с некоторыми распространенными формами акушерской патологии.
Антифосфолипидный синдром встречается часто у женщин с привычным невынашиванием. По данным разных авторов в 27,0-42,0% [72, 118, 137,210].
По данным А. С. Кидралиевой (1996), АФС выявляется в 27,0-36,0% случаев невынашивания беременности, а по результатам исследования D. Branch et al. (1997), АФС является причиной потери плода в 10,0-48,0% случаев, по данным М. Stephenson (1999) — в 5,0-15,0% [37, 114, 305].
Также многие исследователи доказали наличие высоких уровней аФЛ у беременных с тяжелым гестозом [18, 19, 68, 78, 83, 252, 253].
Кроме того, доказана роль АФС в развитии таких осложнений как СЗРП, ПН, хроническая гипоксия плода, антенатальная гибель плода во II и III триместрах беременности, гипертензионный синдром во время беременности [26, 58, 61, 71, 112,135].
По данным Е.Л. Насонова и соавт. (1995) антенатальные потери при СКВ составляют 91,0% у больных с наличием аФЛ и только 6,0% у больных без аФЛ [54].
Беременные с АФС относятся к группе высокого риска по развитию таких осложнений, как неразвивающаяся беременность в I и во II триместрах, преждевременная отслойка нормально расположенной плаценты [131, 203, 213, 227, 240].
Доказано, что аФЛ подавляют активность естественных антикоагулянтов — белков С и S, AT-III, кофактора эндотелия — ТМ, а также простациклина, обладающего мощным сосудорасширяющим и антиагрегантным действием [36, 56, 60, 85, 265, 266, 318].
Это способствует развитию хронического синдрома ДВС с ранних сроков беременности и таким ^образом, нарушает нормальные процессы имплантации, формирования плаценты, роста и развития эмбриона и плода [51,84, 150, 171,306]./73/73.jpg)
Нарушения в микроциркуляторном русле с ростом беременности ведут к нарастанию признаков ПН, хронической гипоксии плода, а также к возможным тромботическим осложнениям у матери [20, 49, 52, 72, 174].
Кроме того, в литературе широко обсуждается вопрос прямого повреждающего воздействия аФЛ на синцитиотрофоблает с последующим развитием первичной ПН [178, 215, 272, 295, 298].
Установлена связь приобретенной и генетически обусловленной формами тромбофилии не только с рецидивирующими тромботическими и/или ТЭО, но и с такими распространенными формами акушерской патологии, как синдром потери плода, гестозы, преждевременная отслойка нормально расположенной плаценты [113, 196, 285].
Тем не менее, в литературе не достаточно освещены следующие вопросы: частота встречаемости наследственной и приобретенной форм тромбофилии во время беременности, значение их в развитии акушерской патологии. Не выработана единая тактика обследования, ведения беременности, родов и послеродового периода у пациенток с АФС и генетическими дефектами системы гемостаза.
Учитывая вышеизложенное, целью исследования явилось определение значения роли антител к фосфолипидам и фосфолипидсвязывающим белкам и генетически обусловленных дефектов системы гемостаза в развитии осложнений беременности, для выработки методов профилактики, и лечения беременных с антифосфолипидным синдромом и наличием генетически обусловленных дефектов системы гемостаза.
Для выполнения этой цели были определены следующие задачи исследования:
1. Определить частоту встречаемости антител к фосфолипидам и фосфолипидсвязывающим белкам, а также генетических дефектов тромбофилии у беременных с физиологическим течением беременности.
2. Определить частоту встречаемости антител к фосфолтпидам и фосфолипидсвязывающим белкам, а также генетических дефектов тромбофилии у беременных с акушерской патологией и выявить группу риска по возникновению тромботических осложнений. I. .»„’Ml м 11 < •»
3. Изучить систему гемостаза у беременных с наличием акушерской патологии и повышенным уровнем аФЛ, антител к фосфолипидсвязывающим белкам и генетическими формами тромбофилии.
4. На основании полученных результатов обследования новорожденных от матерей с АФС на наличие аФЛ и фосфолипидсвязывающим белкам, доказать возможность трансплацентарной передачи антител к фосфолипидам и фосфолипидсвязывающим белкам.
5. Оценить состояние плацентарной ткани у беременных с наличием повышенного уровня антител к фосфолипидам и фосфолипидсвязывающим белкам, а также с генетическими формами тромбофилии, как одной из причин влияющих на состояние плода и течение беременности.
6. Выработать алгоритм обследования и тактику ведения беременности, родов и послеродового периода у беременных с выявленными наследственными и приобретенными формами тромбофилии.
7. Разработать клинические и лабораторные критерии эффективности комплексной терапии с применением низкомолекулярного гепарина во время беременности, родов и послеродового периода у беременных с наследственной и приобретенной формой тромбофилии.
НАУЧНАЯ НОВИЗНА.
На основании проведенных исследований впервые выявлена частота встречаемости антител к фосфолипидам и фосфолипидсвязывающим белкам и генетически обусловленных дефектов гемостаза при физиологическом течении беременности.
Установлены границы .степеней позитивности показателей антител к фосфолипидам и фосфолипидсвязывающим белкам у беременных с физиологическим течением беременности.
В результате проведенных исследований получены новые современные данные о патогенезе, клиническом проявлении и диагностике наследственных и приобретенных форм тромбофилии в акушерстве.
Выявлено значение аФЛ и фосфолипидсвязывающим белкам, а также генетической патологии системы гемостаза в развитии акушерских осложнений.
Доказана трансплацентарная передача антител к фосфолипидам и фосфолипидсвязывающим белкам от матери к новорожденному.
Выработан алгоритм обследования пациенток групп риска по возникновению антифосфолипидного синдрома.
Выработан алгоритм ведения беременности, родов и послеродового периода у беременных с АФС и генетическими формами тромбофилии.
Разработаны клинические и лабораторные критерии эффективности комплексного лечения с применением низкомолекулярного гепарина во время беременности, родов и послеродового периода у беременных с наследственной и приобретенной формами тромбофилии.
Проведена электронная микроскопия плацент у пациенток с АФС и генетическими формами тромбофилии.
Доказано, что антитела к фосфолипидам и фосфолипидсвязывающим белкам, а также генетические формы тромбофилии влияют на клеточные структуры плацентарной ткани, способствуют нарушению плацентации, неполноценной инвазии трофобласта и ремоделированию спиральных артерий ведущих к нарушению плацентарной перфузии, и как следствие к ухудшению состояния плода, патологическому течению беременности и родов.
ПРАКТИЧЕСКАЯ ЦЕННОСТЬ.
Проведенное исследование доказывает, что обследование пациенток на антитела к фосфолипидам и фосфолипидсвязывающим белкам, а также на генетические формы тромбофилии является методом выявления пациенток группы высокого риска по развитию акушерской патологии.
Повышенный уровень антител к фосфолипидам и фосфолипидсвязывающим белкам, наличие генетической патологии системы гемостаза до беременности или в начале I триместра беременности дает возможность прогнозировать осложненное течение беременности: привычное невынашивание, угрозу прерывания беременности, неразвивающуюся беременность, СЗРП, гестоз, тромботические и/или ТЭО.
Наличие повышенных уровней aKJI-IgG, b2-rni-IgG, В А и генетической патологии системы гемостаза являются лабораторными маркерами угрожающих тромботических осложнений.
Наличие повышенных уровней аКЛ-IgM, b2-rni-IgM, В А и генетической патологии системы гемостаза характерны для пациенток с привычным невынашиванием беременности и для пациенток с неразвивающейся беременностью.
Для беременных с гестозом характерно наличие аКЛ-IgM и IgG, Ь2-rni-IgG и IgM, В А и генетической патологии системы гемостаза.
Выявление у новорожденных повышенного уровня аФЛ и антител к фосфолипидсвязывающим белкам дает возможность целенаправленного дальнейшего обследования и наблюдения для профилактики осложнений, вызываемых наличием антител к фосфолипидам и фосфолипидсвязывающим белкам.
Патогенетически обоснована комплексная терапия с применением низкомолекулярного гепарина во время беременности, родов и послеродового периода.
Разработаны объективные’ .критерии эффективности лечения и профилактики осложнений у беременных, вызванных АФС и генетическими формами тромбофилии.
ВНЕДРЕНИЕ В ПРАКТИКУ.
Результаты исследования внедрены в работу родильного и гинекологического отделений Московской городской клинической больницы №1 им. Н.И. Пирогова, гинекологического» отделения городской клинической больницы №55, городского клинического родильного дома №10, родильного дома городской больницы №8, а также используются для обучения студентов, врачей — интернов, ординаторов, аспирантов, слушателей ФПК и ФУВ в Российском Государственном медицинском университете.
Основные положения работы были представлены на II съезде акушеров-гинекологов Северного Кавказа (1998), Международном симпозиуме «Актуальные вопросы диагностики, профилактики и лечения гестоза» (1998), V конгрессе международной ассоциации морфологов (2000), VII Российском национальном конгрессе «Человек и Лекарство» (2000), V Всероссийской конференции «Тромбозы, геморрагии, ДВС-синдром. Проблемы лечения» (2000), Пленуме Российской ассоциации врачей акушеров — гинекологов (2000), II Российском форуме «Мать и Дитя» (2000), III Российском форуме «Мать и Дитя» (2001), IX Российском национальном конгрессе «Человек и Лекарство» (2002), IV Российском форуме «Мать и Дитя» (2002), V Международной конференции «Здоровье, труд, отдых в XXI веке. Профилактика, лечение, реабилитация в различные периоды жизни человека» (2002).
ПУБЛИКАЦИИ.
По теме диссертации опубликованы 40 научные работы (статьи в центральной печати, в сборниках, методические рекомендации, учебное пособие, монография). . „::; ‘>
СТРУКТУРА И ОБЪЕМ РАБОТЫ.
Диссертация состоит из введения, 6 глав, заключения, выводов, практических рекомендаций, указателя литературы. Диссертация изложена на 317 страницах машинописного текста, содержит 20 рисунков, 74 таблиц. Список литературы включает в себя 327 источников, из них 86 отечественных, 241 иностранных авторов.
Список литературы включает в себя 327 источников, из них 86 отечественных, 241 иностранных авторов.
Фактор Виллебранда
Фактор Виллебранда
Исследование уровня антигена фактора Виллебранда.
С какой целью выполняется услуга:-
Определение фактора Виллебранда в крови целесообразно при выявлении кровоточивости, подозрительной на наличие болезни Виллебранда, при снижении содержания VIII фактора неясного происхождения.
-
Определение этого фактора проводится для определения активности системных васкулитов, сопряженных с массивным повреждением эндотелия.
Показания для выполнения услуги:
-
Кровоточивость;
-
Диагностика и последующий мониторинг врожденной и приобретенной болезни Виллебранда;
-
Диагностика тромбофилии;
-
Дифференциальная диагностика гемофилии А.
Исследование рекомендуется проводить:
-
после оценки первичных параметров свертывания крови (АЧТВ) и тромбоцитов;
-
частые и/или длительные кровотечения, особенно у детей;
-
снижение фактора VIII;
-
выявление болезни фон Виллебранда у кровного родственника.
Как готовиться пациенту к услуге:
-
исследование проводится утром натощак, ужин накануне не позже 18 часов, затем до самого взятия крови прием пищи не допустим;
-
перед взятием крови нежелательно проведение каких-либо инвазивных диагностических и лечебных манипуляций (эндо-скопическое исследование и т.
 д.), физиотерапевтических процедур;
д.), физиотерапевтических процедур;
-
необходимо избегать тяжелых физических нагрузок (спортивные тренировки и проч.), переохлаждения и перегревания;
- перед исследованием разрешается прием воды и лекарственных препаратов, назначенных врачом.
Референсные значения:
- 50-160% (6 -15 мкг/мл)
Областной центр клинической лабораторной диагностики
Областной центр клинической лабораторной диагностики (ОЦКЛД) был организован в марте 2008 года на функциональной основе на базе клинико-диагностического лабораторного комплекса (КДЛК) ГАУ РО Областной консультативно-диагностический центр (ОКДЦ) для оказания эффективной, доступной лабораторно-диагностической помощи населению Ростовской области и г. Ростова-на-Дону.
ОЦКЛД выполняет функции ведущей структуры в системе лабораторной службы региона и реализует в рамках гарантированных объемов Территориальную программу государственных гарантий оказания гражданам Российской Федерации бесплатной медицинской помощи в Ростовской области. Для выполнения поставленных задач ОЦКЛД имеет материально-техническую базу, высококвалифицированные кадры, лабораторно-диагностические ресурсы ОКДЦ. В ОЦКЛД входят лаборатории: клинико-гематологических исследований, клинической биохимии и иммунологии, клинической микробиологии, патоморфологии и молекулярно-биологических исследований.
Задачей ОЦКЛД является проведение комплекса лабораторно-диагностических исследований пациентам медицинских организаций (МО) Ростовской области и города Ростова-на-Дону, основываясь на новейших наукоемких и эффективных технологиях и организационно-методических формах работы.
Для проведения лабораторных исследований в ОЦКЛД доставляется различный биологический материал (кровь, костный мозг, мокрота, промывные воды бронхов, мазки из носа, зева, мочеполовой системы, отделяемое ран, гистологические блоки, соскобы и др. ) собранный по месту жительства. Доставка биоматериала в ОКЦЛД осуществляется в соответствии с согласованным графиком курьерами на транспорте направляющей МО. В исключительных случаях (невозможность транспортировки биоматериала в силу неустойчивости отдельных компонентов) взятие биоматериала может осуществляться непосредственно в ОКДЦ по предварительной договоренности. В этом случае пациент должен иметь при себе направление по форме, разработанной ОКДЦ, заверенное печатью МО и личной печатью лечащего врача. Исследованию подлежит биоматериал пациентов, имеющих полис обязательного медицинского страхования.
) собранный по месту жительства. Доставка биоматериала в ОКЦЛД осуществляется в соответствии с согласованным графиком курьерами на транспорте направляющей МО. В исключительных случаях (невозможность транспортировки биоматериала в силу неустойчивости отдельных компонентов) взятие биоматериала может осуществляться непосредственно в ОКДЦ по предварительной договоренности. В этом случае пациент должен иметь при себе направление по форме, разработанной ОКДЦ, заверенное печатью МО и личной печатью лечащего врача. Исследованию подлежит биоматериал пациентов, имеющих полис обязательного медицинского страхования.
Направления на лабораторные исследования в ОЦКЛД оформляются через РС ЕГИСЗ.
В перечень исследований, выполняемых в ОЦКЛД, входят, в том числе, высокотехнологичные, сложные и редкие диагностически значимые услуги.
Важное медико-социальное значение имеет ранняя диагностика онкогематологических заболеваний с целью оказания своевременной специализированной помощи. В ОЦКЛД диагностика острых лейкозов, дифференциальная диагностика В- и Т-клеточных лимфопролиферативных заболеваний, выявление минимальной резидуальной болезни при острых лейкозах и лимфопролиферативных заболеваниях выполняется методом лазерной проточной цитофлюориметрии. Применение электрофореза с иммунофиксацией позволяет осуществлять завершенную диагностику парапротеинемических гемобластозов.
В рамках ОЦКЛД проводится исследование иммунного статуса, с целью определения характера и степени иммунных нарушений.
Наиболее полную характеристику всех звеньев гемостаза в Ростовской области возможно осуществить только в ОЦКЛД. Здесь проводятся тесты, необходимые для диагностики сложных нарушений в системе гемостаза: коагулограмма развернутая с определением плазмина, факторов свертывания (VIII, IX, XIII), Д-димера; активность системы протеина С и резистентность к активированному протеину С, волчаночный антикоагулянт, фактор Виллебранда, антиген Виллебранда, тест тромбодинамика, определение агрегационной активности тромбоцитов для выявления чувствительности к дезагрегантам.
В ОЦКЛД реализована комплексная и дифференциальная диагностика анемий сложного генеза с применением биохимических, иммунологических, гематологических тестов, в том числе исследование фракционного состава ретикулоцитов и эритроцитограммы с построением кривой Прайс-Джонса.
Важным направлением деятельности ОЦКЛД является диагностика инфекционных заболеваний человека: инвазивных микозов (кандидоза и криптококкоза), острых инфекционных диарейных заболеваний вирусной и протозойной этиологии, острых респираторных заболеваний, включая вирус гриппа и новую коронавирусную инфекцию.
В рамках ОЦКЛД выполняются исследования методом иммуногистохимического анализа срезов тканей с целью диагностики и определения иммунофенотипа лимфопролиферативных заболеваний, мягкотканых опухолей, гистогенеза метастазов при невыявленном первичном очаге. Молекулярно-биологический анализ методом ПЦР в реальном времени проводится для определения генетической предрасположенности к тромбозам (мутации в генах), генотипирования гепатита С, определения вирусной нагрузки при гепатитах В и С.
С 2008 года в ОЦКЛД проводится диагностика патологии шейки матки методом жидкостной цитологии с одновременным ВПЧ-тестированием.
Благодаря наличию в ОЦКЛД высококвалифицированного персонала и мощной приборной базы, для диагностики используется одновременно широкий спектр исследований, выполняемых с применением различных технологий: молекулярно-биологических, культуральных, иммунохимических, иммуноферментных, биохимических, проточной цитометрии, классической микроскопии. Такой подход позволяет выявлять патологию на ранней стадии, осуществлять качественный мониторинг заболевания.
Руководитель ОЦКЛД: заведующая лабораторией клинико-гематологических исследований, к.б.н. Крайнова Наталья Николаевна.
Контактные телефоны: 8(863)218-01-45, 8(863)255-79-13; 8(863) 255-79-12; 8(863)240-35-33;8(863)240-29-67.
ГАУЗ СО «Клинико-диагностический центр город Екатеринбург» :: Лаборатория клинической генетики
Медицинские манипуляции НЕ ПРОВОДЯТСЯ детям младше 3 лет
|
Лаборатория выполняет исследования для лечебно-профилактических учреждений города и частных лиц. Лаборатория ежегодно успешно участвует в Федеральной программе контроля качества (ФСВОК). Основным направлением деятельности лаборатории генетики является исследование причин нарушения репродуктивной функции, таких как бесплодие и невынашивание беременности. |
|
Выполняемые исследования: |
|
|
1. Цитогенетический анализ (кариотипирование). 2. Кариотипирование материала замершей беременности. 3. Определение HLA-совместимости супружеской пары по HLA I класса (локусы А, В, Cw). 4. Лимфоцитотоксический тест (определение антител к лимфоцитам мужа в крови у женщин с невынашиванием беременности) 5. Определение HLA-фенотипа (I класс). 6. Генотипирование по HLA II класса по трем локусам (DRB1, DQA1, DQB1) 7. Генотипирование по HLA II класса по двум локусам (DQA1, DQB1) 8. Диагностика наследственных тромбофилий: определение 8 мутаций в генах системы свертывания крови (F2, F5, F7, F13, FGB, PAI-1, ITGA2, ITGB3) и 4 мутаций в генах фолатного цикла (MTHFR 677, MTHFR 1298, MTR, MTRR) 9. Определение антифосфолипидных антител (АФА) (суммарные антитела к кардиолипину, фосфатидил-серину, фосфатидил-инозитолу и фосфатидиловой кислоте, антитела к белкам-кофакторам: бета-2-гликопротеину1, аннексину V, протромбину). 10. Определение антиспермальных антител (АСАТ) в сыворотке крови. 11. Определение антиспермальных антител в сперме (mar-тест IgA, IgG, латексная агглютинация). 12. Диагностика причин нарушения сперматогенеза (выявление микроделеций AZF-локуса и мутаций гена CFTR) 13. Определение полиморфизмов в гене интерлейкина 28В (определение восприимчивости к лечению гепатита С) 14. Генотипирование HLA-B27 (диагностика ревматологических заболеваний) |
Цитогенетическое исследование (кариотипирование)
Одной из ведущих генетических причин нарушения репродукции являются хромосомные аномалии. В процессе репродукции участвует несколько сторон (мать, отец, плод). Генетические нарушения могут касаться каждого участника репродуктивного процесса. Генетическая информация, передаваемая плоду, содержится в половых клетках (гаметах) — сперматозоидах и яйцеклетках. Нарушения в процессе образования и созревания гамет могут приводить к генетическому дисбалансу у зиготы, зародыша и плода.
Генетический дисбаланс у зародыша в подавляющем большинстве случаев приводит к остановке развития и отторжению плодного яйца. Во многих случаях такое отторжение происходит на очень ранних стадиях развития, в первые дни или часы после зачатия, и не сопровождается задержкой месячных или другими признаками беременности. Такие пациенты могут иногда годами обследоваться и лечиться по поводу бесплодия или невынашивания беременности, не подозревая, что главной причиной нарушений репродуктивной функции являются генетические факторы.
В некоторых случаях генетические нарушения у супругов приводят к абсолютной неспособности сперматозоидов или яйцеклеток к оплодотворению. Своевременное выявление подобных нарушений может дать возможность выбрать альтернативные пути лечения бесплодия (использование донорских сперматозоидов или донорской яйцеклетки).
Основным методом диагностики хромосомных нарушений в медицине репродукции является цитогенетическое обследование (кариотипирование).
При бесплодии и невынашивании беременности кариготипирование необходимо провести обоим партнерам супружеской пары.
Причиной I и II аменореи у женщин могут быть хромосомные нарушения, связанные с изменением числа или структуры Х-хромосом. Выявить эти изменения можно так же с помощью цитогенетического анализа.
Множественные врожденные пороки развития у ребенка могут быть вызваны хромосомными нарушениями. Цитогенетический анализ позволяет выяснить есть ли хромосомные аномалии у больного ребенка, произошли ли они как мутация de novo в гаметогенезе кого-то из родителей или передались по наследству от одного из родителей. Все это позволяет оценить риск повторного рождения больного ребенка в семье.
Материал для исследования: венозная кровь, взятая в стерильных условиях в специальные пробирки с антикоагулянтом гепарином.
Прием материала: по муниципальному заказу: в понедельник, вторник, пятницу с 8 до 11 часов;
платно: в понедельник, вторник, пятницу с 8.00 до 12.00.
Готовность результата: через 3 недели.
Исследование кариотипа материала замершей беременности
Если остановка развития плода произошла на ранних этапах беременности (5-12 недель) можно провести исследование кариотипа погибшего эмбриона, что позволит установить были ли у плода хромосомные нарушения, вследствие чего и произошла остановка развития.
Материал для исследования: предварительно необходимо взять в лаборатории контейнер с транспортной средой, после получения материала (ворсины хориона) необходимо сразу доставить в лабораторию.
Приемные дни: понедельник – пятница с 8.00 до 12.00 часов.
Готовность результата: через 3 недели.
Определение генетических причин нарушения сперматогенеза
(выявление микроделеций AZF-локуса и мутаций гена CFTR)
Половина всех бесплодных пар страдает из-за неспособности мужского организма к оплодотворению. При исключении анатомических, гормональных и инфекционных факторов азоо- или олигозооспермии это состояние может определяться генетическими нарушениями (мутациями генов AZF и CFTR). Процесс сперматогенеза контролируется большим количеством генов, расположенных как на аутосомах, так и на половых хромосомах, в особенности на Y-хромосоме. Мутации этих генов могут приводить к нарушению подвижности, морфологических и фертильных свойств сперматозоидов, блоку сперматогенеза.
При исключении анатомических, гормональных и инфекционных факторов азоо- или олигозооспермии это состояние может определяться генетическими нарушениями (мутациями генов AZF и CFTR). Процесс сперматогенеза контролируется большим количеством генов, расположенных как на аутосомах, так и на половых хромосомах, в особенности на Y-хромосоме. Мутации этих генов могут приводить к нарушению подвижности, морфологических и фертильных свойств сперматозоидов, блоку сперматогенеза.
AZF-локус расположен в Y-хромосоме и кодирует факторы азооспермии. Микроделеции (потери участка гена) в AZF-локусе являются основной генетической причиной мужского бесплодия. Частота обнаружения AZF-микроделеций в среднем составляет 10-15% среди пациентов с азооспермией, 5-10% — среди пациентов с олигозооспермией тяжелой степени.
Обструктивная азооспермия в 25% случаев является следствием одностороннего или двухстороннего врожденного отсутствия семявыносящих протоков. 60-70% пациентов c врожденным отсутствием семявыносящих путей являются гетерозиготными носителями мутации по гену CFTR, а 30-40% пациентов – гомозиготами. Ген CFTR кодирует трансмембранный регуляторный белок. Наличие мутаций в обеих копиях гена CFTR ведет, как правило, к развитию аутосомно-рецессивного заболевания – муковисцидоза. Врожденное отсутствие семявыносящих путей считают легкой формой муковисцидоза. Наличие у мужчины обструктивной азооспермии неясной этиологии – это показание для молекулярно-генетической диагностики гена CFTR у него и его супруги. По данным литературы в 10% у мужчин, страдающих бесплодием, выявляют сочетание делеций в AZF-локусе и наличие мутаций в CFTR гене.
В нашей лаборатории выполняется комплексное исследование по определению генетических причин нарушения сперматогенеза, включающее в себя одновременное выявление микроделеций в AZF-локусе и мутаций в гене муковисцидоза CFTR.
Материал для исследования: венозная кровь, взятая натощак.
Приемные дни: понедельник- суббота с 8. 00 до 12.00 часов.
00 до 12.00 часов.
Готовность анализа: 2 недели.
Диагностика иммуногенетических причин невынашивания беременности
(определение HLA-совместимости партнеров)
Особое место в медицинской генетике занимает иммуногенетика. Иммуногенетика изучает наследование генов, определяющих уникальность каждого человека, генов тканевой совместимости. Иногда неблагоприятные сочетания таких генов у супругов приводят к повышению риска отторжения плодного яйца. Диагностировать подобные случаи бесплодия и невынашивания беременности помогают такие методы, как иммуногенетическое обследование супругов (HLA-типирование).
Система HLA состоит из антигенов I и II классов. Антигены I класса представлены практически на всех клетках человеческого организма. II класс антигенов находятся преимущественно на клетках иммунной системы, макрофагах и эпителиальных клетках.
Совместимость супругов по антигенам HLA-системы приводит к тому, что эмбрион становится слишком «похож» на организм матери. Такое «сходство» способствует недостаточной антигенной стимуляции иммунной системы матери, поэтому реакции организма, ответственные за сохранение беременности, не активизируются. Это приводит к тому, что плод воспринимается иммунной системой организма как чужеродное тело, в результате чего происходит выкидыш. В некоторых случаях совпадения генов HLA-системы возникает анэмбриония (неразвивающаяся беременность).
В нашей лаборатории проводится исследование совместимости партнеров супружеской пары по HLA-антигенам I класса (локусы HLA-A, B, Cw), для этого определяется HLA-фенотип жены и HLA-фенотип мужа и оценивается количество одинаковых антигенов. Дополнительно сыворотка жены исследуется на наличие анти-HLA-антител к лимфоцитам мужа.
Материал для исследования: венозная кровь мужа и жены.
Приемные дни: по муниципальному заказу: понедельник – четверг, с 8.00 до 11. 00 часов; платно: понедельник – пятница, с 8.00 до 12.00 часов.
00 часов; платно: понедельник – пятница, с 8.00 до 12.00 часов.
Готовность результата: через 3 дня.
Кроме того для супружеских пар с репродуктивными нарушениями в лаборатории выполняется генотипирование HLA II класса по трем локусам DRB1, DQA1 и DQB1. Исследуется HLA-II генотип, обоих партнеров, в результате чего делается заключение о наличии совпадений или о полном несовпадении генотипов мужа и жены. Полное несовпадение партнеров по генам HLA класса II является благоприятным фактором для развития беременности.
Материал для исследования: венозная кровь мужа и жены.
Приемные дни: понедельник- суббота с 8.00 до 12.00 часов.
Готовность анализа: 2 недели.
Диагностика антифосфолипидного синдрома (АФС)
Иммунологические причины невынашивания беременности занимают важное место среди причин самопроизвольных выкидышей и обусловлены продукцией организмом аутонтител, направленных против тканей матери, вследствие чего страдает и плод. Одним из иммунологических факторов невынашивания является антифосфолипидный синдром. При данном заболевании вырабатываются антитела к фосфолипидам (АФА) – компонентам клеточных мембран, вследствие чего развиваются различные тромботические осложнения, приводящие к потере беременности на разных сроках, а также к развитию серьезных осложнений беременности – плацентарная недостаточность, гестоз. При обследовании у пациенток с антифосфолипидным синдромом выявляются антифосфолипидные антитела.
В нашей лаборатории приводится комплексное исследование антифосфолипидных антител, которое включает в себя не только определение суммарных антител к отрицательно заряженным фосфолипидам мембран (кардиолипину, фосфатидил-серину, фосфатидил-инозитолу и фосфатидиловой кислоте), но и к так называемым белкам-кофакторам, в частности к бета-2-гликопротеину1, к аннексину V, протромбину.
Для исключения ложноположительного результата исследование необходимо проводить минимум через 2 недели после перенесенного инфекционного заболевания. Для исключения ложноотрицательного результата нежелательно проводить анализ на фоне антикоагулянтной терапии.
Для исключения ложноотрицательного результата нежелательно проводить анализ на фоне антикоагулянтной терапии.
Материал для исследования: венозная кровь.
Приемные дни: понедельник- суббота с 8.00 до 12.00 часов.
Готовность анализа: 2 недели.
Определение антиспермальных антител
В организме женщины или мужчины могут вырабатываться антитела к сперматозоидам, которые «склеивают» их, снижают их подвижность, препятствуют процессу оплодотворения.
У мужчин лучше определять антиспермальные антитела в сперме. Определение АСАТ в сыворотке крови является дополнением к анализу спермы. При азооспермии (отсутствии сперматозоидов в сперме) наиболее информативным является определение АСАТ в сыворотке крови.
У женщин следует определять антиспермальные антитела как в цервикальной слизи, так и в сыворотке крови. Обязательным является определение антиспермальных антител у пар, готовящихся к ЭКО, особенно, если женская плазма будет использована как культурная среда в ЭКО-технологиях.
В нашей лаборатории для определения антиспермальных антител используется целый комплекс методов:
— возможно определение антиспермальных антител в сыворотке крови мужчин и женщин методом иммуноферментного анализа
— возможно определение антиспермальных антител у мужчин в сперме, при этом определяются антитела, прикрепленные к поверхности сперматозоидов (IgA и IgG) и антитела, находящиеся в семенной плазме.
Материал для исследования: для исследования антител в сыворотке крови используется венозная кровь.
Приемные дни: понедельник — суббота с 8.00 до 12.00 часов.
Готовность анализа: 2 недели.
При исследовании антител в сперме в лабораторию доставляется эякулят (в течение 40 минут – 1 часа с сохранением температуры тела).
Приемные дни: понедельник — пятница с 8. 00 до 12.00 часов.
00 до 12.00 часов.
Готовность анализа: 1 день.
Диагностика наследственных тромбофилий
(генотипирование полиморфизмов в генах системы свертывания крови и фолатного цикла)
Наследственная тромбофилия представляет собой предрасположенность к тромбозу вследствие генетических дефектов свертывающей и противосвертывающей (антикоагулянтной и фибринолитической) системы крови.
Нарушение фолатного цикла приводит к накоплению гомоцистеина в клетках и повышению в плазме общего уровня гомоцистеина, обладающего выраженным токсическим, атерогенным и тромбофилическим действием.
Генетический анализ позволяет выявить полиморфизмы генов факторов и компонентов системы гемостаза, генов фолатного цикла, которые приводят к их аномальному синтезу или нарушению функциональной активности. Это позволяет оценить риск развития сердечно-сосудистой патологии и акушерско-гинекологических осложнений, тромбоэмболии, венозных и артериальных тромбозов.
Показания к генетическому тестированию на риск наследсвенныхомбофилий
— Случаи наследственной тромбоэмболии в семье
— Случаи тромбоза в анамнезе (единичный тромбоз до 50 лет, повторные тромбозы, случаи тромбоза в любом возрасте при наличии семейного анамнеза, тромбозы необычной локализации)
— Отягощенный акушерский анамнез (ФПН, преждевременная отслойка нормально расположенной плаценты, поздний гестоз)
— Дефекты развития плода (незаращение нервной трубки, анэнцефалии, деформации лицевого скелета)
— Применение гормональной контрацепции или заместительной гормональной терапии у женщин, имеющих тромбозы в анамнезе
— Предстоящие массивные хирургические вмешательства
— Длительная иммобилизация
— Злокачественные новообразования
— Для диагностики наследственных тромбофилий в нашей лаборатории одновременно определяется 12 мутаций.
8 мутаций генов системы свертывания крови:
— F2, F5, F7, F13,
— FGB( фибриноген),
— PAI-1 (серпин-1, антагонист тканевого активатора плазминогена),
— ITGA2 (тромбоцитарный рецептор к коллагену),
— ITGB3 (тромбоцитарный рецептор фибриногена)
— 4 мутации генов фолатного цикла:
— MTHFR 677, MTHFR 1298 (метилен-тетрагидрофолат-редуктаза),
— MTR (метионин-синтаза),
— MTRR (метионин-синтаза-редуктаза)
Материал для исследования: венозная кровь.
Приемные дни: понедельник- суббота с 8.00 до 12.00 часов.
Готовность анализа: 2 недели.
Диагностика наследственной предрасположенности к сахарному диабету I типа
Установление HLA-генетических «маркëров», определëнных вариантов генов HLA класса II, ассоциированных с чувствительностью к аутоиммунным заболеваниям, является подтверждающим при знаком генетически обусловленного аутоиммунного процесса. В связи с этим HLA-генотипирование в комплексе с другими лабораторными исследованиями существенно повышает возможности постановки правильного диагноза и прогноза аутоиммунных заболеваний.
Сахарный диабет (СД) 1 типа является многофакторным аутоиммунным заболеванием с наследственной предрасположенностью, связанной с неблагоприятной комбинацией множества нормальных вариантов генов, контролирующих иммунный ответ.
Гены предрасположенности к СД 1 типа располагаются на нескольких хромосомах. В настоящее время известно более 15 таких генов, однако наиболее значимыми из них являются гены HLA класса II, с которыми генетическую предрасположенность к СД1 связывают более, чем на 50 %.
Прогностическое генотипирование HLA II класса родственников больных позволяет выделить среди них группы с высоким или низким риском развития заболевания, что обеспечивает возможность различной профилактической и врачебной тактики их ведения на ранней, доклинической стадии болезни. Установление HLA-генетических маркëров СД1 в комплексе с иммунологическими и гормональными исследованиями существенно повышает возможности постановки правильного диагноза и прогноза заболевания.
В нашей лаборатории для диагностики наследсвенной предрасположенности к развитию СД I типа выполняется генотипирование HLA-II класса по трем локусам (DRB1, DQA1и DQB1).
Материал для исследования: венозная кровь.
Приемные дни: понедельник- суббота с 8.00 до 12. 00 часов.
00 часов.
Готовность анализа: 2 недели.
Диагностика наследственной предрасположенности к глютенчувствительной целиакии
Другим вариантом заболеваний, где HLA-генотипирование помогает определиться с диагнозом является глютенчувствительная целиакия. Современный стандарт ведения пациентов с подозрением на целиакию в обязательном порядке включает в себя исследование на наличие в генотипе пациента вариантов HLA-DQ2 и/или DQ8.
Для диагностики наследственной предрасположенности к целиакии в нашей лаборатории проводится генотипирование HLA-II класса по двум локусам (DQA1и DQB1).
Материал для исследования: венозная кровь.
Приемные дни: понедельник- суббота с 8.00 до 12.00 часов.
Готовность анализа: 2 недели.
Генетическое тестирование HLA-B27
На сегодняшний день HLA-B27 является хорошо изученным антигеном, имеющим большое значение в дифференциальной диагностике аутоиммунных болезней. Согласно Международной классификации ревматических болезней выделяют отдельную группу спондилоартритов, ассоциированных с антигеном HLA–B27:
|
Заболевание |
Встречаемость HLA-В27, % |
|
Анкилозирующий спондилоартрит |
90-95 |
|
Болезнь Рейтера |
70-85 |
|
Реактивный артрит |
36-100 |
|
Псориатический артрит |
54 |
|
Энтеропатические артриты |
50 |
Показания к генетическому тестированию HLA-B27:
— необходимость исключить анкилозирующий спондилит у больного, родственники которого страдают этим заболеванием,
— дифференциальная диагностика неполной формы синдрома Рейтера (без уретрита или увеита) с гонококковым артритом,
— дифференциальная диагностика синдрома Рейтера, сопровождающегося тяжелым артритом, с ревматоидным артритом,
— при обследовании больных ювенильным ревматоидным артритом.
Материал для исследования: венозная кровь.
Приемные дни: понедельник- суббота с 8.00 до 12.00 часов.
Готовность анализа: 2 недели.
Определение полиморфизмов в гене интерлейкина 28В
(определение наследственной предрасположенности к ответу на терапию хронического гепатита С)
В настоящее время появился генетический маркер, позволяющий прогнозировать эффективность проводимой противовирусной терапии хронического гепатита С: полиморфизм гена интерлейкина 28В (IL28B), который определяет в известной степени чувствительность иммунной системы пациента к стимуляции интерфероном.
Основную роль при инфицировании гепатитом С играют две однонуклеотидные замены в гене IL28B :
— замена цитозина на тимин (C>T), имеющая обозначение rs12979860
— замена тимина на гуанин (T>G), имеющая обозначение rs8099917
Показано, что наибольшее значение полиморфизм IL28B имеет при инфицировании 1 субтипом HCV.
Определение генотипа пациента по IL28B может изменить алгоритм принятия решения о лечении путем изменения длительности как стандартного курса терапии ПЕГ ИФН/РИБ, так и длительности тройной терапии ХГС. Оптимизация терапии позволит избежать многих дополнительных проблем при лечении пациентов с высокой вероятностью положительного ответа при назначении терапии (избежать дополнительных побочных эффектов и дополнительных затрат на тройную терапию с включением ингибиторов протеазы телапревира и боцепревира).
Материал для исследования: венозная кровь, взятая натощак.
Приемные дни: понедельник- суббота с 8.00 до 12.00 часов.
Готовность анализа: 2 недели.
Исследование системы гемостаза в Самаре
Система гемостаза — это биологическая система, обеспечивающая, с одной стороны, сохранение жидкого состояния циркулирующей крови (предотвращение образования тромбов), а с другой, — предупреждение и остановку кровотечений. Именно это свойство системы гемостаза обеспечивает нормальное функционирование организма.
Именно это свойство системы гемостаза обеспечивает нормальное функционирование организма.
Исследование системы гемостаза выполняется в следующих случаях:
- прием гормональных контрацептивов: перед началом использования (для выбора безопасного вида контрацепции) и во время приема КОК (для контроля состояния свертывающей системы) отягощенный акушерский анамнез:
- две и более остановки развития плода
- неудачные попытки ЭКО
- невынашивание беременности
- тяжелый гестоз в анамнезе
- бесплодие
- наличие сердечно-сосудистых заболеваний (особенно после перенесенных инсультов и инфарктов, после операций на сердце)
- наличие у близких родственников в молодом возрасте (младше 40 лет) инфарктов и инсультов
- признаки кровоточивости, как то: носовые кровотечения; наличие множества мелких синячков; длительная кровоточивость при бритье и порезах, из десен, из геморроидальных трещин
- обильные менструальные выделения
- прием непрямых антикоагулянтов (варфарин, дикумарол, фенилин), низкомолекулярных гепаринов (фраксипарин, дельтапарин, клексан, фрагмин, кальципарин) и антиагрегантов (ТромбоАсс, кардиомагнил, аспирин, плавикс)
- возраст пациента старше 50 лет (для определения необходимости применения антиагрегантов)
- оценка функции печени
- обследование перед операцией
- обследование перед программой ЭКО
- обследование перед планируемой беременностью
- обследование во время беременности
- обследование для постановки дифференциального диагноза тромбофилии, геморрагии, гемофилий, АФС
При исследовании системы гемостаза важно оценить работу всех компонентов.
Гемостаз осуществляется тремя взаимодействующими между собой функционально-структурными компонентами:
- Сосудистым (эндотелий сосудистой стенки)
- Клеточным (клетки крови)
- Плазменным (факторы свертывания, антикоагулянты, участники фибринолиза)
В нашей лаборатории мы исследуем каждый этап.
Давайте разберемся — какие исследования характеризуют тот или иной этап гемостаза.
Сосудисто-тромбоцитарный гемостаз:
- Количество тромбоцитов (в составе общего анализа крови или как отдельное исследование), дополнительно рассчитываются тромбоцитарные индексы — средний размер тромбоциты, тромбокрит, анизоцитоз тромбоцитов.
- Определение времени, за которое свертывается кровь при проколе пальца руки.
- Определение функциональной активности тромбоцитов по их способности к агрегации (слипанию). В процессе исследования важно оценить — как тромбоциты агрегируют при воздействии на них различных веществ, так называемых индукторов агрегации (синонимы «активатор», «стимулятор») и без добавления индукторов — спонтанная агрегация.
В случае спонтанной агрегации активизация тромбоцитов происходит за счет турбулентности потока крови (имитация процесса in vivo, т. е. «в организме»).
Также проводится оценка агрегации тромбоцитов под воздействием различных индукторов в разных концентрациях: агрегация с АДФ, коллагеном, ристомицином, арахидоновой кислотой, УИА (универсальным индуктором агрегации).
В нашей лаборатории проводится комплексная агрегатограмма, в которую входит спонтанная агрегация и агрегация с АДФ в трех концентрациях. Такое исследование позволяет более точно оценить функции тромбоцитов. Результат комплексной агрегатограммы выдается с распечаткой графиков и с заключением.
Для исследования агрегации мы используем агрегометр «Биола», который является уникальным прибором, сочетающим общепризнанный метод определения агрегации по Борну (турбидиметрический) и метод ФСП (с оценкой среднего размера агрегатов). Преимущество этого метода в том, что он позволяет оценить агрегацию с низкими физиологическими дозами индуктора, приближая лабораторный анализ, к процессам, протекающим в организме.
Исследование вторичного или плазменного гемостаза:
Свертывание крови протекает по двум путям — внешнему и внутреннему.
- Внешний путь активируется при повреждении кровеносного сосуда извне (например, при порезе) и его можно оценить при проведении протромбинового теста, включающего в себя активность по Квику, протромбиновый индекс и МНО. МНО (международное нормализованное отношение) — это стандартизованный показатель, используемый для контроля применения непрямых антикоагулянтов.
- Внутренний путь активируется при повреждении эндотелия (внутренней выстилки) сосудистой стенки и оценивается тестом АЧТВ (активированное частичное (парциальное) тромбопластиновое время).
- Конечный этап свертывания оценивают два теста — фибриноген и тромбиновое время, позволяя оценить количественные и качественные характеристики этого периода свертывания.
- Активизация свертывающей системы и образование тромбов могут происходить не только при повреждении сосуда, но и при воздействии многих веществ, находящихся в кровотоке.
Насколько активизирована эта система, можно оценить по результатам теста — РФМК (растворимые фибрин-мономерные комплексы — продукты деградации фибриногена). Повышение активности свертывающей системы может привести к повышенному тромбообразованию.
Образовавшиеся тромбы необходимо постепенно лизировать (разрушить), после того как они выполнят свою «функцию» и целостность поврежденного сосуда восстановиться. В дело вступает фибринолитическая система.
Ее «работоспособность» можно оценить при проведении теста: плазминоген, D-димер. Определяя активность плазминогена можно косвенно оценить «работу» плазмина — фермента «разрезающего» фибриновый сгусток. По концентрации D-димера (продукта деградации фибрина) можно сделать вывод, о том насколько активно идёт процесс расщепления образовавшихся сгустков.
- Для того, чтобы наша кровь поддерживалась в жидком состоянии, в плазме крови циркулируют т.н. физиологические (естественные) антикоагулянты. К ним относятся — антитромбин III, протеин С и его кофактор протеин S. Недостаток этих компонентов приводит к тромбозу.
- В некоторых случаях (например, для дифференциальной диагностики гемофилии, А и В, болезни (или синдрома) Виллебранда) необходимо дополнительные исследования для определения активности отдельных факторов: фактора VIII, фактора IX, фактора Виллебранда.
Говоря о патологии системы гемостаза и клинических состояниях, с ней связанных нельзя обойти тему диагностики антифосфолипидного синдрома (АФС), т.к. это один из видов тромбофилий, связанный с аутоиммунными процессами.
Основными маркерами АФС является наличие антител к кардиолипину и волчаночного антикоагулянта в крови (т.н. люпус-тест). Наличие антител к фосфолипидам в акушерской практике может быть причиной антенатальной гибели плода и невынашивания беременности. Повышенные титры антител были обнаружены при некоторых неврологических заболеваниях.
В последнее время наблюдаются ситуации, при которых оба вышеназванных теста могут оставаться отрицательными при наличии клинических проявлений АФС. Для диагностики таких состояний все чаще применяется определение антител к другим фосфолипидам (фосфатидилинозитолу, фосфатидилсерину), а также антител к бета-2 гликопротеину-1, аннексину V и протромбину.
Причиной повышенной свертываемости крови может быть и гипергомоцистеинемия — повышенное содержание гомоцистеина в крови.
Гомоцистеин является продуктом метаболизма метионина — одной из 8 незаменимых аминокислот организма. В норме он не накапливается. Обладает выраженным токсическим действием на клетку. Циркулируя в крови, повреждает сосуды, тем самым повышая свертываемость крови, способствует образованию микротромбов в сосудах (одна из причин невынашивания беременности, инсультов). Поэтому данное исследование показано лицам с сердечно-сосудистыми заболеваниями, женщинам с привычным невынашиванием, с замершими беременностями в анамнезе и бесплодием.
Все перечисленные выше исследования системы гемостаза можно пройти в Диагностической лаборатории ЗАО «Медицинская компания ИДК».
Подготовка к сдаче анализов: Кровь сдается натощак в утренние часы.
Для сдачи анализа «агрегация тромбоцитов» необходима особенная подготовка:
Кровь сдается натощак, допускается прием некрепкого чая и сухих хлебобулочных изделий.
Перед исследованием нельзя употреблять кофе, алкоголь (в течение суток), есть чеснок, курить, необходимо исключить любую физическую нагрузку. Также нельзя проводить исследование на фоне острого воспаления.
Следующие исследования сдаются в определенные дни по записи в процедурных кабинетах Медицинской компании ИДК на ул. Энтузиастов 29: фактор VIII, фактор IX, фактор Виллебранда, агрегация тромбоцитов, Протеин С и протеин S.
Запись на исследования по тел 8 800 250 24 24, (846) 927- 99- 91.
Профилактика COVID-19-ассоциированного нарушения гемостаза у пациента со стентированными коронарными артериями. Клинический случай | Самородов
Введение
Впервые о ведущей роли нарушений в системе гемостаза при COVID-19 сообщили G. Landoni и соавт., предположив, что у пациентов в основе острого повреждения легких лежит воспалительная реакция («цитокиновый шторм») и микрососудистый тромбоз. И даже предложили термин MicroCLOTS (microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome) в качестве нового названия для COVID-19 [1]. Далее было показано, что развитие тромбовоспалительного синдрома возможно не только в эндотелии легких, но идет и повреждение сердца, почек, кишечника и других жизненно важных органов, что и приводит к полиорганной недостаточности, способствуя развитию летального исхода [2-4]. Эффективным средством в профилактике органных дисфункций в таких условиях является прием антикоагулянтов [5]. Лечение и профилактика инфекции, вызванной SARS-CoV-2, на территории Российской Федерации должно проводиться в соответствии с Временными методическими рекомендациями Минздрава России, которые находятся в общемировом тренде по вопросам профилактики и лечения COVID-19 и регулярно пересматриваются в связи с новыми данными об эффективности различных препаратов, в том числе и антикоагулянтов. В данной статье мы рассмотрим клинический случай эффективного лечения пациента с COVID-19 после вмешательства на коронарных артериях через призму Временных методических рекомендаций разных версий и результатов международных клинических исследований в отношении антикоагулянтной терапии.
Материалы и методы
Клинический случай. Пациент С., 67 лет, 03.04.2020 поступил в ГБУЗ РКБ им Г. Г. Куватова на плановую диагностическую процедуру (контрольная коронарография) с диагнозом: Ишемическая болезнь сердца. Атеросклероз коронарных артерий IV стадии, 3-й степени. Стеноз просвета левой коронарной артерии до 80 %. Транслюминальная баллонная ангиопластика со стентированием левой коронарной артерии в апреле 2017 года. Фибрилляция предсердий нормосистолическая форма. Гипертоническая болезнь III, ст. 3, риск 4. Анамнез заболевания: болеет более 3-х лет, после стентирования коронарных артерий по месту жительства не наблюдался у специалистов, с 2018 года никакого лечения не получал.
Данные инструментальных и лабораторных методов исследования:
ЭКГ: фибрилляция предсердий с ЧСС 79 в минуту. Трансторакальная эхокардиоскопия: уплотнение стенок аорты. Сократительная функция миокарда сохранена. Диастолическая дисфункция ЛЖ по 1-му типу. Незначительная эксцентрическая гипертрофия миокарда ЛЖ. ФВ — 60 %.
На вторые сутки пребывания (04.04.2020) в стационаре отмечается ухудшение состояния в виде развития одышки, беспокойства, появились боли за грудиной, перевод в реанимационное отделение с подозрением на острый коронарный синдром. С целью дифференциальной диагностики проведено повторное ЭКГ (фибрилляция предсердий), компьютерная томография органов грудной клетки, маркеры повреждения миокарда и тромбоэмболии легочной артерии, превентивно УДС вен нижних конечностей.
Объективно: состояние средней степени тяжести. Сознание — ясное. Кожные покровы и видимые слизистые без особенностей, лимфатические узлы при пальпации не увеличены. Дыхание спонтанное, ДН-II, ЧД 22-24 в мин, SpO2 = 95 %. Гемодинамика стабильная. АД = 110/60 мм рт. ст. Пульс 80 уд/мин, аритмичный. Живот мягкий, при пальпации безболезненный. Физиологические отправления не нарушены. Т = 37,5 °C. Компьютерная томография: форма грудной клетки обычная. Плевра не изменена, признаков скопления жидкости в плевральной полости не отмечается. Легочные поля симметричные, воздушные. С обеих сторон, субплеврально, по всем полям множество участков по типу матового стекла, неправильной формы, с зонами ретикулярной структуры и консолидации. Средостение не смещено и не расширено. Сердце расположено обычно и имеет правильную конфигурацию. Лимфатические узлы паравазальной, паратрахеальной, бифуркационной и бронхиальной групп не увеличены. Диафрагма расположена обычно, контуры ее четкие и ровные. Заключение: Двусторонняя вирусная пневмония (объем поражения легких — КТ-2) (видео 1).
Видео 1. Компьютерная томография на момент поступления
Video 1. Computed tomography at the time of admission
УДС вен нижних конечностей: магистральной патологии вен нижних конечностей не выявлено.
ОАК: гемоглобин — 110 г/л, эритроциты — 3,1х109/л, Ht — 43 %, лейкоциты — 5,0х109/л, тромбоциты — 132х109/л.
Б/х: общий белок — 63 г/л, альбумин — 35 г/л, креатинин — 75 ммоль/л, мочевина — 5,9 ммоль/л, К — 4,1 ммоль/л, Na — 135 ммоль/л, глюкоза — 3,3 ммоль/л, холестерин — 5,5 ммоль/л, билирубин — 11,5 мкмоль/л, АЛТ — 25 Ед/л, АСТ — 35 Ед/л, СРБ сыворотки крови — 6 мг/л, тропонин I — отр, КФК МВ — 17 Ед/л. Коагулограмма: АПТВ — 27 с, ПВ — 20 с, фибриноген — 2,9 г/л, D-димеры — 570 нг/мл. Тромбоэластография: R — 5,8 мин, K — 1,4 мин, Angle — 74,0 град, МА — 83,4 мм, G — 25,2 К, CI — 5,6 (рис. 1).
Выставлен конкурирующий диагноз:
Двусторонняя вирусная полисегментарная пневмония. Не исключается новая коронавирусная инфекция. ДН II ст.
Несмотря на отягощенный кардиологический анамнез, от коронарографии решено воздержаться. Взят мазок из зева и носа на SARS-CoV-2, начато лечение согласно Временным методическим рекомендациям «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 4 (27.03.2020)»:
- Положение в прон-позиции на самостоятельном дыхании.
- Хлорохин 500 мг 2 раза в сутки в течение 7 дней (начат с пятых суток).
- Инфузия нитратов (в начальной дозе 5 мкг/мин, с титрованием до снижения систолического артериального давления на 10 %).
- Антикоагулянтная терапия — парнапарин натрия (Флюксум®, Alfasigma, Italy), раствор для подкожного введения 6400 анти-XaМЕ — 2 р/сут).
- Принимая во внимание высокий тромбогенный потенциал по данным тромбоэластографии, имеющийся стент коронарной артерии и высокий процент стеноза нестентированной коронарной артерии, начата дуальная антиагрегационная терапия (аспирин 100 мг 1 раз/сут + клопидогрель, однократный прием нагрузочной дозы 300 мг, а затем 75 мг 1 раз/сут).
Результаты оценки состояния пациента на 08.04.2020. Объективно: состояние удовлетворительное. Сознание — ясное. Жалоб активно не предъявляет. Кожные покровы и видимые слизистые без особенностей, лимфатические узлы при пальпации не увеличены. Дыхание спонтанное, ДН-0, ЧД — 16-18 в мин, SpO2 = 98 %. Гемодинамика стабильная. АД = 124/75 мм рт. ст. Пульс 67 уд./мин, аритмичный. Живот мягкий, при пальпации безболезненный. Физиологические отправления не нарушены. Т = 36,6 °C.
Рисунок 1. Исходные показатели тромбоэластографии пациента до начала лечения
Figure 1. Initial thromboelastography before treatment
Рисунок 2. Показатели тромбоэластографии пациента на фоне проводимой терапии
Figure 2. Thromboelastography with background therapy
Заключение компьютерной томографии: положительная динамика в стадии разрешения (уменьшение протяженности инфильтративных изменений, формирование участков локального пневмофиброза) (видео 2).
Видео 2. Компьютерная томография на 4 сутки пребывания в стационаре
Video 2. Computed tomography on the 4th day of hospital stay
ОАК: гемоглобин — 116 г/л, эритроциты — 3,2×10 9/л, Ht — 39 %, лейкоциты — 6,3×10 9/л, тромбоциты — 134×10 9/л.
Б/х: общий белок — 67 г/л, альбумин — 38 г/л, креатинин — 47 ммоль/л, мочевина — 5,2 ммоль/л, К — 4,5 ммоль/л, Na — 137 ммоль/л, глюкоза — 3,6 ммоль/л, холестерин — 5,5 ммоль/л, билирубин — 11,4 мкмоль/л, АЛТ — 26 Ед/л, АСТ — 31 Ед/л, СРБ сыворотки крови — 3 мг/л, тропонин I — отр, КФК МВ — 19 Ед/л. Коагулограмма: АПТВ — 24 с, ПВ — 17 с, фибриноген — 3,0 г/л, D-димеры — 500 нг/мл. Тромбоэластография: R — 11,7 мин, Angle — 10,5 град, МА — 16,7 мм, G — 1,0 К, CI — 3,1 (рис. 2).
На фоне проводимых лечебных мероприятий состояние пациента улучшилось. Перевод в терапевтическое (инфекционное) отделение на 5-е сутки в связи с положительной динамикой и лабораторным подтверждением SARS-CoV-2, плановая коронарография и выписка из стационара на 14-е сутки.
Результаты и обсуждение
На сегодняшний день уже общепризнанным является тот факт, что коагулопатия при коронавирусной инфекции связана с высокой смертностью и более частым развитием тромбозов. Установлено, что микротромбы в альвеолярных капиллярах определялись в 9 раз чаще у пациентов с COVID-19, чем у пациентов, умерших от гриппа [6]. Риск тромбоэмболии легочной артерии (ТЭЛА) выше у пациентов с ОРДС, связанных с COVID-19, чем у пациентов с острым респираторным дистресс-синдромом (ОРДС) других причин (6 % vs 18 %, OR 3,4 [1,7-7,3], p < 0,001) [7]. Согласно данным когортного исследования Saskia Middeldorp и др., у 20 % пациентов диагностируется венозный тромбоз, несмотря на рутинную профилактику тромбозов, из которых лишь 13 % с явной симптоматикой. Совокупные случаи ВТЭ на 7, 14 и 21-е сутки составляли 16 % (95 % ДИ, 10-22), 33 % (95 % ДИ, 23-43) и 42 % (95 % ДИ 30-54) соответственно. Кумулятивная доля венозных тромбозов была выше в отделении интенсивной терапии (26 % (95 % ДИ, 17-37), 47 % (95 % ДИ, 34-58) и 59 % (95 % ДИ, 42-72) на 7, 14 и 21-е сутки), чем в профильных/инфекционных отделениях (5,8 % (95 % ДИ, 1,4-15,0), 9,2 % (95 % ДИ, 2,6-21,0) и 9,2 % (2,6-21,0) на 7, 14 и 21-е сутки) [8]. Эти данные согласуются с результатами другого проспективного когортного исследования Dominic Wichmann и др., где показано, что массивная ТЭЛА была причиной смерти у 33 % пациентов с COVID-19 на фоне тромбоза глубоких вен, а двусторонний тромбоз глубоких вен был найден по результатам аутопсии у 25 % пациентов без признаков ТЭЛА [9].
Обращаясь к нашему клиническому случаю и клиническим рекомендациям Международного общества по тромбозу и гемостазу (ISTH), можно отметить, что госпитализированные пациенты с COVID-19 характеризуются стандартными предрасполагающими внутренними и внешними факторами риска развития венозного тромбоза и тромбоэмболических осложнений: пожилой возраст, ожирение, вынужденная иммобилизация, онкология, пребывание в отделении интенсивной терапии, поражение коронарных сосудов, предшествующие эпизоды венозных тромбозов или известная тромбофилия [10, 11]. То есть наш пациент имел 3 фактора из 7 возможных и характеризовался 40 % вероятностью развития фатального тромбоэмболического события.
Основным маркером коагулопатии, ассоциированной с CОVID-19, является высокий уровень D-димеров. У пациентов с высоким уровнем D-димеров было обнаружено снижение летальности на фоне приема гепарина приблизительно на 20 % (32,8 % vs 52,4 %, р = 0,017) [12, 13]. Имеются отдельные сообщения, которые объясняют положительные эффекты приема гепарина на фоне COVID-19 преимущественно его неантикоагуляционными свойствами — связыванием тромбина, противовоспалительной активностью, ингибированием хемотаксиса нейтрофилов и миграции лейкоцитов, нейтрализацией положительно заряженного пептидного фактора комплемента C5a и др. [14-17]. Однако для таких выводов недостаточно клинических данных с одной стороны, с другой стороны — имеется высокая эффективность низкомолекулярных гепаринов (НМГ), которые обладают преимущественно антикоагуляционной активностью. В этой связи достаточно интересным представляется эволюция Временных методических рекомендаций Минздрава России в отношении антикоагулянтной терапии от отсутствия упоминания в ранних версиях и перечня конкретных НМГ до «… назначение НМГ как минимум в профилактических дозах, показано ВСЕМ госпитализированным пациентам и должно продолжаться как минимум до выписки. Нет доказанных преимуществ какого-либо одного НМГ по сравнению с другими…» в последней, 7-й версии, что кажется нам очень важным моментом.
В нашем клиническом случае терапия пациента проходила согласно Временным методическим рекомендациям Минздрава России 4-й версии, а лечение пациента проводилось в переформированном под инфекционный госпиталь хирургическом стационаре и хирургической реанимации (т. е. в условиях ограниченных ресурсов в плане специфической терапии), что приводило к приему этиотропной терапии с задержкой. В качестве стандартного средства профилактики ТГВ/ТЭЛА применялся парнапарин натрия — препарат из перечня ЖНВЛП с управляемой и безопасной гипокоагуляцией [18]. Однако версии 5-х и 6-х Временных методических рекомендаций, действовавших в период с 8.04 по 3.06.2020, делали бы невозможным применение данного препарата. Справедливости ради отметим, что и схема этиотропной терапии COVID-19 хлоронином признана неэффективной и отсутствует в 7-й версии рекомендаций Минздрава.
Также следует отметить отсутствие в национальных и международных клинических рекомендациях диагностических инструментов point of test care — глобальных тестов гемостаза (тромбоэластографии и тромбоэластометрии) [19]. Анализ нашего клинического случая позволяет продемонстрировать достаточную точность тромбоэластографии по оценке гиперкоагуляционного потенциала крови пациента в отличие от нормальных значений клоттинговых тестов, проводить оценку динамики коагулопатии при COVID-19 на фоне проводимых терапевтических мероприятий, что имеет первостепенное значение в условиях совместного применения антиагрегантов и антикоагулянтов. То есть в сложных условиях нецелесообразно ориентироваться только на временные рекомендации, которые могут не успевать за меняющимися подходами в терапии. В новых условиях возрастает ответственность врача, который должен применять системный подход к назначению терапии, включая анализ литературных данных и собственный клинический опыт.
Заключение
Таким образом продемонстрирована необходимость совместного назначения антикоагулянтов и антиагрегантов пациентам с высокими факторами риска тромбоза на фоне COVID-19 при наличии показаний. В условиях трудной дифференциальной диагностики, выбора тактики ведения пациента, осуществления мониторинга антикоагуляционной и/или антиагрегационной терапии необходимо опираться не только на имеющиеся национальные рекомендации, но и на результаты последних метаанализов и международных клинических рекомендаций.
Информированное согласие. Информированное согласие пациента на публикацию своих данных получено.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Информация о спонсорстве. Данная работа не финансировалась.
1. Ciceri F., Beretta L., Scandroglio A.M., Colombo S., Landoni G., Ruggeri A., et al. Microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome (MicroCLOTS): an atypical acute respiratory distress syndrome working hypothesis. Crit Care Resusc. 2020 Apr 15. Online ahead of print. PMID: 32294809
2. Nardelli P., Landoni G. COVID-19-Related Th romboinflammatory Status: MicroCLOTS and Beyond. General Reanimatology. 2020. Online ahead of print. DOI: 10.15360/1813-9779-2020-3-0-2
3. Th achil J., Srivastava A. SARS-2 Coronavirus-Associated Hemostatic Lung Abnormality in COVID-19: Is It Pulmonary Th rombosis or Pulmonary Embolism? Semin Th romb Hemost. 2020 May 12. Online ahead of print. DOI: 10.1055/s-0040-1712155
4. Bo Diao, Chenhui Wang, Rongshuai Wang, Zeqing Feng, Yingjun Tan, Huiming Wang, et al. Human kidney is a target for novel severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection. MedRxiv. 2020.03.04.20031120. DOI: 10.1101/2020.03.04.20031120
5. Savioli F. Is there a rationale for heparin use among severe COVID-19 patients? Einstein (Sao Paulo). 2020;18:eED5758. DOI: 10.31744/einstein_journal/2020ed5758
6. Ackermann M., Verleden S.E., Kuehnel M., Haverich A., Welte T., Laenger F., et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020 May 21. Online ahead of print. DOI: 10.1056/NEJMoa2015432
7. Helms J., Tacquard C., Severac F., Leonard-Lorant I., Ohana M., Delabranche X., et al. High risk of thrombosis in patients with severe SARS- CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46(6):1089–98. DOI: 10.1007/s00134-020-06062-x
8. Middeldorp S., Coppens M., van Haaps T.F., Foppen M., Vlaar A.P., Müller M.C.A., et al. Incidence of venous thromboembolism in hospitalized patients with COVID-19. J Th romb Haemost. 2020 May 5. Online ahead of print. DOI: 10.1111/jth.14888
9. Wichmann D., Sperhake J.P., Lütgehetmann M., Steurer S., Edler C., Heinemann A., et al. Autopsy fi ndings and venous thromboembolism in patients with COVID-19. Ann Intern Med. Ann Intern Med. 2020 May 6: M20-2003. DOI: 10.7326/M20-2003
10. Driggin E., Madhavan M.V., Bikdeli B., Chuich T., Laracy J., Bondi- Zoccai G., et al. Cardiovascular considerations for patients, health care workers, and health systems during the coronavirus disease 2019 (COVID-19) pandemic. J Am Coll Cardiol. 2020;75(18):2352–71. DOI: 10.1016/j.jacc.2020.03.031
11. Spyropoulos A.C., Raskob G.E. New paradigms in venous thromboprophylaxis of medically ill patients. Th romb Haemost. 2017;117(9):1662–70. DOI: 10.1160/Th27-03-0168
12. Tang N., Bai H., Chen X., Gong J., Li D., Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020;18(5):1094–9. DOI: 10.1111/jth.14817
13. Iba T., Nisio M.D., Levy J.H., Kitamura N., Th achil J. New criteria for sepsis-induced coagulopathy (SIC) following the revised sepsis defi nition: a retrospective analysis of a nationwide survey. BMJ Open. 2017;7(9):e017046. DOI: 10.1136/bmjopen-2017-017046
14. Young E. The anti‐inflammatory eff ects of heparin and related compounds. Thromb Res. 2008;122(6):743–52. DOI: 10.1016/j.thromres.2006.10.026
15. Li J.P., Vlodavsky I. Heparin, heparan sulfate and heparanase in infl ammatory reactions. Thromb Haemost. 2009;102(5):823–8. DOI: 10.1160/TH09-02-0091
16. Esmon C.T. Targeting factor Xa and thrombin: impact on coagulation and beyond. Thromb Haemost. 2014;111(4):625–33. DOI: 10.1160/Th23-09-0730
17. Poterucha T.J., Libby P., Goldhaber S.Z. More than an anticoagulant: Do heparins have direct anti‐infl ammatory eff ects? Th romb Haemost. 2017;117(3):437–44. DOI: 10.1160/Th26-08-0620
18. Морозов К.М., Колбин А.С., Галанкин Т.Л. Сетевой метаанализ эффективности применения парнапарина для профилактики венозных тромбоэмболических осложнений при хирургических вмешательствах. Тромбоз, гемостаз и реология. 2018;(1):31–9. DOI: 10.25555/THR.2018.1.0821
19. Govil D., Pal D. Point-of-care Testing of Coagulation in Intensive Care Unit: Role of Th romboelastography. Indian J Crit Care Med. 2019;23(Suppl 3):S202–6. DOI: 10.5005/jp-journals-10071-23253
Дифференциальный диагноз тромбофилии — wikidoc
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1]; Заместитель главного редактора: М. Хуррам Афзал, доктор медицины [2], Соганд Гударзи, доктор медицины [3], Асири Эдиривикрема, доктор медицины, M.H.S. [4], Джаспиндер Каур, MBBS [5]
Обзор
Тромбофилии необходимо дифференцировать от других заболеваний, которые вызывают следующие клинические проявления: семейный анамнез тромбоза, особенно в раннем возрасте (<45 лет), неспровоцированный тромбоз в раннем возрасте (<40-55 для венозного тромбоза и <50-55 лет). для артериального тромбоза), рецидивирующий тромбоз, включая тромбоз глубоких вен, тромбоэмболию легочной артерии или тромбоз поверхностных вен.
Дифференциальная диагностика
Тромбофилии необходимо дифференцировать от других заболеваний, которые вызывают следующие клинические проявления: [1] [2]
Таблица 1: Дифференциация различных тромбофилий на основе симптомов, физического осмотра и лабораторных данных
Список литературы
- ↑ Cohoon KP, Heit JA (2014). «Наследственная и вторичная тромбофилия». Тираж . 129 (2): 254–7.DOI: 10.1161 / CIRCULATIONAHA.113.001943. PMC 3979345. PMID 24421360.
- ↑ Селигсон У., Любецкий А (2001). «Генетическая предрасположенность к венозному тромбозу». N Engl J Med . 344 (16): 1222–31. DOI: 10.1056 / NEJM200104193441607. PMID 11309638.
- ↑ Патнаик М.М., Молл С. (ноябрь 2008 г.). «Унаследованный дефицит антитромбина: обзор». Гемофилия . 14 (6): 1229–39. DOI: 10.1111 / j.1365-2516.2008.01830.x. PMID 163.
- ↑ Аль-Хадиди, Самер; Ву, Кристи; Абурахма, Ахмед; Аламарат, Заин (2017). «Семья со сгустками: дефицит антитромбина». Отчеты о делах BMJ : bcr-2017–221556. DOI: 10.1136 / bcr-2017-221556. ISSN 1757-790X.
- ↑ Konecny F (январь 2009 г.). «Унаследованные тромбофильные состояния и тромбоэмболия легочной артерии». J Res Med Sci . 14 (1): 43–56. PMC 3129068. PMID 21772860.
- ↑ Mannucci PM, Asselta R, Duga S, Guella I, Spreafico M, Lotta L, Merlini PA, Peyvandi F, Kathiresan S, Ardissino D (октябрь 2010 г.).«Связь фактора V Лейдена с инфарктом миокарда повторяется у 1880 пациентов с преждевременным заболеванием». J. Thromb. Haemost . 8 (10): 2116–21. DOI: 10.1111 / j.1538-7836.2010.03982.x. PMID 20626623.
- ↑ Campello E, Spiezia L, Simioni P (декабрь 2016 г.). «Диагностика и лечение фактора V Лейден». Эксперт Рев Гематол . 9 (12): 1139–1149. DOI: 10.1080 / 17474086.2016.1249364. PMID 27797270.
- ↑ Ван Роден CJ, Розендал FR, Майндерс AE, Ван Остайен JA, Ван Дер Меер FJ, Huisman MV (февраль 2004 г.).«Вклад лейденской мутации фактора V и протромбина G20210A в риск тромбоза, связанного с центральным венозным катетером». Гематология . 89 (2): 201–6. PMID 15003896.
- ↑ Dentali F, Pomero F, Borretta V, Gianni M, Squizzato A, Fenoglio L; и другие. (2013). «Расположение венозного тромбоза у пациентов с мутациями FVL или протромбина G20210A: систематический обзор и метаанализ». Тромб Гемост . 110 (1): 191–4.DOI: 10.1160 / Th23-02-0163. PMID 23615845.
- ↑ Press RD, Bauer KA, Kujovich JL, Heit JA (ноябрь 2002 г.). «Клиническая полезность тестирования фактора V leiden (R506Q) для диагностики и лечения тромбоэмболических расстройств». Arch. Патол. Лаборатория. Мед . 126 (11): 1304–18. DOI: 10.1043 / 0003-9985 (2002) 126 <1304: CUOFVL> 2.0.CO; 2. PMID 12421138.
- ↑ Бернард Хор и Элизабет М. Ван Котт (2010). «Лабораторные тесты на дефицит протеина С». Американский гематологический журнал . 85 (6): 440–442. DOI: 10.1002 / ajh.21679. PMID 20309856.
- ↑ Pescatore SL (март 2001 г.). «Клиническое лечение дефицита протеина С». Экспертное мнение Фармаколог . 2 (3): 431–9. DOI: 10.1517 / 14656566.2.3.431. PMID 11336597.
- ↑ 13,0 13,1 Густаво А. Родригес-Леаль, Сегундо Моран, Роберто Корона-Седильо и Росио Бром-Валладарес (2014).«Тромбоз воротной вены с дефицитом протеина C-S у пациента без цирроза печени». Всемирный гепатологический журнал . 6 (7): 532–537. DOI: 10.4254 / wjh.v6.i7.532. PMID 25068006.
- ↑ Кристи Дж. Смок, Элизабет А. Пламхофф, Пит Мейер, Пейхонг Сюй, Николь Д. Зантек, Нахла М. Хейкал и Элизабет М. Ван Котт (2016). «Тестирование протеина S у пациентов с дефицитом протеина S, лейденского фактора V и ривароксабана, проведенное Североамериканскими специализированными лабораториями коагуляции». Тромбоз и гемостаз . 116 (1): 50–57. DOI: 10.1160 / Th25-12-0918. PMID 27075008.
- ↑ Джи М., Юн С.Н., Ли В., Чан С., Пак С.Х., Ким Д.Й., Чун С., Мин В.К. (октябрь 2011 г.). «Дефицит белка S с мутацией гена PROS1 у пациента с тромбозом мезентериальных вен после тотальной колэктомии». Свертыш крови. Фибринолиз . 22 (7): 619–21. DOI: 10.1097 / MBC.0b013e32834a0421. PMID 21799399.
- ↑ Cooper PC, Rezende SM (2007).«Обзор методов обнаружения лейденского фактора V и мутаций протромбина G20210A». Инт Дж. Лаборатория Гематол . 29 (3): 153–62. DOI: 10.1111 / j.1751-553X.2007.00892.x. PMID 17474891.
- ↑ McGlennen RC, Key NS (2002). «Клиническое и лабораторное лечение мутации протромбина G20210A». Арч Патол Лаб Мед . 126 (11): 1319–25. DOI: 10.1043 / 0003-9985 (2002) 126 <1319: CALMOT> 2.0.CO; 2. PMID 12421139.
- ↑ Dentali F, Pomero F, Borretta V, Gianni M, Squizzato A, Fenoglio L; и другие.(2013). «Расположение венозного тромбоза у пациентов с мутациями FVL или протромбина G20210A: систематический обзор и метаанализ». Тромб Гемост . 110 (1): 191–4. DOI: 10.1160 / Th23-02-0163. PMID 23615845.
- ↑ Venugopal A (сентябрь 2014 г.). «Диссеминированное внутрисосудистое свертывание». Индийский Дж. Анаэст . 58 (5): 603–8. DOI: 10.4103 / 0019-5049.144666. PMC 4260307. PMID 25535423.
- ↑ Makruasi N (ноябрь 2015 г.).«Лечение распространенной внутрисосудистой коагуляции». J Med Assoc Thai . 98 Дополнение 10: S45–51. PMID 27276832.
- ↑ Цуй С, Фу З, Фэн И, Се Х, Ма Х, Лю Т; и другие. (2018). «Оценка диссеминированного внутрисосудистого свертывания крови является новым предиктором тромбоза воротной вены у пациентов с циррозом печени и гепатитом В.» Тромб Рес . 161 : 7–11. DOI: 10.1016 / j.thromres.2017.11.010. PMID 291.
- ↑ Лим W (2013). «Антифосфолипидный синдром». Hematology Am Soc Hematol Educ Program . 2013 : 675–80. DOI: 10.1182 / asheducation-2013.1.675. PMID 24319251.
- ↑ Pengo V, Tripodi A, Reber G, Rand JH, Ortel TL, Galli M, De Groot PG (октябрь 2009 г.). «Обновление рекомендаций по выявлению волчаночных антикоагулянтов. Подкомитет по волчаночным антикоагулянтам / антифосфолипидным антителам Комитета по науке и стандартизации Международного общества по тромбозам и гемостазу». J. Thromb. Haemost . 7 (10): 1737–40. DOI: 10.1111 / j.1538-7836.2009.03555.x. PMID 19624461.
- ↑ Лим W (2013). «Антифосфолипидный синдром». Hematology Am Soc Hematol Educ Program . 2013 : 675–80. DOI: 10.1182 / asheducation-2013.1.675. PMID 24319251.
- ↑ Гарсия Д., Эркан Д. (2018). «Диагностика и лечение антифосфолипидного синдрома». N Engl J Med . 378 (21): 2010–2021. DOI: 10.1056 / NEJMra1705454. PMID 297
.
- ↑ Kornacki J, Wirstlein P, Skrzypczak J (2012). «[Оценка допплерографии маточных артерий в первой половине беременности у женщин с тромбофилией]». Гинеколь Пол . 83 (12): 916–21. PMID 23488294.
Шаблон: WH Шаблон: WS
Наследственный и приобретенный дифференциальный диагноз гиперкоагуляции
Rosendaal FR. Венозный тромбоз: многокомпонентное заболевание. Ланцет . 1999 г. 3 апреля.353 (9159): 1167-73. [Медлайн].
Cha AE. Загадочное осложнение свертывания крови убивает пациентов с коронавирусом. Вашингтон Пост . 22 апреля 2020 г. Доступно по адресу https://www.washingtonpost.com/health/2020/04/22/coronavirus-blood-clots/.
Коэн Э. Врачи пытаются выяснить, почему они наблюдают «беспрецедентное» свертывание крови среди пациентов с Covid-19. CNN . 22 апреля 2020 г. Доступно по адресу https://www.cnn.com/2020/04/21/health/blood-clots-coronavirus/index.html.
Хан Х, Ян Л., Лю Р., Лю Ф., Ву К.Л., Ли Дж. И др. Выраженные изменения свертывания крови у пациентов с инфекцией SARS-CoV-2. Clin Chem Lab Med . 2020 16 марта. [Medline].
Оксли Т.Дж., Мокко Дж., Маджиди С. и др. Инсульт крупных сосудов как признак Covid-19 у молодых. N Engl J Med . 2020 28 апреля. [Medline]. [Полный текст].
Panigada M, Bottino N, Tagliabue P, Grasselli G, Novembrino C, Chantarangkul V, et al.Гиперкоагуляция пациентов с COVID-19 в отделении интенсивной терапии. Отчет о результатах тромбоэластографии и других параметрах гемостаза. J Тромб Haemost . 2020 17 апреля [Medline]. [Полный текст].
Spiezia L, Boscolo A, Poletto F, Cerruti L, Tiberio I, Campello E и др. Тяжелая гиперкоагуляция, связанная с COVID-19, у пациентов, поступивших в отделение интенсивной терапии по поводу острой дыхательной недостаточности. Тромб Гемост . 2020 21 апреля [Medline]. [Полный текст].
Коллиас А., Кириакулис К.Г., Димакакос Э., Поулаку Г., Стергиу Г.С., Сиригос К. Риск тромбоэмболии и антикоагулянтная терапия у пациентов с COVID-19: новые доказательства и призыв к действию. Br J Haematol . 2020 18 апреля. [Medline].
Асакура Х., Огава Х. Возможности комбинированной терапии гепарином и нафамостатом при COVID-19. J Тромб Haemost . 2020 17 апреля [Medline].
[Рекомендации] Тачил Дж., Танг Н., Гандо С., Фаланга А., Каттанео М., Леви М. и др.Временное руководство ISTH по распознаванию и лечению коагулопатии при COVID-19. J Тромб Haemost . 2020 май. 18 (5): 1023-1026. [Медлайн]. [Полный текст].
Zhang Y, Xiao M, Zhang S, et al. Коагулопатия и антифосфолипидные антитела у пациентов с Covid-19. N Engl J Med . 2020 апр 23.382 (17): e38. [Медлайн]. [Полный текст].
Brooks M. Полное отключение фибринолиза при тяжелой форме COVID-19. Медицинские новости Medscape.Доступно на https://www.medscape.com/viewarticle/931316. 28 мая 2020 г .; Дата обращения: 2 июня 2020 г.
Wright FL, Vogler TO, Moore EE, Moore HB, Wohlauer MV, Urban S, et al. Прекращение фибринолиза коррелирует с тромбоэмболическими событиями при тяжелой инфекции COVID-19. Дж. Ам Колл Сург . 2020 15 мая. [Medline]. [Полный текст].
Hillarp A, Dahlback B, Zoller B. Активированная устойчивость к протеину C: от фенотипа к генотипу и клинической практике. Кровь Ред. . 1995 Декабрь 9 (4): 201-12. [Медлайн].
Ву К.К., Тиагараджан П. Роль эндотелия в тромбозе и гемостазе. Анну Рев Мед . 1996. 47: 315-31. [Медлайн].
Колман-Брошу С. Тромбоз глубоких вен при беременности. MCN Am J Matern Детские медсестры . 2004 май-июнь. 29 (3): 186-92. [Медлайн].
[Рекомендации] Бейтс С.М., Грир И.А., Миддельдорп С., Винстра Д.Л., Прабулос А.М., Вандвик П.О.ВТЭ, тромбофилия, антитромботическая терапия и беременность: Антитромботическая терапия и профилактика тромбоза, 9-е изд: Руководства по клинической практике Американского колледжа грудных врачей, основанные на фактических данных. Сундук . 2012, февраль 141 (2 доп.): E691S-e736S. [Медлайн]. [Полный текст].
Rand JH, Wolgast LR. Антифосфолипидный синдром. В: Hoffman R, Benz EJ Jr, Silberstein LE, Heslop H, Weitz J, Anastasi J, ред. Гемостаз и тромбоз . 6-е изд. Филадельфия, Пенсильвания: Эльзевьер / Сондерс; 2013.2025-38.
Ortel TL. Тромбоз и антифосфолипидный синдром. Hematology Am Soc Hematol Educational Program . 2005. 462-8. [Медлайн]. [Полный текст].
Triplett DA. Антифосфолипидные антитела. Clin Adv Hematol Oncol . 2003 декабрь 1 (12): 726-30. [Медлайн].
Franchini M, Mannucci PM. Группа крови АВО и тромботическая болезнь сосудов. Тромб Гемост . 2014 декабрь 112 (6): 1103-9.[Медлайн].
Heit JA, Cunningham JM, Petterson TM, et al. Генетические вариации антикоагулянтного, прокоагулянтного, фибринолитического и врожденного иммунных путей как факторы риска венозной тромбоэмболии. J Тромб Haemost . 2011 июн.9 (6): 1133-42. [Медлайн]. [Полный текст].
Di Micco P, Scudiero O, Lombardo B, Lodigiani C. Идиопатическая гиперэозинофилия и венозная тромбоэмболия: есть ли патофизиологическая или клиническая связь? Описание интригующего клинического случая. Дж. Кровавая медицина . 2020. 11: 73-76. [Медлайн]. [Полный текст].
Eroglu A, Egin Y, Cam R, Akar N. Делеция 19 пар оснований дигидрофолатредуктазы (DHFR), метилентетрагидрофолатредуктазы (MTHFR) C677T, фактор V Лейден, полиморфизм протромбина G20210A у онкологических больных с тромбозом и без него. Энн Гематол . 2009 Январь 88 (1): 73-6. [Медлайн].
Клиника Мэйо. Активированная устойчивость к протеину C V (APCRV). Медицинские лаборатории Мэйо.Доступно на http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81967. Дата обращения: 22 марта 2020 г.
Heit JA. Тромбофилия: общие вопросы по лабораторной оценке и ведению. Hematology Am Soc Hematol Educational Program . 2007. 127-35. [Медлайн]. [Полный текст].
Couturaud F, Leroyer C, Julian JA и др. Факторы, предсказывающие риск тромбоза у родственников пациентов с неспровоцированной венозной тромбоэмболией. Сундук . 2009 10 июля. Epub опережает печать. [Медлайн].
Lijfering WM, Veeger NJ, Middeldorp S, et al. Более низкий риск рецидива венозного тромбоза у женщин по сравнению с мужчинами объясняется факторами риска, специфичными для пола во время первого венозного тромбоза в тромбофильных семьях. Кровь . 2009 сентябрь 3. 114 (10): 2031-6. [Медлайн]. [Полный текст].
Робертс Л.Н., Патель Р.К., Арья Р. Венозная тромбоэмболия и этническая принадлежность. Br J Haematol .2009 Август 146 (4): 369-83. [Медлайн].
Hong SN, Yun HC, Yoo JH, Lee SH. Связь между гиперкоагуляцией и тяжелым обструктивным апноэ во сне. JAMA Otolaryngol Head Neck Surg . 2017 г. 1. 143 (10): 996-1002. [Медлайн].
Кушман М. Факторы риска венозного тромбоза. Hematology Am Soc Hematol Educational Program . 2005. 452-7. [Медлайн]. [Полный текст].
Айах М., Эммеррих Дж.Генетика тромбофилии. Colman RW, Marder VJ, Clowes AW, et al, eds. Гемостаз и тромбоз . 5-е изд. Филадельфия, Пенсильвания: Липпинкотт, Уильямс и Уилкинс; 2006. 779-93.
Colucci G, Tsakiris DA. Скрининг на тромбофилию. Clin Appl Thromb Hemost . 2017 г. 1. 1076029616683803. [Medline].
Прути РК. Оптимальное использование тестирования на тромбофилию. Int J Lab Hematol . 2017 май. 39 Дополнение 1: 104-110.[Медлайн].
van Ommen CH, Nowak-Göttl U. Унаследованная тромбофилия при венозной тромбоэмболической болезни у детей: зачем и кого тестировать. Фронтальный педиатр . 2017. 5:50. [Медлайн]. [Полный текст].
Straczek C, Oger E, Yon de Jonage-Canonico MB, et al. Протромботические мутации, гормональная терапия и венозная тромбоэмболия у женщин в постменопаузе: влияние пути введения эстрогена. Тираж . 2005 29 ноя.112 (22): 3495-500. [Медлайн]. [Полный текст].
Urbanus RT, de Groot PG. Антифосфолипидные антитела — мы еще не закончили. Кровь Ред. . 2011 25 марта (2): 97-106. [Медлайн].
Бейтс С.М. Ведение беременных с тромбофилией или венозной тромбоэмболией в анамнезе. Hematology Am Soc Hematol Educational Program . 2007. 143-50. [Медлайн]. [Полный текст].
Коннорс Дж. Тестирование на тромбофилию и венозный тромбоз. N Engl J Med . 2017 7 декабря. 377 (23): 2298. [Медлайн]. [Полный текст].
Douketis J, Tosetto A, Marcucci M, et al. Риск рецидива венозной тромбоэмболии у мужчин и женщин: метаанализ на уровне пациента. BMJ . 2011 24 февраля. 342: d813. [Медлайн]. [Полный текст].
Кеарон С., Джулиан Дж. А., Ковач М. Дж. И др. Влияние тромбофилии на риск рецидива венозной тромбоэмболии при приеме варфарина: результаты рандомизированного исследования. Кровь . 2008 декабрь 1. 112 (12): 4432-6. [Медлайн]. [Полный текст].
Hirsh J, Raschke R. Гепарин и низкомолекулярный гепарин: Седьмая конференция ACCP по антитромботической и тромболитической терапии. Сундук . 2004 Сентябрь 126 (3 доп.): 188С-203С. [Медлайн]. [Полный текст].
Rühle F, Stoll M. Успехи в прогнозировании риска венозной тромбоэмболии у детей. Br J Haematol . 2017 декабрь 19, 82 (1): 25-6. [Медлайн].
Warkentin TE. Средства для лечения гепарин-индуцированной тромбоцитопении. Гематол Онкол Клин Норт Ам . 2010 24 августа (4): 755-75, ix. [Медлайн].
Адам С.С., Макдаффи-младший, Лахевич П.Ф., Ортель Т.Л., Уильямс Дж.В. Сравнительная эффективность новых пероральных антикоагулянтов и стандартных режимов антикоагулянтов для тромбопрофилактики у пациентов, перенесших тотальную замену тазобедренного или коленного сустава [Интернет]. Вирджиния Отчеты программы синтеза на основе фактов .2012 декабрь [Medline].
Perez A, Merli GJ. Использование новых антикоагулянтов при венозной тромбоэмболии: обновление 2013 г. Варианты лечения Curr Cardiovasc Med . 2013 6 февраля [Medline].
Dobesh PP, Oestreich JH. Новые антикоагулянты прямого действия для снижения риска ОКС. Дж. Фарм Практик . 2012 19 ноября [Medline].
Merli GJ. Новые пероральные антикоагулянты: вызов для больничных формуляров. Госпиталь (Миннеап) . 2012 Август 40 (3): 126-8. [Медлайн].
Komócsi A, Vorobcsuk A, Kehl D, Aradi D. Использование пероральных антикоагулянтов нового поколения у пациентов, получающих антитромбоцитарную терапию после острого коронарного синдрома: систематический обзор и метаанализ рандомизированных контролируемых исследований. Arch Intern Med . 2012 г., 12 ноября 172 (20): 1537-45. [Медлайн].
Kar S, Bhatt DL. Антикоагулянты для лечения острого коронарного синдрома в эпоху новых пероральных средств. Диск коронарной артерии . 2012 Сентябрь 23 (6): 380-90. [Медлайн].
Rajasekhar A, Beyth R, Crowther MA. Новые антикоагулянты у тяжелобольных. Клиника интенсивной терапии . 2012 июл.28 (3): 427-51, vii. [Медлайн].
Ли А.Ю. Лечение установленных тромботических событий у онкологических больных. Тромб Рес . 2012 апр. 129 Приложение 1: S146-53. [Медлайн].
Коэн А.Т., Гурвит М.М., Добромирски М.Тромбопрофилактика у онкологических больных без хирургического вмешательства. Тромб Рес . 2012 апр. 129 Приложение 1: S137-45. [Медлайн].
Vande Griend JP, Marcum ZA, Linnebur SA. Год в обзоре: новые лекарства для пожилых людей в 2011 году. Am J Geriatr Pharmacother . 2012 10 августа (4): 258-63. [Медлайн].
Burke DA, Warraich HJ, Pinto DS. Какой антитромбин для кого? Выявление группы пациентов, получающих наибольшую пользу от новых антитромбиновых препаратов. Curr Cardiol Rep . 2012 14 августа (4): 493-501. [Медлайн].
Di Nisio M, Middeldorp S, Büller HR. Прямые ингибиторы тромбина. N Engl J Med . 2005 сентябрь 8. 353 (10): 1028-40. [Медлайн].
Baglin T, Barrowcliffe TW, Cohen A, Greaves M. Рекомендации по использованию и мониторингу гепарина. Br J Haematol . 2006 апр. 133 (1): 19-34. [Медлайн]. [Полный текст].
Harenberg J. Необходим ли лабораторный мониторинг терапии низкомолекулярным гепарином? Да. J Тромб Haemost . 2004 г., 2 (4): 547-50. [Медлайн]. [Полный текст].
Bounameaux H, de Moerloose P. Необходим ли лабораторный мониторинг терапии низкомолекулярным гепарином? № J Thromb Haemost . 2004 г., 2 (4): 551-4. [Медлайн]. [Полный текст].
[Рекомендации] Кеарон С., Акл Э.А., Комерота А.Дж., Прандони П., Боунамо Х., Голдхабер С.З. и др. Антитромботическая терапия при ВТЭ: Антитромботическая терапия и профилактика тромбоза, 9-е изд: Руководства по клинической практике Американского колледжа грудных врачей. Сундук . 141 февраля 2012 г. (2 доп.): E419S-94S. [Медлайн]. [Полный текст].
[Рекомендации] Kitchen S, Grey E, Mackie I, Baglin T, Makris M, комитет BCSH. Измерение антикоагулянтов, не относящихся к кумарину, и их влияния на тесты гемостаза: руководство Британского комитета по стандартам в гематологии. Br J Haematol . 2014 Сентябрь 166 (6): 830-41. [Медлайн]. [Полный текст].
Cho L, Kottke-Marchant K, Lincoff AM, et al.Корреляция времени свертывания экарина в месте оказания медицинской помощи и времени активированного свертывания с концентрацией бивалирудина. Ам Дж. Кардиол . 2003 May 1. 91 (9): 1110-3. [Медлайн].
Welsby IJ, McDonnell E, El-Moalem H, Stafford-Smith M, Toffaletti JG. Системы активированного времени свертывания крови различаются по точности и смещению и не являются взаимозаменяемыми при соблюдении протоколов лечения гепарином во время искусственного кровообращения. Дж. Клин Монит Компьютер . 2002 июл.17 (5): 287-92.[Медлайн].
Chang LC, Lee HF, Yang Z, Yang VC. Протамин с низким молекулярным весом (LMWP) как нетоксичный гепарин / антидот низкомолекулярного гепарина (I): получение и характеристика. AAPS PharmSci . 2001. 3 (3): E17. [Медлайн].
Schick BP, Maslow D, Moshinski A, San Antonio JD. Новые конкатамерные гепарин-связывающие пептиды обращают активность гепарина и низкомолекулярного гепарина в антикоагулянтную активность в плазме пациентов in vitro и у крыс in vivo. Кровь . 2004 15 февраля. 103 (4): 1356-63. [Медлайн]. [Полный текст].
Welsby IJ, Stafford-Smith M. Мониторинг прямых ингибиторов тромбина: время для стандартизации. Анестезиология . 2004 Октябрь 101 (4): 1048-9. [Медлайн].
Weitz JI. Новые антикоагулянты для лечения венозной тромбоэмболии. Тираж . 2004 31 августа 110 (9 доп. 1): I19-26. [Медлайн]. [Полный текст].
Коннорс Дж.Антидот для антикоагулянтов фактора Ха. N Engl J Med . 2015 17 декабря. 373 (25): 2471-2. [Медлайн]. [Полный текст].
Lassen MR, Raskob GE, Gallus A, Pineo G, Chen D, Hornick P. Сравнение апиксабана с эноксапарином для тромбопрофилактики после замены коленного сустава (ADVANCE-2): рандомизированное двойное слепое исследование. Ланцет . 2010 марта 6. 375 (9717): 807-15. [Медлайн].
Romualdi E, Ageno W. Оральные ингибиторы Ха. Гематол Онкол Клин Норт Ам .2010 24 августа (4): 727-37, viii-ix. [Медлайн].
Medi C, Hankey GJ, Freedman SB. Риск инсульта и антитромботические стратегии при фибрилляции предсердий. Ход . 2010 ноябрь 41 (11): 2705-13. [Медлайн].
Becattini C, Lignani A, Agnelli G. Новые антикоагулянты для профилактики венозной тромбоэмболии. Наркотики . 2010. 4: 49-60. [Медлайн].
Desai SS, Massad MG, DiDomenico RJ, et al.Последние достижения в антитромботической терапии: останется ли варфарин натрия лекарством прошлого? Последние данные Pat Cardiovasc Drug Discov . 2006 ноябрь 1 (3): 307-16. [Медлайн].
Хэнли JP. Отмена варфарина. Дж. Клин Патол . 2004 ноябрь 57 (11): 1132-9. [Медлайн]. [Полный текст].
Кини М., Аллан Д.С., Ломанн Р.С., Йи И.Х. Влияние активированного рекомбинантного человеческого фактора 7 (ниастазы) на лабораторные испытания ингибиторов факторов VIII и IX. Лабораторный гематол . 2005. 11 (2): 118-23. [Медлайн].
Malherbe S, Tsui BC, Stobart K, Koller J. Argatroban в качестве антикоагулянта при искусственном кровообращении у младенца и попытка обращения с рекомбинантным активированным фактором VII. Анестезиология . 2004 Февраль 100 (2): 443-5. [Медлайн].
Powner DJ, Hartwell EA, Hoots WK. Противодействие воздействию антикоагулянтов и антиагрегантов при неотложных нейрохирургических вмешательствах. Нейрохирургия . 2005, ноябрь 57 (5): 823–31; обсуждение 823-31. [Медлайн].
Дифференциальный диагноз дефицита протеина C
Dahlback B. Успехи в понимании патогенетических механизмов тромбофилических расстройств. Кровь . 2008 г. 1. 112 (1): 19-27. [Медлайн]. [Полный текст].
Pepler L, Wu C, Dwivedi DJ, Wu C, Kim PY, Liaw PC. Влияние рецептора эндотелиального протеина C на образование тромбина и лизис сгустка. Тромб Рес . 2017 Апрель 152: 30–37. [Медлайн].
Clouse LH, Comp PC. Регуляция гемостаза: система протеина С. N Engl J Med . 1986 15 мая. 314 (20): 1298-304. [Медлайн].
Уокер FJ. Регулирование активированного протеина C новым протеином. Возможная функция бычьего белка S. J Biol Chem . 1980, 25 июня. 255 (12): 5521-4. [Медлайн]. [Полный текст].
Mosnier LO, Zlokovic BV, Griffin JH.Цитопротекторный путь протеина С. Кровь . 2007 15 апреля. 109 (8): 3161-72. [Медлайн]. [Полный текст].
Danese S, Vetrano S, Zhang L, Poplis VA, Castellino FJ. Путь протеина C при воспалении и повреждении тканей: патогенетическая роль и терапевтическое значение. Кровь . 2010 11 февраля. 115 (6): 1121-30. [Медлайн]. [Полный текст].
D’Ursi P, Marino F, Caprera A, Milanesi L, Faioni EM, Rovida E. ProCMD: база данных и трехмерный веб-ресурс для мутантов протеина C. BMC Bioinformatics . 2007 8 марта. 8 Приложение 1: S11. [Медлайн]. [Полный текст].
Bovill EG, Bauer KA, Dickerman JD, Callas P, West B. Клинический спектр гетерозиготной недостаточности протеина C у большой родословной из Новой Англии. Кровь . 1989 15 февраля. 73 (3): 712-7. [Медлайн]. [Полный текст].
Limperger V, Klostermeier UC, Kenet G, Holzhauer S, Alhenc Gelas M, Finckh U, et al. Клинические и лабораторные характеристики детей с венозной тромбоэмболией и дефицитом протеина C: наблюдательное израильско-немецкое когортное исследование. Br J Haematol . 2014 ноябрь 167 (3): 385-93. [Медлайн].
Horellou MH, Conard J, Bertina RM, Samama M. Врожденный дефицит протеина C и тромботическая болезнь в девяти французских семьях. Br Med J (Clin Res Ed) . 1984, 10 ноября. 289 (6454): 1285-7. [Медлайн]. [Полный текст].
Reitsma PH, Poort SR, Allaart CF, Briet E, Bertina RM. Спектр генетических дефектов в панели из 40 голландских семей с симптоматической недостаточностью протеина C типа I: гетерогенность и эффекты основателя. Кровь . 1991 15 августа. 78 (4): 890-4. [Медлайн]. [Полный текст].
Мустафа С., Маннхальтер С., Ринтелен С. и др. Клинические особенности тромбофилии в семьях с дефектами генов протеина C или протеина S в сочетании с фактором V Лейден. Фибринолиз свертывания крови . 1998, 9 (1): 85-9. [Медлайн].
Иноуэ Х., Терачи С.И., Учиуми Т., Сато Т. Клиническая картина и генотип дефицита протеина С с двойными мутациями гена протеина С. Рак крови у детей . 2017 24 июля. Том 64: [Medline]. [Полный текст].
Tait RC, Walker ID, Reitsma PH, et al. Распространенность дефицита протеина С среди здорового населения. Тромб Гемост . 1995, январь, 73 (1): 87-93. [Медлайн].
Miletich J, Sherman L, Broze G Jr. Отсутствие тромбоза у субъектов с гетерозиготной недостаточностью протеина C. N Engl J Med . 1987 15 октября. 317 (16): 991-6. [Медлайн].
Mateo J, Oliver A, Borrell M, Sala N, Fontcuberta J.Лабораторная оценка и клинические характеристики 2132 последовательно неотобранных пациентов с венозной тромбоэмболией — результаты Испанского многоцентрового исследования тромбофилии (EMET-Study). Тромб Гемост . 1997 Mar.77 (3): 444-51. [Медлайн].
Гу И, Шен В., Чжан Л., Чжан Дж, Инь С. Дефицит антитромбина и гена протеина С у 202 китайских пациентов с венозной тромбоэмболией. Int J Lab Hematol . 2014 Апрель 36 (2): 151-5. [Медлайн].
Heijboer H, Brandjes DP, Buller HR, Sturk A, ten Cate JW.Дефицит белков, ингибирующих свертывание, и фибринолитиков у амбулаторных больных с тромбозом глубоких вен. N Engl J Med . 1990, 29 ноября. 323 (22): 1512-6. [Медлайн].
Ichiyama M, Ohga S, Ochiai M, Fukushima K, Ishimura M, Torio M и др. Гидроцефалия плода и неонатальный инсульт как первое проявление дефицита протеина С. Brain Dev . 2016 Февраль 38 (2): 253-6. [Медлайн].
Martinelli I, Mannucci PM, De Stefano V, et al.Различные риски тромбоза при четырех дефектах свертывания крови, связанных с наследственной тромбофилией: исследование 150 семей. Кровь . 1998, 1 октября. 92 (7): 2353-8. [Медлайн]. [Полный текст].
Koster T., Rosendaal FR, Briet E, et al. Дефицит протеина C в контролируемой серии неотобранных амбулаторных пациентов: нечастый, но явный фактор риска венозного тромбоза (Leiden Thrombophilia Study). Кровь . 1995 15 мая. 85 (10): 2756-61. [Медлайн]. [Полный текст].
Pabinger I, Schneider B, для исследовательской группы Gesellschaft fur Thrombose- und Hamostaseforschung (GTH) по естественным ингибиторам. Тромботический риск при наследственной недостаточности антитромбина III, протеина C или протеина S. Совместное ретроспективное исследование. Артериосклер тромб Vasc Biol . 1996 июня 16 (6): 742-8. [Медлайн]. [Полный текст].
de Bruijn SF, Stam J, Koopman MM, Vandenbroucke JP, для группы исследования тромбоза венозного синуса головного мозга.Изучение «случай-контроль» риска тромбоза церебрального синуса у пользователей оральных контрацептивов и у носителей наследственных протромботических состояний. BMJ . 1998 21 февраля. 316 (7131): 589-92. [Медлайн]. [Полный текст].
Момои А., Комура Ю., Кумон И. и др. Тромбоз брыжеечных вен при наследственном дефиците протеина C с мутацией Arg169 (CGG-TGG). Медицинский работник . 2003 Январь 42 (1): 110-6. [Медлайн]. [Полный текст].
Высокинская Е.М., Высокински В.Е., Браун Р.Д. и др.Различия тромбофилии при венозном синусе головного мозга и тромбозе глубоких вен нижних конечностей. Неврология . 2008, 19 февраля. 70 (8): 627-33. [Медлайн].
Melissari E, Kakkar VV. Врожденный тяжелый дефицит протеина C у взрослых. Br J Haematol . 1989 июн.72 (2): 222-8. [Медлайн].
McGehee WG, Klotz TA, Epstein DJ, Rapaport SI. Некроз кумарина, связанный с наследственной недостаточностью протеина С. Энн Интерн Мед. .1984 июл.101 (1): 59-60. [Медлайн].
Pourdeyhimi N, Bullard Z. Некроз кожи, вызванный варфарином. Хосп Фарм . 2014 декабрь 49 (11): 1044-8. [Медлайн]. [Полный текст].
Faraci PA, Deterling RA Jr, Stein AM, Rheinlander HF, Cleveland RJ. Варфарин вызвал некроз кожи. Хирургический акушерский гинекологический кабинет . 1978 май. 146 (5): 695-700. [Медлайн].
Broekmans AW, Teepe RG, van der Meer FJ, Briet E, Bertina RM.Белок C (PC) и некроз кожи, вызванный кумарином. Тромб Рес . 1986. 41 (приложение 1): 137.
Парси К., Младший И., Галло Дж. Варфарин-индуцированный некроз кожи, связанный с приобретенным дефицитом протеина С. Австралас Дж. Дерматол . 2003 Февраль 44 (1): 57-61. [Медлайн].
Sallah S, Abdallah JM, Gagnon GA. Рецидивирующий индуцированный варфарином некроз кожи у родственников с дефицитом протеина S. Гемостаз . 1998 Янв-Фев.28 (1): 25-30. [Медлайн].
Preston FE, Rosendaal FR, Walker ID, et al. Повышенная потеря плода у женщин с наследственной тромбофилией. Ланцет . 1996, 5 октября. 348 (9032): 913-6. [Медлайн].
Vossen CY, Preston FE, Conard J и др. Наследственная тромбофилия и потеря плода: проспективное катамнестическое исследование. J Тромб Haemost . 2004 г., 2 (4): 592-6. [Медлайн]. [Полный текст].
Рей Э., Кан С.Р., Дэвид М., Шрайер И.Тромбофилические расстройства и потеря плода: метаанализ. Ланцет . 2003 15 марта. 361 (9361): 901-8. [Медлайн].
Kohler J, Kasper J, Witt I, von Reutern GM. Ишемический инсульт из-за дефицита протеина С. Ход . 1990, 21 июля (7): 1077-80. [Медлайн]. [Полный текст].
Camerlingo M, Finazzi G, Casto L и др. Унаследованный дефицит протеина С и негеморрагический артериальный инсульт у молодых людей. Неврология . 1991 сен.41 (9): 1371-3. [Медлайн].
Петерман М.А., Робертс WC. Синдром дефицита протеина C и острый инфаркт миокарда передней стенки в молодом возрасте из-за одиночной коронарной окклюзии с нормальными коронарными артериями. Ам Дж. Кардиол . 2003 15 сентября. 92 (6): 768-70. [Медлайн].
Douay X, Lucas C, Caron C, Goudemand J, Leys D. Уровни антитромбина, протеина C и протеина S у 127 последовательных молодых людей с ишемическим инсультом. Acta Neurol Scand . 1998 августа 98 (2): 124-7. [Медлайн].
Munts AG, van Genderen PJ, Dippel DW, van Kooten F, Koudstaal PJ. Нарушения коагуляции у молодых людей с острой церебральной ишемией. Дж. Нейрол . 1998 Январь 245 (1): 21-5. [Медлайн].
Boekholdt SM, Kramer MH. Артериальный тромбоз и роль тромбофилии. Семин Тромб Гемост . 2007 Сентябрь 33 (6): 588-96. [Медлайн].
Folsom AR, Ohira T, Yamagishi K, Cushman M.Низкий уровень протеина C и частота ишемического инсульта и ишемической болезни сердца: исследование риска атеросклероза в сообществах (ARIC). J Тромб Haemost . 2009 7 ноября (11): 1774-8. [Медлайн]. [Полный текст].
Kenet G, Lütkhoff LK, Albisetti M, Bernard T, Bonduel M, Brandao L, et al. Влияние тромбофилии на риск артериального ишемического инсульта или церебрального синовенозного тромбоза у новорожденных и детей: систематический обзор и метаанализ обсервационных исследований. Тираж . 2010 27 апреля, 121 (16): 1838-47. [Медлайн].
Комай Х., Шиндо С., Сато М., Огино Х. Снижение активности протеина С может быть связано с прогрессированием заболевания периферических артерий. Ангиология . 2014 12 августа [Medline].
Селигсон У., Бергер А., Абенд М. и др. Гомозиготный дефицит протеина C проявляется массивным венозным тромбозом у новорожденного. N Engl J Med . 1 марта 1984 г. 310 (9): 559-62.[Медлайн].
Питерс С., Каселла Дж. Ф., Марлар Р. А., Монтгомери Р. Р., Зинкхэм У. Гомозиготный дефицит протеина C: наблюдения за характером молекулярной аномалии и эффективностью терапии варфарином. Педиатрия . 1988 Февраль 81 (2): 272-6. [Медлайн].
Marciniak E, Wilson HD, Marlar RA. Молниеносная пурпура новорожденных: генетическое заболевание, связанное с отсутствием протеина С в крови. Кровь . 1985 января 65 (1): 15-20.[Медлайн]. [Полный текст].
Патель Р.К., Форд Э., Тэмпстон Дж., Арья Р. Факторы риска венозного тромбоза у чернокожего населения. Тромб Гемост . 2003 Ноябрь 90 (5): 835-8. [Медлайн].
Саката Т., Карио К., Катаяма Ю. и др. Исследования врожденного дефицита протеина C в Японии: распространенность, генетический анализ и отношение к возникновению окклюзионных заболеваний артерий. Семин Тромб Гемост . 2000. 26 (1): 11-6. [Медлайн].
Нарди М., Карпаткин М. Протромбин и протеин С в раннем детстве: нормальные уровни у взрослых не достигаются до четвертого года жизни. Дж. Педиатр . 1986 ноябрь 109 (5): 843-5. [Медлайн].
van Teunenbroek A, Peters M, Sturk A, Borm JJ, Breederveld C. Активность протеина C и уровни антигена в детстве. евро J Педиатр . 1990 августа, 149 (11): 774-8. [Медлайн].
Lensen RP, Rosendaal FR, Koster T. и др.Очевидная различная тромботическая тенденция у пациентов с дефицитом фактора V Лейдена и протеина C из-за отбора пациентов. Кровь . 1996 декабрь 1. 88 (11): 4205-8. [Медлайн]. [Полный текст].
Сарай А., Месихович Р., Ванис Н., Амила М. Дефицит белка C при хроническом гепатите C: корреляция с гистологической степенью фиброза печени. Clin Appl Thromb Hemost . 2017 23 января (1): 72-77. [Медлайн].
Broekmans AW, Veltkamp JJ, Bertina RM.Врожденный дефицит протеина С и венозная тромбоэмболия. Исследование трех голландских семей. Медицинский журнал Новой Англии . 1983, 11 августа. 309: 340-344. [Медлайн]. [Полный текст].
Martinelli I1, Mannucci PM, De Stefano V, Taioli E, Rossi V, Crosti F и др. Различные риски тромбоза при четырех дефектах свертывания крови, связанных с наследственной тромбофилией: исследование 150 семей. Кровь . 1 октября 1998 г. 92: 2353-2358. [Медлайн]. [Полный текст].
Молино Д., Де Люсия Д., Маротта Р., Перна А., Ломбарди С., Чирилло М. и др.При уремии уровни в плазме антител к протеину C и анти протеину S связаны с тромбозом. Почки Инт . 2005 сентябрь 68 (3): 1223-9. [Медлайн]. [Полный текст].
Mitchell CA, Rowell JA, Hau L, Young JP, Salem HH. Смертельное тромботическое заболевание, связанное с приобретенным ингибитором протеина C. N Engl J Med . 1987 24 декабря. 317 (26): 1638-42. [Медлайн].
Гордон Б., Хейр В., Руби Е. и др. Длительный дефицит протеина C после трансплантации гемопоэтических стволовых клеток. Пересадка костного мозга . 1996 17 марта (3): 415-9. [Медлайн].
Gerson WT, Dickerman JD, Bovill EG, Golden E. Тяжелый приобретенный дефицит протеина C у молниеносной пурпуры, связанный с диссеминированным внутрисосудистым свертыванием: лечение концентратом протеина C. Педиатрия . 1993, февраль, 91 (2): 418-22. [Медлайн].
Шлегель Н. Тромбоэмболические риски и осложнения у нефротических детей. Семин Тромб Гемост .1997. 23 (3): 271-80. [Медлайн].
MacCallum PK, Cooper JA, Martin J, Howarth DJ, Meade TW, Miller GJ. Связь протеина C и протеина S с концентрацией липидов в сыворотке. Британский гематологический журнал . 2001, 25 декабря, 102: 609-615. [Медлайн]. [Полный текст].
Йилмаз С., Гунайдин С. Наследственные факторы риска венозной тромбоэмболии низкого риска у пациентов младше 45 лет. Торакальная хирургия Interact Cardiovasc . 2014 окт 17.[Медлайн].
Михильс Дж. Дж., Хамуляк К. Лабораторная диагностика наследственной тромбофилии. Семин Тромб Гемост . 1998. 24 (4): 309-20. [Медлайн].
Долан Г., Нил К., Купер П., Браун П., Престон Ф. Белок С, антитромбин III и плазминоген: влияние возраста, пола и группы крови. Br J Haematol . 1994 апр. 86 (4): 798-803. [Медлайн].
Martinoli JL, Stocker K. Быстрый функциональный анализ протеина C с использованием Protac, нового активатора протеина C. Тромб Рес . 1 августа 1986 г. 43 (3): 253-64. [Медлайн].
Джонс DW, Mackie IJ, Winter M, Gallimore M, Machin SJ. Обнаружение дефицита протеина C во время пероральной антикоагулянтной терапии — использование соотношения протеин C: фактор VII. Фибринолиз свертывания крови . 1991 июн. 2 (3): 407-11. [Медлайн].
Linn YC, Tien SL. Обнаружение дефицита протеина C или протеина S у пациентов, получающих терапию варфарином — исследование девяти пациентов. Энн Акад Мед Сингапур .1994 23 сентября (5): 775-80. [Медлайн].
Эммануэль Х. Фавалоро и Джузеппе Липпи. Вмешательство прямых пероральных антикоагулянтов в исследованиях гемостаза: высокий потенциал диагностических ложноположительных и ложноотрицательных результатов. Переливание крови . 2017 Ноябрь 15: 491-494. [Медлайн]. [Полный текст].
Milleret C, Epiard C, Douchin S, Pernod G, Debillon T. Раннее антитромботическое лечение пероральной суспензией варфарина при тяжелой неонатальной недостаточности протеина C. Арх. Педиатр . 2017 24 апреля (4): 363-366. [Медлайн].
Schramm W., Spannagl M, Bauer KA, et al. Лечение кумаринового некроза кожи очищенным концентратом протеина С моноклональными антителами. Дерматол Арки . 1993 июн 129 (6): 753-6. [Медлайн].
Menon N, Sarode R, Zia A. Корректировка дозы ривароксабана с использованием образования тромбина при тяжелой врожденной недостаточности протеина C и индуцированном варфарином некрозе кожи. Blood Adv . 2018 23 января. 2 (2): 142-145. [Медлайн]. [Полный текст].
Минфорд А., Бениш В., Бронс П., Дэвид М., Гомес Гомес Н., Хертфельдер Г. Дж. И др. Подкожный концентрат протеина C в лечении тяжелой недостаточности протеина C — опыт 12 центров. Br J Haematol . 2014 Февраль 164 (3): 414-21. [Медлайн].
Конард Дж., Бауэр К.А., Грубер А. и др. Нормализация маркеров активации свертывания крови очищенным концентратом протеина С у взрослых с дефицитом гомозиготного протеина С. Кровь . 1993 15 августа. 82 (4): 1159-64. [Медлайн]. [Полный текст].
Дрейфус М., Ладузи А., Чамбост Н. и др. Для исследовательской группы PROTEXEL. Лечение наследственного дефицита протеина C заместительной терапией с использованием французского очищенного плазменного концентрата протеина C (PROTEXEL). Vox Sang . 2007 Октябрь 93 (3): 233-40. [Медлайн].
Хартман К. Р., Манко-Джонсон М., Ролингс Дж. С., Бауэр Д. Д., Марлар Р. А.. Гомозиготный дефицит протеина C: начало лечения варфарином. Am J Pediatr Hematol Oncol . 1989 Зима. 11 (4): 395-401. [Медлайн].
Minford AM, Parapia LA, Stainforth C, Lee D. Лечение дефицита гомозиготного протеина C с помощью подкожного концентрата протеина C. Br J Haematol . 1996 апр. 93 (1): 215-6. [Медлайн].
Lee MJ, Kim KM, Kim JS, Kim YJ, Lee YJ, Ghim TT. Долгосрочная выживаемость ребенка с гомозиготным дефицитом протеина С, успешно пролеченного при трансплантации печени от живого донора. Педиатр по трансплантологии . 2009 марта 13 (2): 251-4. [Медлайн].
Crowther MA, Ageno W, Garcia D и др. Пероральный прием витамина К по сравнению с плацебо для коррекции чрезмерной антикоагуляции у пациентов, получающих варфарин: рандомизированное исследование. Энн Интерн Мед. . 2009 3 марта. 150 (5): 293-300. [Медлайн].
Klein TE, Altman RB, Eriksson N, et al, для Международного консорциума по фармакогенетике варфарина. Оценка дозы варфарина по клиническим и фармакогенетическим данным. N Engl J Med . 2009 19 февраля. 360 (8): 753-64. [Медлайн]. [Полный текст].
Тромбофилия | Причины и лечение
Что такое тромбофилия?
Тромбофилия относится к группе состояний, при которых кровь свертывается легче, чем обычно. Это может привести к образованию нежелательных тромбов (так называемых тромбозов) внутри кровеносных сосудов. Эти сгустки крови могут вызывать такие проблемы, как тромбоз глубоких вен (ТГВ) или тромбоэмболия легочной артерии. Дополнительные сведения см. В отдельных брошюрах «Тромбоз глубоких вен и эмболия легочной артерии».
Что вызывает тромбофилию?
В организме происходит естественный процесс свертывания крови, который изменяется при тромбофилии.
Нормальный процесс свертывания крови называется гемостазом. Это помогает остановить кровотечение, если у вас есть травма, например порез. При травме кровеносного сосуда запускается процесс свертывания крови. Это называется каскадом свертывания. Это цепная реакция различных химических веществ в крови, которые называются факторами свертывания крови. Каскад свертывания крови заставляет кровь превращаться в сгусток, который прилипает к поврежденной части кровеносного сосуда.Маленькие частицы в крови, называемые тромбоцитами, также способствуют образованию сгустка.
В крови также содержатся природные химические вещества, которые действуют против системы свертывания, препятствуя слишком сильному свертыванию крови.
Тромбофилия возникает при нарушении нормального баланса системы свертывания крови. Может быть слишком много фактора свертывания или слишком мало вещества, препятствующего свертыванию.
Тромбофилия может вызвать нежелательные тромбы (тромбозы). Это не означает, что у каждого человека с тромбофилией образуется тромб.Но это означает, что у вас более высокий риск образования тромбов, чем обычно. Дополнительный риск будет зависеть от типа вашей тромбофилии.
Что такое тромбоз?
Сгусток крови, образующийся внутри кровеносного сосуда, в медицине известен как тромб . Тромбоз — это процесс, при котором образуется тромб. Тромб может заблокировать кровеносный сосуд — эта закупорка теперь также известна как тромбоз . Слово тромбозы — это множественная версия тромбоза (то есть более одного).
Какие бывают типы тромбофилии?
Тромбофилии можно разделить на наследственные и приобретенные. Унаследованные являются генетическими и могут передаваться от родителя к ребенку.
Приобретенные тромбофилии не передаются по наследству, то есть они не имеют ничего общего с вашими генами. Обычно приобретенные тромбофилии проявляются в зрелом возрасте. Они могут произойти в результате других возникших медицинских проблем или могут быть связаны с проблемами с иммунной системой.
Возможна смешанная тромбофилия, частично обусловленная генетическими, а частично негенетическими факторами.
Различные типы тромбофилии более подробно описаны ниже в этой брошюре.
Каковы симптомы тромбофилии?
Нет никаких симптомов, если тромбофилия не приводит к образованию тромба (тромбозу) .
Многие люди с тромбофилией не образуют тромб и не имеют никаких симптомов.
Каковы симптомы тромбов?
Сгустки крови могут образовываться в артериях и венах.Артерии — это кровеносные сосуды, по которым кровь от сердца поступает к органам и тканям тела. Вены — это кровеносные сосуды, по которым кровь возвращается к сердцу от остального тела.
Сгусток крови в вене является наиболее частой проблемой при тромбофилии — это называется венозным тромбозом . Возможные симптомы:
- Боль и припухлость в ноге. Это происходит, если у вас есть тромб в большой вене на ноге. Это обычно известно как тромбоз глубоких вен (ТГВ).ТГВ может возникнуть в любой вене вашего тела, но чаще всего поражает вену на ноге.
- Сгусток крови может попасть в сердце и в легкое, вызывая тромбоэмболию легочной артерии. Возможные симптомы: боль в груди, боль при глубоком дыхании, одышка или, в редких случаях, коллапс.
- Некоторые типы тромбофилии могут вызвать образование тромба в необычных местах, таких как мозг, кишечник или печень. Это может вызвать симптомы в голове или животе. Сгусток крови в венах печени называется синдромом Бадда-Киари.
Сгусток крови в артерии может возникнуть при некоторых типах тромбофилии. Это называется артериальный тромбоз . В зависимости от того, какая артерия поражена, сгусток крови в артерии может вызвать инсульт, сердечный приступ или проблемы с плацентой во время беременности. Итак, возможные симптомы артериального тромбоза, вызванного тромбофилией:
. Важно помнить, что все эти состояния могут быть вызваны не тромбофилией, а другими причинами. Например, курение, высокое кровяное давление, диабет и высокий уровень холестерина являются основными факторами риска развития таких проблем, как сердечный приступ и инсульт.
По этой причине не все пациенты с инсультом или сердечным приступом проходят тестирование на тромбофилию, поскольку это не частая причина.
Как диагностируется тромбофилия?
Тромбофилию можно заподозрить, если у кровного родственника был тромб в молодом возрасте (до 40 лет). Это также можно заподозрить, если у вас образовался тромб, чего нельзя было ожидать, учитывая ваш возраст и общее состояние здоровья.
Одним из наиболее важных моментов является то, что тестирование на тромбофилию не проводится регулярно всем, у кого есть тромб.Только определенные люди должны проходить эти тесты — результат изменит то, как к вам относятся. Тесты дорогие, и иногда неизвестно, как результат повлияет на ваши шансы в будущем иметь тромб. Это может быть довольно сложно понять, но часто, если у вас только что образовался тромб, вам в любом случае будет назначено разжижающее кровь (антикоагулянтное) лечение. Это произойдет независимо от того, есть у вас тромбофилия или нет. Если у вас однажды был неспровоцированный тромб (то есть это произошло без очевидной причины), вы в любом случае будете классифицированы как имеющие более высокий риск образования тромба в будущем.Это произойдет независимо от того, положительный у вас тест на тромбофилию.
Какие тесты на тромбофилию?
Тромбофилия диагностируется на основании анализа крови.
Анализы проводятся через несколько недель или месяцев после тромбоэмболии легочной артерии или тромбоэмболии легочной артерии, поскольку наличие этих состояний может повлиять на результаты. Обычно вам приходится ждать, пока вы не прекратите прием разжижающих кровь лекарств (антикоагулянтов), таких как варфарин, в течение 4-6 недель. Если вы недавно были беременны, анализы, возможно, придется отложить на восемь недель.Это связано с тем, что результаты беременности гораздо труднее понять.
Берется образец крови, и на нем будет проведено несколько различных анализов для проверки различных частей процесса свертывания крови. Обычно тесты проходят в два этапа. Первый тест — это скрининг на тромбофилию, который представляет собой несколько основных тестов на свертывание крови. Если результаты показывают, что возможна тромбофилия, будет взят еще один образец крови для более подробных анализов.
Вас могут направить к врачу, специализирующемуся на заболеваниях крови (гематологу).Врач обычно спрашивает о вашем анамнезе и семейном анамнезе. Это поможет интерпретировать результаты теста.
Все ли тромбофилии можно диагностировать с помощью анализов?
Вероятно, существуют некоторые виды тромбофилии, которые мы еще не можем идентифицировать или тестировать. Это потому, что есть люди или семьи, у которых тромбов больше, чем обычно ожидается, но результаты тестов на тромбофилию отрицательны. В этой ситуации вам могут порекомендовать лечение как от тромбофилии, даже если у вас нет точного диагноза.
Таким образом, отрицательные результаты анализов не исключают возможности наличия у вас унаследованного повышенного риска образования тромбов.
Кого следует обследовать на тромбофилию?
Текущие рекомендации предполагают, что тестирование на тромбофилию следует рассматривать в следующих ситуациях:
- Если у вас венозный тромбоз или тромбоэмболия легочной артерии в возрасте до 40 лет.
- Если у вас есть повторяющиеся эпизоды венозного тромбоза, тромбоэмболии легочной артерии или воспаленных вен (тромбофлебит).
- Если у вас венозный тромбоз в необычном месте — например, в животе (животе) или головном мозге — при некоторых обстоятельствах, так как они могут быть вызваны другими состояниями.
- Необъяснимые тромбозы у новорожденных.
- Младенцы или дети с редким заболеванием, называемым молниеносной пурпурой.
- Если у вас развивается некроз кожи, при котором участки кожи теряются из-за сгустков внутри или под кожей, из-за таких лекарств, как варфарин.
- Если у вас артериальный тромбоз в возрасте до 40 лет.
- Если вы являетесь кровным родственником человека с определенными типами тромбофилии высокого риска, такими как дефицит протеина C и протеина S в некоторых случаях.
- Некоторые беременные женщины, у которых в прошлом был тромбоз из-за легкого провоцирующего фактора. (Тем не менее, беременная женщина с неспровоцированным тромбозом в анамнезе не нуждается в обследовании, так как во время беременности ей все равно нужны разжижающие кровь препараты (антикоагулянты).)
- Если у вас есть семейный анамнез венозного тромбоза как минимум у двух родственников.
- Если у вас есть определенные результаты анализа крови: необъяснимое пролонгированное активированное частичное тромбопластиновое время (АЧТВ) — ненормальный результат определенного типа теста на свертывание крови. Некоторые люди с другими заболеваниями (потому что они иногда могут быть связаны с тромбофилией):
- Повторяющийся выкидыш.
- Смерть плода.
- Идиопатическая тромбоцитопеническая пурпура (ИТП) — заболевание, поражающее тромбоциты крови.
- Системная красная волчанка (СКВ), также называемая волчанкой.
Даже если в семье есть известная тромбофилия, вы не можете пройти тест на нее, если она легкая и у вас не было тромба. Это потому, что у вас нет симптомов (у вас нет симптомов). Если вы знаете, есть ли у вас этот унаследованный дефект, это не повлияет на отношение к вам; вам, вероятно, не понадобятся антикоагулянты, потому что неизвестно, насколько увеличивается ваш риск аномального свертывания крови. Лечение антикоагулянтами должно быть тщательно оценено, поскольку их использование также сопряжено с определенными рисками, такими как кровотечение.
Как лечить тромбофилию?
В первую очередь вы и ваш врач должны определить, насколько велик риск образования тромба. Этот риск зависит от сочетания факторов, например:
- Какой у вас тип тромбофилии (у некоторых риск образования тромбов выше, чем у других).
- Ваш возраст, вес, образ жизни и другие заболевания.
- Беременны ли вы или недавно родили.
- Был ли у вас тромб.
- Ваш семейный анамнез — были ли у близких родственников тромбы.
Эта информация поможет вашему врачу оценить, какой у вас риск развития тромба и какой тип тромба может образоваться. Затем вы и ваш врач можете обсудить плюсы и минусы лечения, а также, при необходимости, какой тип лечения принять.
Возможные методы лечения тромбофилии:
Аспирин в низких дозах
Аспирин в низких дозах подавляет действие тромбоцитов, поэтому может помочь предотвратить образование тромбов.Это также может помочь предотвратить выкидыш или проблемы с беременностью при некоторых типах тромбофилии.
Антикоагулянтная терапия
Антикоагулянтную терапию часто называют «разжижением» крови. Однако на самом деле он не разжижает кровь. Он изменяет определенные химические вещества в крови, чтобы остановить образование тромбов так легко — по сути, он замедляет процесс свертывания. Он также не растворяет тромб (как некоторые ошибочно думают). Затем собственные механизмы исцеления организма могут начать работать, чтобы разрушить любой существующий сгусток крови.
Антикоагулянты могут значительно снизить вероятность образования тромба. Антикоагулянтные препараты обычно используются для лечения венозного тромбоза (такого как ТГВ) или тромбоэмболии легочной артерии.
При тромбофилии можно порекомендовать прием антикоагулянтов, если:
- У вас образовался тромб, чтобы предотвратить образование нового тромба.
- У вас не было тромба, но у вас высокий риск его развития.
- У вас временная ситуация, которая подвергает вас высокому риску образования тромба.Это может произойти, если вы беременны, в течение шести недель после родов или длительное время неподвижны.
Антикоагулянтные препараты вводятся путем инъекции (например, гепарина) или в виде таблеток. Варфарин — это наиболее часто используемый таблетированный антикоагулянт. Другие антикоагулянты, принимаемые в форме таблеток, включают апиксабан, эдоксабан, дабигатран и ривароксабан.
Варфарин — обычный антикоагулянт. Однако для полного действия таблеток варфарина требуется несколько дней.Поэтому инъекции гепарина (часто вводимые непосредственно под кожу) используются вместе с варфарином в первые несколько дней (обычно пять дней) для немедленного эффекта, если у вас в настоящее время есть сгусток крови. Если вы начинаете прием варфарина и у вас нет тромба (то есть это просто для его предотвращения), вам не понадобятся инъекции гепарина в первую очередь.
Цель состоит в том, чтобы получить нужную дозу варфарина, чтобы кровь не свертывалась. Слишком большое количество варфарина может вызвать кровотечение. Чтобы подобрать правильную дозу, вам понадобится регулярный анализ крови, называемый международным нормализованным соотношением (INR), пока вы принимаете варфарин.Доза подбирается индивидуально по результатам этого анализа крови. INR — это анализ крови, который измеряет вашу способность к свертыванию крови. Сначала вам нужны анализы довольно часто, но затем, когда будет подобрана правильная доза, они будут реже.
Обычно целью является МНО 2,5, если вы принимаете варфарин для предотвращения образования тромба при тромбофилии или для лечения ТГВ или тромбоэмболии легочной артерии. Тем не менее, любое значение в диапазоне 2-3 обычно нормально. Если у вас были рецидивирующие ТГВ или легочная эмболия во время приема варфарина, вам может потребоваться более высокое МНО (даже более «жидкая» кровь).Анализы крови на МНО обычно можно сделать в амбулаторной клинике или иногда у вашего терапевта. Вам могут посоветовать принимать варфарин на протяжении всей жизни, чтобы предотвратить образование тромбов, если у вас тромбофилия. Или у вас может быть краткосрочное лечение вашего текущего ТГВ или тромбоэмболии легочной артерии (обычно 3-6 месяцев).
Гепарин — инъекционный антикоагулянт. Стандартный гепарин вводится внутривенно (IV), то есть непосредственно в вену — обычно в руку. Этот тип гепарина назначают в больнице и контролируют с помощью анализов крови.
Низкомолекулярный гепарин (НМГ) вводится под кожу в нижней части живота (брюшной полости). Его можно вводить дома, участковой медсестрой, или вас могут научить делать инъекции самостоятельно (или лицо, осуществляющее уход, может сделать это за вас). Для наблюдения за ней не нужны анализы крови. Для профилактики (профилактики) и лечения имеющегося тромба используются разные дозы. Существуют разные марки инъекций гепарина; наиболее распространенными из них являются Clexane® и Fragmin®.
Лечение во время беременности
Если вы беременны или планируете беременность, обсудите это со своим врачом и сообщите своей акушерке и врачу, специализирующемуся на беременности и родах (акушеру), о тромбофилии.Лечение тромбофилии во время беременности может быть различным, потому что:
- Некоторым женщинам с определенными типами тромбофилии рекомендуется принимать низкие дозы аспирина во время беременности, чтобы предотвратить выкидыш или проблемы с беременностью.
- Сама беременность увеличивает риск венозного тромбоза — это касается всей беременности и особенно шести недель после родов. Поэтому вам могут посоветовать начать лечение антикоагулянтами во время беременности или после родов. Это будет зависеть от типа тромбофилии и вашей истории болезни.
- Если вы принимали варфарин, вам обычно рекомендуется перейти на гепарин. Это связано с тем, что гепарин более безопасен для будущего ребенка (существует значительная вероятность того, что варфарин может вызвать аномалии плода). И гепарин, и варфарин безопасны для кормления грудью.
Профилактика ТГВ
Определенные ситуации могут временно подвергнуть вас высокому риску образования тромба, и в этих ситуациях вам могут посоветовать на некоторое время дополнительное лечение. Примеры: беременность и послеродовой период, тяжелая болезнь, серьезная операция или все, что вас обездвиживает, например, путешествие или операция.Также можно порекомендовать специальные чулки, такие как летные носки или компрессионные чулки, чтобы предотвратить ТГВ.
Общие рекомендации для людей с тромбофилией
- Если вам предстоит лечение или операция, сообщите своему врачу / медсестре / фармацевту о тромбофилии.
- Помните о предупреждающих симптомах тромба — немедленно обратитесь за медицинской помощью, если вы подозреваете его (симптомы см. Выше).
- Избегайте недостатка жидкости в организме (обезвоживания), выпивая достаточное количество жидкости.Обезвоживание может способствовать образованию тромбов.
- Сохраняйте активность и избегайте длительного пребывания в неподвижном состоянии — неподвижность способствует образованию тромбов в ногах (ТГВ).
- С осторожностью при приеме лекарств: некоторые лекарства повышают риск образования тромба. Например, комбинированные оральные контрацептивы (КОК), таблетки или пластыри и заместительная гормональная терапия (ЗГТ). Вам могут посоветовать избегать приема некоторых лекарств или перейти на те, которые не влияют на свертываемость крови.
- Поддерживайте здоровый вес — избыточный вес или ожирение увеличивает риск образования тромбов в ногах.
- Чтобы поддерживать здоровье кровеносных сосудов (в частности, артерий), не курите. Это важно, если у вас есть тромбофилия, которая может вызывать образование тромбов в артериях, поскольку курение также способствует образованию тромбов в артериальной крови.
Какие осложнения тромбофилии — и каковы перспективы?
Часто осложнений не бывает. Многие формы тромбофилии являются легкими, поэтому прогноз (прогноз) для многих людей с тромбофилией означает, что у них нет проблем с их состоянием.Кроме того, во многих случаях лечение может успешно предотвратить осложнения.
Тромбоэмболия легочной артерии, инсульт, сердечный приступ или сгусток крови в головном мозге или животе (брюшной полости) могут быть опасными для жизни состояниями. Раннее лечение может спасти жизнь и уменьшить количество осложнений. Поэтому важно знать симптомы и немедленно обратиться за лечением, если вы подозреваете какой-либо тромб.
Как упоминалось выше, некоторые типы (не все) тромбофилии могут увеличить вероятность проблем во время беременности.Ваш врач может посоветовать — это будет зависеть от типа тромбофилии, а также у разных людей. Тем не менее, многие женщины с тромбофилией беременеют успешно.
Также могут быть осложнения из-за разжижающей кровь (антикоагулянтной) терапии. Аспирин, гепарин и варфарин могут иметь побочные эффекты, в основном нежелательные кровотечения, такие как внутреннее кровотечение из слизистой оболочки желудка. По этой причине вам и вашему врачу важно взвесить все за и против лечения.Необходимо учитывать вашу индивидуальную ситуацию и предпочтения.
Тестирование родственников
Если у вас или вашей семьи есть наследственная (генетическая) форма тромбофилии, вас могут попросить пройти тесты для себя или ваших близких родственников. Это нужно для того, чтобы увидеть, есть ли у вас или других членов семьи такое же состояние. Однако преимущества поиска людей с тромбофилией, у которых не было тромба, еще не доказаны. Вот почему существуют четкие инструкции о том, кого следует тестировать.
Какие бывают типы тромбофилии?
В этом разделе описаны наиболее распространенные типы тромбофилии, но не все состояния.
Унаследованные тромбофилии
Фактор V Лейден
Это произносится как «фактор 5 лайден». Это довольно распространено у людей европейского происхождения — примерно у 1 из 20 европейцев есть лейденский ген фактора V. Этот ген влияет на фактор V каскада свертывания, заставляя процесс свертывания длиться дольше.Это увеличивает риск образования тромба в вене примерно в восемь раз. Это все еще относительно низкий риск, поэтому у большинства людей с фактором V Лейден не возникает проблем. Некоторые люди наследуют два лейденских гена фактора V — по одному гену от каждого родителя (известный как «гомозиготный фактор V Лейдена»). Это менее распространено, но значительно повышает риск — примерно в восемьдесят раз выше обычного.
Протромбин 20210
Протромбин является фактором свертывания крови, и у людей с геном 20210 наблюдается изменение протромбина, что облегчает образование сгустков.Примерно 1 из 50 человек европейского происхождения имеет этот ген; это чаще встречается у людей южноевропейского происхождения. Это увеличивает риск образования тромба в вене вдвое по сравнению с нормальным риском. Это относительно низкий риск, поэтому у большинства людей с протромбином 20210 тромб не образуется.
Дефицит протеина C
Протеин C — это естественный антикоагулянт, содержащийся в крови. Дефицит может быть генетическим или вызван другими состояниями, такими как заболевание почек. При наследственном дефиците протеина C риск образования тромба варьируется в зависимости от семьи.Это потому, что в каждой семье есть разные изменения в гене протеина C. Лучшим индикатором вашего уровня риска является наличие тромба у вас или ваших родственников. Если ребенок наследует два гена с дефицитом протеина C (по одному от каждого родителя — это очень редко), у него будет более серьезная проблема. Вскоре после рождения у них на коже образуются сгустки крови (состояние, называемое молниеносной пурпурой). Это лечится концентратами протеина С и препаратами, разжижающими кровь (антикоагулянтами).
Дефицит протеина S
Белок S также является естественным антикоагулянтом в крови.Дефицит протеина S встречается редко. Риск образования тромба варьируется в зависимости от семьи. Лучшим индикатором вашего риска является проверка наличия тромба у других родственников.
Дефицит антитромбина
Антитромбин — еще один природный антикоагулянт, содержащийся в крови. Существуют разные типы дефицита антитромбина, как генетические, так и вызванные другими заболеваниями. Наследственная форма встречается редко и поражает примерно 1 человека из 2000.
Дефицит антитромбина — довольно тяжелая форма тромбофилии.Риск образования тромба варьируется в зависимости от семьи, но может быть увеличен в 25-50 раз по сравнению с нормальным риском. При этом состоянии сгусток крови может образоваться не только в ногах или легких, но и в венах рук, кишечника, головного мозга или печени. Примерно у 1 из 2 человек с дефицитом антитромбина тромб образуется в возрасте до 30 лет. Другие же без проблем доживают до пожилого возраста.
При этом заболевании, если у вас действительно образуется тромб, вам могут посоветовать длительный прием варфарина.Однако это нужно решать в индивидуальном порядке. Кроме того, лечение концентратами антитромбина может быть назначено, когда существует более высокий риск образования тромба, например, если вам предстоит серьезная операция.
При беременности обычно требуется антикоагулянтное лечение гепарином. Также можно использовать лечение концентратами антитромбина.
Примечание : у детей может быть дефицит антитромбина; родители должны знать, чтобы они могли обнаружить признаки сгустка крови.Хотя у большинства детей тромб не образуется, они подвергаются риску в таких ситуациях, как хирургическое вмешательство. У некоторых новорожденных также появляются тромбы. Может потребоваться лечение антикоагулянтами или концентрат антитромбина. Родители, которые сами имеют дефицит антитромбина и ждут ребенка, должны обсудить это со своим врачом.
Дисфибриногенемия
Это редкий генетический дефект, при котором растворяющее сгустки химическое вещество, называемое фибриногеном, не работает нормально. Может быть повышенное свертывание крови, усиление кровотечения или и то, и другое.
Комбинированные наследственные тромбофилии
Некоторые люди наследуют более одного гена тромбофилии — например, фактор V Лейден плюс протромбин 20210. При комбинированных тромбофилиях риск образования тромба увеличивается в несколько раз, и риск гораздо выше, чем при любом другом. состояние в одиночку.
Приобретенные тромбофилии
Приобретенные тромбофилии не передаются по наследству и обычно возникают во взрослом возрасте.
Антифосфолипидный синдром (APS) .Это также известно как синдром Хьюза. Это вызвано определенными химическими веществами иммунной системы (антителами) в крови, которые называются антифосфолипидными антителами. APS может вызвать образование тромба в артериях и мелких кровеносных сосудах, а также в венах. В некоторых случаях APS может повлиять на беременность. Многие женщины с АФС не имеют проблем с беременностью. Однако APS может вызвать выкидыш или другие проблемы — ограничение роста плода, преэклампсию или, в редких случаях, смерть плода. Эти проблемы можно уменьшить путем лечения.
APS можно лечить низкими дозами аспирина, которые помогают при беременности. Если у вас образовался тромб, то вместо него обычно рекомендуется варфарин (или гепарин, если вы беременны). Узнайте больше об антифосфолипидном синдроме.
Другие приобретенные состояния
Другие состояния могут увеличить риск образования тромба. Некоторые врачи относят их к тромбофилиям. Примерами являются определенные нарушения, влияющие на тромбоциты, некоторые заболевания костного мозга, некоторые проблемы с почками, воспалительные заболевания кишечника и запущенный рак.
Смешанные наследственные / приобретенные тромбофилии
Они возникают как по генетическим, так и негенетическим причинам.
Гипергомоцистеинемия
Это повышенный уровень химического вещества, называемого гомоцистеином, в крови, которое, как считается, увеличивает риск образования артериальных и венозных тромбов. Повреждает кровеносные сосуды. Это относительно легкое заболевание, но оно может увеличить факторы риска образования тромба. Могут помочь витамин B12 и фолиевая кислота.
Пароксизмальная ночная гемоглобинурия
Это редкое заболевание, поражающее костный мозг.Это может привести к образованию венозных тромбов, часто в необычных местах, таких как вены кишечника, печени или мозга. Может потребоваться антикоагулянтная терапия, и есть другие методы лечения этого состояния.
Повышенный фактор VIII
Это произносится как «фактор 8». Это связано с аномально высоким уровнем фактора VIII, который является одним из химических веществ крови, способствующих свертыванию. В зависимости от фактического уровня фактора VIII, он может увеличить риск свертывания крови примерно в шесть раз — это относительно низкий риск образования сгустка крови.
Дифференциальная диагностика гиперкоагуляции
Дифференциальная диагностика гиперкоагуляцииTOC | HEME
Дифференциальная диагностика гиперкоагуляции
1. Злокачественная опухоль
- 5-15% опухолей в целом
- Почти у 50% пациентов с раком поджелудочной железы наблюдаются тромбоэмболические осложнения.
- Может быть связано с активацией тромбоцитов опухолями и / или производством прокоагулянты
- Также может быть связано с нарушением функции белка S (или C).
- Мигрирующий тромбофлебит (синдром Труссо) не редкость.
2.Беременность
3. Оральные контрацептивы (обычно при курении или другой гиперкоагуляции). государственный)
4. Нефротический синдром
- Потеря фибринолитических компонентов (например, антитромбина III, белков C или S) через фильтрация
- Проверьте уровень альбумина; Соотношение моча: сывороточный альбумин.
5. Миелопролиферативные заболевания
6. Гиперлипидемии
7.Сахарный диабет ,00
8. Пароксизмальная ночная гемоглобинурия (ПНГ): нарушение мембраны тромбоцитов
9. Иммобилизация
10. Послеоперационный (иммобилизация, постельный режим) Наверх | Домашняя страница
11. Васкулит и коллагеновая сосудистая болезнь
- СКВ «Волчаночный антикоагулянт»
- Антифосфолипидный синдром
- Облитерирующий тромбангиит
- ANCA-ассоциированный васкулит
- Криоглобулинемия
12.Синдромы гипервязкости
- Серповидноклеточная анемия
- Полицитемия
- Гипергаммаглобулинемия (esp IgM)
13. Дефицит / дисфункция антикоагулянтов
- Антитромбин III — отсутствие, снижение, резистентность
- Дефицит протеина C может сопровождаться ДВС-синдромом.
- Устойчивость к активированному протеину C (обычно мутация фактора V)
- Белок S
- Необходимо проверить функцию печени, уровень витамина K (белки C и S являются витамином K зависит)
- Симптомы дефицита протеина C или S могут быть спровоцированы приемом варфарина. без гепарина
14.Гомоцистинемия и гомоцистеинурия ,00
- Высокий уровень гомоцистеина является фактором риска преждевременного развития сосудов от легкого до тяжелого. болезнь
- Фактор риска артериальных> венозных тромбоэмболов — нередко ранний ИМ
- Генетическое заболевание (дефицит гомзиготной бета-синтазы цистатионина) — тяжелая форма События
- Также включает умственную отсталость, эктопию лентиса, аномалии скелета. (остеопороз)
15.Тромбоцитопения, индуцированная гепарином (опосредованная антителами) ,00 Наверх | Домашняя страница
16. Противоопухолевые средства (повреждение эндотелия сосудов; HUS / TTP)
17. Ожирение
18. Пути свертывания крови
- Повышенный уровень фактора VII и / или фибриногена в плазме
- Фактор VII Генотип H6H6
19. Курение (обычно усугубляет основное состояние гиперкоагуляции)
20.Комбинации рисков гиперкоагуляции являются аддитивными или синергическими
Наверх | Домашняя страница
Ссылки:
Очерки клинической медицины в Интернете 2000
Электронная медицина
Синдром гипервязкости
Nachman RL и Silverstein R. 1993. Ann Intern Med. 119 (8): 819
Fermo I, D’Angelo V, Paroni R, et al. 1995. Ann Intern Med. 123 (10): 747
van der Bom JG, Bots ML, Haverkate F и др.1996. Ann Intern Med.
125 (4): 265
Прайс Д.Т. и Ридкер П.М. 1997. Ann Intern Med. 127 (10): 895
Iacoviello L, Di Castelnuovo A, de Knijff P, et al. 1998. NEJM. 338 (2): 79
Наверх | Домашняя страница
07172002
См. Обзор гиперкоагуляции. (Arch IM, 23 апреля 2001 г.)
Антикардиолипиновые антитела (АСА)
относятся к группе белков антифосфолипидных антител и могут иметь
антикоагулянтная активность (аналогична активности волчаночных антикоагулянтов)
Синдром антифосфолипидных антител
характеризуется повторяющимися клиническими событиями: невоспалительным тромбозом.
мелких или крупных артерий и / или вен и потери плода с очевидными
антифосфолиидные антитела (антикардиолипиновые антитела или волчаночный антикоагулянт).Синдром первичен, если нет СКВ.
Генетика тромбофилии | Сгустки крови
Тромбофилия
Автор: Элизабет Варга, M.S.
Тромбофилия — это медицинский термин, используемый для описания состояния, при котором кровь имеет повышенную тенденцию к свертыванию. Есть много причин, по которым кровь может иметь такую повышенную тенденцию.
Тромбофилия обычно подразделяется на два типа — приобретенная и наследственная.При приобретенной тромбофилии аномальное свертывание крови обычно связано с определенной причиной, например, с длительным постельным режимом после операции, травмой ноги или раком. Люди с наследственной тромбофилией склонны к образованию тромбов из-за генетической предрасположенности, унаследованной от родителей. Люди с наследственной тромбофилией могут иметь в семейном анамнезе родственников с аномальной или чрезмерной свертываемостью крови. Эта брошюра объяснит, как гены играют роль в свертывании крови и связаны с наследственной тромбофилией.
Свертывание крови (коагуляция)
Свертывание крови — естественная защита организма от кровотечения. Сгусток, или «тромб», образуется всякий раз, когда поврежден кровеносный сосуд (артерии и вены). Сгустки образуются в результате серии химических реакций между специальными клетками крови (тромбоцитами) и белками крови (факторами свертывания). Тромбоциты и факторы работают вместе, чтобы регулировать процесс свертывания; Другими словами, они начинают и прекращают свертывание крови по мере того, как это нужно организму. Если процесс протекает неправильно, в кровеносных сосудах может образоваться сгусток, блокирующий приток крови к окружающим тканям.Когда это происходит, сгусток называется тромбозом.
Тромбофилия и процесс свертывания крови
Для того, чтобы процесс свертывания работал, белки фактора свертывания крови должны присутствовать в нужных количествах и работать правильно. Люди, унаследовавшие тромбофилию, могут не вырабатывать нужное количество определенного фактора свертывания крови, или этот фактор может быть каким-то образом ненормальным. У таких людей тромбоз развивается чаще или чаще, чем у людей, не имеющих наследственной тромбофилии.
Белки и свертывание крови
Белки — это большие молекулы, которые определяют структуру тела, помогают ему функционировать и регулируют его работу. В организме много белков, и каждый из них выполняет уникальную функцию. Процесс свертывания крови — это пример совместной работы белков. Клетки крови, тромбоциты и факторы свертывания крови состоят из белков. Если есть проблемы с этими белками, это может привести к проблемам со свертыванием крови.
Генетика, белки и свертываемость крови
Чтобы понять, как генетика влияет на свертываемость крови, важно понять, как производятся белки:
Белки свертывания крови, как и все белки, образуются путем соединения цепочки химических веществ, называемых аминокислотами.Порядок аминокислот в цепи составляет определенный белок; этот порядок определяется нашими генами, которые унаследованы нами от наших родителей. Гены состоят из ДНК, которая содержит наш генетический код.
ДНК — это молекула в форме витой лестницы, состоящая из триллионов химических оснований. Эти химические основы организованы в группы по три и «читаются» телом, как приговор. A, T, G и C — «буквы» «алфавита» или кода ДНК; они обозначают химические вещества аденин, тимин, гуанин и цитозин, соответственно, которые составляют химические основы ДНК.Каждый трехбуквенный код представляет собой определенную аминокислоту. Точно так же, как ваш мозг может определять значение слов, ваше тело может назначать определенные аминокислоты для каждого трехбуквенного кода ДНК.
Сегмент кода ДНК выглядит так:
AGCCGTACGGTTCAACCG
В теле это читается как:
ACG-CGG-ACG-GTT-CAA-CCC
Исходя из этого, аминокислоты назначаются, образуя цепочку аминокислот, из которой образуется белок. Проблемы возникают, если в коде ДНК есть орфографическая ошибка (мутация).Мутации в коде ДНК могут привести к неправильному назначению аминокислоты.
ДНК с мутацией вызывает изменение аминокислоты, назначенной в определенном положении:
ACG-CAG-ACG-GTT-CAA-CGG
Если это происходит, то производимый белок изменяется. Это изменение может привести к изменению формы белка или к тому, что организм вырабатывает слишком много белка, поэтому функция белка будет другой.
Унаследованная тромбофилия
- Унаследованная тромбофилия возникает, когда наследственная мутация ДНК приводит к образованию в организме
- слишком много или слишком мало белка свертывания крови
- белок свертывания крови, который не функционирует должным образом
Хотя существует ряд мутаций, которые могут вызывать наследственную тромбофилию, наиболее распространенные мутации ДНК называются фактором V Лейдена и протромбином G20210A.Понимание того, как происходят эти две мутации, можно применить к другим мутациям, которые приводят к наследственной тромбофилии.
Фактор V (пять) Лейден
Все люди вырабатывают белок, называемый фактором V, который помогает свертыванию крови. Однако есть определенные люди, у которых есть мутация ДНК в гене, из которого вырабатывается белок фактора V. Утверждается, что у этих людей есть лейденская мутация фактора V. Мутация была названа в честь города под названием Лейден, где было проведено исследование первой семьи, в которой обнаружена мутация.Лица с лейденской мутацией фактора V унаследовали тромбофилию.
Фактор V Лейден и склонность к образованию тромбов
Обычно белок фактора V вырабатывается, чтобы помочь свертыванию крови, и вырабатывается в больших количествах после повреждения кровеносного сосуда.
Количество продуцируемого протеина фактора V контролируется другими протеинами, включая протеин C и протеин S. Соединение протеина C и протеина S помогает расщепить фактор V, предотвращая его повторное использование и свертывание крови.
Когда человек имеет фактор V Лейдена, мутация приводит к неправильной форме белка. Эта аномальная форма препятствует его правильному расщеплению белками C и S. Поскольку белок фактора V не расщепляется, он остается в крови на более длительный период времени и увеличивает тенденцию к свертыванию.
Тест на фактор V Лейден
- Тестирование фактора V Лейдена проводится путем взятия образца крови, и есть два типа тестов, которые могут быть выполнены, чтобы определить, есть ли у человека фактор V Лейдена.
- В некоторых случаях образец может быть исследован, чтобы определить, устойчива ли кровь к активированному протеину C (одному из протеинов, который помогает контролировать фактор V).
- Если кровь устойчива к активированному протеину C, вероятность того, что у человека есть мутация в гене фактора V, составляет 90-95%.
- Обычно проводится генетический тест, чтобы подтвердить анализ крови на активированный протеин С. Иногда сначала назначают генетический тест, даже не проводя тестирование на активацию протеина С. В этом случае ДНК выделяется из клеток крови, и ген фактора V исследуется, чтобы увидеть, есть ли мутация в коде ДНК.Если мутация обнаружена, значит, у человека есть фактор V Лейдена.
Распространенность фактора V Лейден
По оценкам, около 5% (1 из 20) кавказцев (белых) имеют фактор V Лейдена, и он чаще встречается у лиц европейского происхождения. В Соединенных Штатах примерно 1-2% (от 1 из 100 до 1 из 50) афроамериканцев, латиноамериканцев и коренных американцев также имеют мутацию. Фактор V Лейден редко встречается у азиатов.
Протромбин G20210A мутация
Все люди вырабатывают протеин протромбин (также называемый фактором два), который помогает свертыванию крови.Однако есть определенные люди, у которых есть мутация ДНК в гене, используемом для образования протромбина (также называемого протромбином G20210A или мутацией фактора II (два)). Говорят, что у них наследственная тромбофилия под названием протромбин G20210A. Когда это происходит, они производят слишком много протеина протромбина.
Протромбин G20210A и склонность к образованию тромбов
- Обычно протеин протромбин вырабатывается, чтобы помочь свертыванию крови, и вырабатывается в больших количествах после повреждения кровеносного сосуда.
- Люди с мутацией в гене протромбина производят больше протеина протромбина, чем обычно. Поскольку в крови больше протеина протромбина, это увеличивает тенденцию к свертыванию.
Тест на протромбин G20210A
Тестирование протромбина проводится путем взятия образца крови и использования генетического теста для определения гена протромбина.
- ДНК выделяется из клеток крови, и ген протромбина исследуется, чтобы увидеть, есть ли мутация в коде ДНК.Если обнаружено изменение гена (20210-я буква изменена с G на A), то у человека есть мутация протромбина (или фактора II).
Распространенность протромбина G20210A
Изменение гена протромбина присутствует у 2–4% (или от 1 из 50 до 1 из 25) европеоидов и чаще встречается у лиц европейского происхождения. В Соединенных Штатах примерно 0,4% (примерно 1 из 250) афроамериканцев также имеют мутацию. Мутация протромбина G20210A в других группах встречается редко.
Наследование фактора V Лейдена и протромбина G20210A
Генетические мутации передаются из поколения в поколение, потому что мы получаем свою ДНК от родителей. Наша генетическая информация передается парами. У каждого гена есть две копии; один идет от нашей матери, а другой — от отца. Различные состояния могут передаваться по-разному; тромбофилия считается доминирующим признаком. Это означает, что человек с наследственной тромбофилией должен иметь мутацию только в одной из двух копий его / ее гена, чтобы иметь заболевание.Это также называется доминантным наследованием.
Если человек наследует только одну копию мутации гена, он считается гетерозиготным («гетеро» означает разные, «зиготный» означает тела). Если обе копии гена человека имеют мутацию, они считаются гомозиготными («гомо» означает то же самое, «зиготный» означает тела).
Если человек гомозиготен (то есть он или она наследует мутацию в обеих копиях своего гена, по одной от каждого родителя), он подвергается большему риску развития тромба, чем человек, который является гетерозиготным.
Человек также может иметь больший риск развития тромба, если он унаследует мутацию более чем в одном из генов, приводящих к тромбофилии. Например, у человека повышается риск образования тромба, если у него есть и фактор V Лейдена, и протромбин G20210A.
Вероятность унаследовать тромбофилию
Каждый человек наследует по две копии каждого гена. Одна копия унаследована от матери, другая — от отца. Чтобы предсказать риск для ребенка, необходимо учитывать несколько факторов.
Первый — гетерозиготный вы (только одна из двух копий вашего гена содержит мутацию) или гомозиготный (обе копии двух ваших генов содержат мутацию). Генетический тест может сказать вам, гетерозиготный вы или гомозиготный.
Во-первых, независимо от того, являетесь ли вы гетерозиготным по мутации гена, вероятность того, что ваш ребенок унаследует мутацию гена, составляет 50:50 (или половину), потому что существует равная вероятность передачи копии гена с мутация ИЛИ копия гена без мутации.Копия гена, которую наследует ваш ребенок, возникла случайно, и никто не может изменить этот шанс. (См. Диаграмму ниже.)
Если вы гомозиготны по мутации гена, ваш ребенок унаследует мутацию. Поскольку у вас нет копии гена без мутации, невозможно передать ген без мутации вашему ребенку.
Еще одно соображение заключается в том, несет ли другой родитель ребенка генную мутацию, которая приводит к тромбофилии.Это также повлияет на шансы вашего ребенка унаследовать тромбофилию.
Консультанты-генетики — это профессиональные медики, которые могут помочь в интерпретации генетических концепций. Если вы хотите узнать больше о генетических рисках, вы можете проконсультироваться с генетическим консультантом или медицинским работником, имеющим специальную подготовку в области генетики. Чтобы найти консультанта по генетике в вашем районе, вы можете связаться с Национальным обществом консультантов по генетике по адресу http://www.nsgc.org.
Генетическое тестирование членов семьи
Решение продолжить генетическое тестирование связано с множеством проблем.Перед проведением какого-либо тестирования важно подумать о том, как генетическая информация будет использоваться в медицинском управлении. Рекомендуется обсудить эти вопросы со знающим врачом. Вы также можете просмотреть брошюру NBCA под названием «Семейное тестирование на нарушения свертывания крови» для получения дополнительной информации.
Заявление об отказе от ответственности
Национальный альянс по изучению сгустка крови (NBCA) и его Медицинский и научный консультативный совет (MASAB) не одобряют и не рекомендуют какие-либо коммерческие продукты, процессы или услуги.Взгляды и мнения авторов, выраженные на веб-сайтах NBCA или MASAB или в письменных материалах NBCA или MASAB, не обязательно содержат или отражают точку зрения NBCA или MASAB, и их нельзя использовать в целях рекламы или одобрения продукта.
NBCA или MASAB не намерены предоставлять конкретные медицинские консультации, а, скорее, предоставлять пользователям информацию, чтобы лучше понять их здоровье и диагностированные заболевания. Конкретные медицинские консультации предоставлены не будут, и NBCA и MASAB настоятельно рекомендуют вам проконсультироваться с квалифицированным врачом для постановки диагноза и ответов на ваши личные вопросы.
Нарушения свертывания крови (состояния гиперкоагуляции)
Обзор
Доктор Джон Бартоломью обсуждает фактор V Лейдена, нарушение свертывания крови.Образование сгустка крови
Когда вы порезаетесь или получаете травму, ваше тело останавливает кровотечение, образуя сгусток крови.Белки и частицы в крови, называемые тромбоцитами, слипаются, образуя сгусток крови. Процесс образования сгустка называется коагуляцией. Нормальная коагуляция важна во время травмы, поскольку она помогает остановить кровотечение из пореза и запустить процесс заживления.
Однако кровь не должна свертываться, когда она просто движется по телу. Если кровь имеет тенденцию к слишком сильному свертыванию, это называется состоянием гиперкоагуляции или тромбофилией.
Опасны ли состояния гиперкоагуляции?
Состояния гиперкоагуляции могут быть опасными, особенно если эти состояния не идентифицированы и не лечатся должным образом.Люди с гиперкоагуляцией имеют повышенный риск образования тромбов в артериях (кровеносных сосудах, которые отводят кровь от сердца) и венах (кровеносных сосудах, несущих кровь к сердцу). Сгусток внутри кровеносного сосуда также называется тромбом или эмболом.
Сгустки крови в венах или венозной системе могут перемещаться по кровотоку и вызывать тромбоз глубоких вен (сгусток крови в венах таза, ног, рук, печени, кишечника или почках) или легочную эмболию (сгусток крови в легких). ).
Сгустки крови в артериях могут увеличить риск инсульта, сердечного приступа, сильной боли в ногах, затруднений при ходьбе или даже потери конечности.
Симптомы и причины
Что вызывает состояния гиперкоагуляции?
Состояния гиперкоагуляции обычно являются генетическими (наследственными) или приобретенными состояниями.Генетическая форма этого расстройства означает, что человек рождается со склонностью к образованию тромбов. Приобретенные состояния обычно являются результатом хирургического вмешательства, травмы, приема лекарств или состояния здоровья, которое увеличивает риск состояний гиперкоагуляции.
Унаследовано Условия гиперкоагуляции включают:
- Фактор V Лейден (самый распространенный)
- Мутация гена протромбина
- Дефицит природных белков, препятствующих свертыванию (таких как антитромбин, протеин C и протеин S)
- Повышенный уровень гомоцистеина
- Повышенный уровень фибриногена или дисфункционального фибриногена (дисфибриногенемия)
- Повышенные уровни фактора VIII (все еще исследуемого как наследственное заболевание) и других факторов, включая фактор IX и XI
- Аномальная фибринолитическая система, включая гипоплазминогенемию, дисплазминогенемию и повышение уровней ингибитора активатора плазминогена (PAI-1)
Приобретенные состояния гиперкоагуляции включают:
- Рак
- Некоторые лекарства, используемые для лечения рака, такие как тамоксифен, бевацизумаб, талидомид и леналидомид
- Недавняя травма или операция
- Установка центрального венозного катетера
- Ожирение
- Беременность
- Дополнительное употребление эстрогенов, включая оральные противозачаточные таблетки (противозачаточные таблетки)
- Заместительная гормональная терапия
- Длительный постельный режим или неподвижность
- Сердечный приступ, застойная сердечная недостаточность, инсульт и другие заболевания, приводящие к снижению активности
- Гепарин-индуцированная тромбоцитопения (снижение количества тромбоцитов в крови из-за гепарина или препаратов низкомолекулярного гепарина)
- Продолжительное путешествие на самолете, также известное как «синдром эконом-класса».
- Синдром антифосфолипидных антител
- Тромбоз глубоких вен или тромбоэмболия легочной артерии в анамнезе
- Миелопролиферативные заболевания, такие как истинная полицитемия или эссенциальный тромбоцитоз
- Пароксизмальная ночная гемоглобинурия
- Синдром воспалительного кишечника
- ВИЧ / СПИД
- Нефротический синдром (слишком много белка в моче)
Диагностика и тесты
Как диагностируется состояние гиперкоагуляции?
Тщательный медицинский анамнез
Определенные условия повышают риск развития тромбов у человека, но не обязательно указывают на генетическое состояние гиперкоагуляции.Следовательно, необходима тщательная оценка личной и семейной истории болезни пациента.
Пациенты могут быть кандидатами на обследование на гиперкоагуляцию, если у них есть:
- Семейная история аномального свертывания крови
- Нарушение свертываемости крови в молодом возрасте (до 50 лет)
- Тромбоз необычных участков или участков, таких как вены рук, печень (портальная), кишечник (брыжеечный), почки (почечные) или головной мозг (церебральный)
- Сгустки крови без ясной причины (идиопатические)
- Повторяющиеся тромбы
- В анамнезе частые выкидыши
- Инсульт в молодом возрасте
Лабораторные испытания
Если у вас есть одно из перечисленных выше состояний, ваш врач может порекомендовать анализы крови для дальнейшей оценки вашего состояния.
Эти тесты должны выполняться в специализированной лаборатории свертывания крови и интерпретироваться патологом или клиницистом, имеющим опыт в области коагуляции, сосудистой медицины или гематологии.
В идеале анализы следует делать, когда у вас нет острого свертывания крови.
Наиболее распространенные лабораторные тесты включают:
- PT-INR : Тест на протромбиновое время (PT или protime) используется для расчета вашего международного нормализованного отношения (INR). Эта информация используется для отслеживания вашего состояния, если вы принимаете варфарин (кумадин).Ваш INR поможет вашему лечащему врачу определить, насколько быстро ваша кровь свертывается и нужно ли изменить дозу варфарина (кумадина).
- Активированное частичное тромбопластиновое время (АЧТВ) : Измеряет время, необходимое для свертывания крови. Этот тест используется для контроля вашего состояния, если вы принимаете гепарин.
- Уровень фибриногена
- Общий анализ крови
Некоторые тесты помогают выявить синдром антифосфолипидных антител или дисфибриногенемии — состояния, которые могут быть связаны с состояниями гиперкоагуляции.
Тесты, используемые для диагностики наследственных состояний гиперкоагуляции, включают:
- Генетические тесты, включая фактор V Лейден (устойчивость к активированному протеину C) и мутацию гена протромбина (G20210A) *
- Активность антитромбина
- Активность протеина С
- Активность протеина S **
- Уровни гомоцистеина в плазме натощак
* Фактор V Лейден и мутация гена протромбина (G20210A) являются наиболее часто выявляемыми генетическими дефектами, повышающими риск свертывания крови у человека.
** Дополнительные лабораторные тесты, такие как измерение уровней свободного (активного) и общего антигена протеина S, могут потребоваться для подтверждения результатов анализа активности протеина S.
Другие тесты, используемые для диагностики приобретенных состояний гиперкоагуляции, включают тесты на:
- Антикардиолипиновые антитела (АСА) или бета-2 гликопротеины, которые являются частью синдрома антифосфолипидных антител *
- Волчаночные антикоагулянты (LA), часть синдрома антифосфолипидных антител *
- Антитела к гепарину (у пациентов, у которых снижается количество тромбоцитов при воздействии гепарина)
* Наличие антифосфолипидных антител (ACA) и волчаночного антикоагулянта (LA) важно при обследовании человека, у которого были повторные выкидыши и венозный или артериальный тромбоз.
Тестирование помогает определить, есть ли у пациента риск дальнейшего свертывания крови, и помогает определить соответствующий курс и продолжительность лечения для предотвращения образования тромбов в будущем. Тестирование также может помочь выявить родственников, у которых в настоящее время нет симптомов, но которые могут находиться в группе риска.
Ведение и лечение
Как лечат состояния гиперкоагуляции?
Антикоагулянты
В большинстве случаев лечение необходимо только при образовании тромба в вене или артерии.Антикоагулянты снижают способность крови к свертыванию и предотвращают образование дополнительных сгустков.
Антикоагулянтные препараты включают:
- Варфарин (кумадин) выпускается в форме таблеток и принимается перорально (внутрь).
- Гепарин — это жидкое лекарство, которое вводится либо через внутривенную (IV) линию, по которой лекарство доставляется непосредственно в вену, либо путем подкожных (под кожей) инъекций, вводимых в больнице.
- Низкомолекулярный гепарин вводится подкожно один или два раза в день и может приниматься дома.
- Фондапаринукс (Арикстра) вводится подкожно.
Вы и ваша семья будете проинструктированы о том, как принимать прописанные антикоагулянты.
Ваш врач расскажет вам о преимуществах и рисках этих лекарств. Эта информация, наряду с вашим диагнозом, поможет определить тип антикоагулянта, который вы будете принимать, как долго вам нужно будет его принимать, а также тип необходимого последующего наблюдения.
Как и в случае с любыми другими лекарствами, важно знать, как и когда принимать антикоагулянт в соответствии с рекомендациями врача, а также часто сдавать анализы крови по назначению врача.
Если вам прописали варфарин (кумадин):
- Вам нужно будет часто сдавать анализ крови, называемый PT-INR, чтобы оценить, насколько хорошо работает лекарство. Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.
- Вам следует заказать и носить медицинский браслет, удостоверяющий личность, чтобы получить надлежащую медицинскую помощь в случае возникновения чрезвычайной ситуации.
- При травме может возникнуть кровотечение или синяк. Позвоните своему врачу, если у вас сильное или необычное кровотечение или синяк.
- Некоторые лекарства, отпускаемые без рецепта (без рецепта), влияют на работу антикоагулянтов. Не принимайте никаких других лекарств, не посоветовавшись предварительно с врачом.
- Спросите своего врача о конкретных диетических рекомендациях, которые вам необходимо соблюдать при приеме варфарина. Определенные продукты, например продукты с высоким содержанием витамина К (содержатся в брюссельской капусте, шпинате и брокколи), могут изменить действие лекарства.
- Не принимайте варфарин (кумадин), если вы беременны или планируете забеременеть. Если да, спросите своего врача о переходе на другой тип антикоагулянтов. Доктора различаются по квалификации из-за разницы в обучении и опыте; больницы различаются по количеству доступных услуг. Чем сложнее ваша медицинская проблема, тем больше эти различия в качестве и тем больше они имеют значение.
Ресурсы
Лечащие врачи
Доктора различаются по качеству из-за разной подготовки и опыта; больницы различаются по количеству доступных услуг.Чем сложнее ваша медицинская проблема, тем больше эти различия в качестве и тем больше они имеют значение.
Очевидно, что врач и больница, которые вы выберете для комплексного специализированного медицинского обслуживания, будут иметь прямое влияние на то, насколько хорошо вы себя чувствуете. Чтобы помочь вам сделать этот выбор, ознакомьтесь с результатами нашего Института сердца, сосудов и торакальной системы семьи Миллер.
Cleveland Clinic Heart, Vascular & Thoracic Institute Специалисты и хирурги сосудистой медицины
Выбор врача для лечения сосудистого заболевания зависит от того, на каком этапе диагностики и лечения вы находитесь.Следующие отделения и отделения Института сердца, сосудов и торакальной хирургии лечат пациентов со всеми типами сосудистых заболеваний, включая нарушения свертываемости крови:
Секция сосудистой медицины: для оценки, лечения или интервенционных процедур для лечения сосудистых заболеваний. Кроме того, неинвазивная лаборатория включает современное компьютерное оборудование для визуализации, которое помогает диагностировать сосудистые заболевания без дополнительного дискомфорта для пациента. Позвоните на прием в сосудистую медицину, бесплатный номер 800-223-2273, добавочный номер 44420 или запишитесь на прием через Интернет.
Отделение сосудистой хирургии: хирургическая оценка хирургического лечения сосудистых заболеваний, в том числе заболеваний аорты, периферических артерий и вен. Позвоните на прием в сосудистую хирургию по бесплатному телефону 800-223-2273, добавочный 44508 или запишитесь на прием через Интернет.
Вы также можете воспользоваться нашей консультацией MyConsult о втором мнении через Интернет. Институт сердца, сосудов и грудной клетки также имеет специализированные центры и клиники для лечения определенных групп пациентов:
Узнайте больше об экспертах, специализирующихся на диагностике и лечении сосудистых и артериальных заболеваний.
Контакт
Если вам нужна дополнительная информация, нажмите здесь, чтобы связаться с нами, поговорите в чате с медсестрой или позвоните в Ресурсную и информационную медсестру Института сердечно-сосудистых заболеваний и торакальной хирургии семьи Миллер по телефону 216.

 д.), физиотерапевтических процедур;
д.), физиотерапевтических процедур;
