Гиперальдостеронизм — диагностика и лечение в Москве, цена
Гиперальдостеронизм — клинический синдром, возникающий вследствие повышенного содержания альдостерона (гормона коры надпочечников, который участвует в регуляции минерального обмена).
Различают первичный (характеризуется низкой активностью протеолитического фермента, который участвует в регуляции кровяного давления, — ренина в плазме крови) и вторичной гиперальдостеронизм (возникает как следствие повышенной активности ренина при некоторых заболеваниях).
Причины и патогенез гиперальдостеронизма
Причиной синдрома служит повышенная секреция альдостерона, которая возникает при развитии альдостеромы, альдостерономы, рака или диффузной гиперплазии коры надпочечников. При первичном гиперальдостеронизме наблюдается пониженная активность ренина.
Механизм развития заболевания связан с влиянием избыточного альдостерона на водно-электролитный баланс. Реабсорбция ионов натрия, воды в почечных канальцах, а также повышенное выведение с мочой ионов калия способствует развитию гиперволемии, понижает активность ренина, увеличению восприимчивости стенки сосуда к внешним прессорным факторам, сопротивлению периферических сосудов току крови. Это приводит к развитию гипертонии, подавлению выработки инсулина и уменьшению толерантности к глюкозе.
Симптомы гиперальдостеронизма
Главный симптом заболевания — стойкое повышенное артериальное давление.
Также пациенты жалуются на сильную жажду, обильные мочеиспускания. Для первичного гиперальдостеронизма характерны периодические приступы судорог в разных группах мышц, онемение и мышечная слабость, порой приводящая к полной обездвиженности.
Диагностика и лечение первичного гиперальдостеронизма в Клиническом госпитале на Яузе
При диагностике данного заболевания эндокринологи опираются на следующие показатели: высокое содержание альдостерона в крови и моче, пониженная активность ренина в плазме крови, низкая концентрация калия в крови, чрезмерное выведение калия с мочой.
Информативными диагностическими методами являются:
- гормональные исследования
- электрокардиография
- УЗИ почек, надпочечников
- КТ почек, надпочечников
- сцинтиграфия надпочечников
Лечение проводится под постоянным наблюдением эндокринолога с контролем показателей крови.
Консервативное лечение проводится при двусторонней гиперплазии надпочечников, метастазирующей карциноме надпочечника, альдостеронпродуцирующей глюкокортикоидподавляемой аденоме коры надпочечников, а также в качестве подготовки к оперативному вмешательству.
В ряде случаев, в том числе при злокачественном течении гиперальдостеронизма, применяется хирургическое лечение.
Стоимость услуг
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
synlab: Гиперальдостеронизм
Синдром, обусловленный гиперпродукцией альдостерона клубочковой зоной коры надпочечников, сопровождающийся артериальной гипертензией и миастенией.
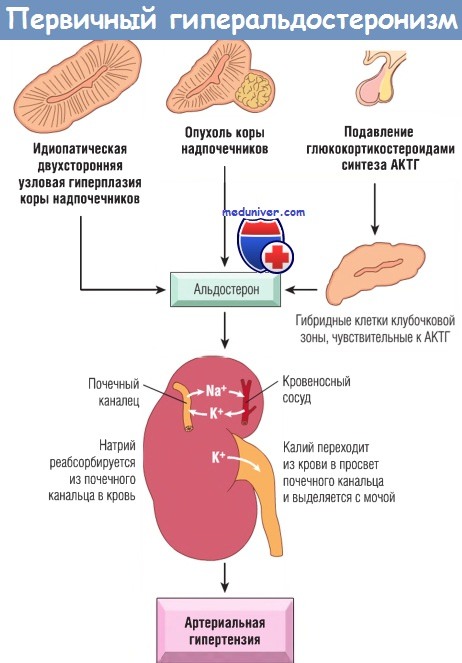
Причиной гиперальдостеронизма может быть гормонально активная аденома коры надпочечников (альдостерома), двусторонняя гиперплазия клубочковой зоны коры надпочечников, множественные микроаденомы коры надпочечников. Гиперальдостеронизм может развиваться при хронических заболеваниях почек, гипертонической болезни, при некоторых опухолях почек. Причиной гиперальдостеронизма может быть также длительное употребление лекарственных препаратов: мочегонных, слабительных, контрацептивов. Преходящее состояние гиперальдостеронизма наблюдается в период лютеиновой фазы менструального цикла, во время беременности, при ограничении натрия в диете.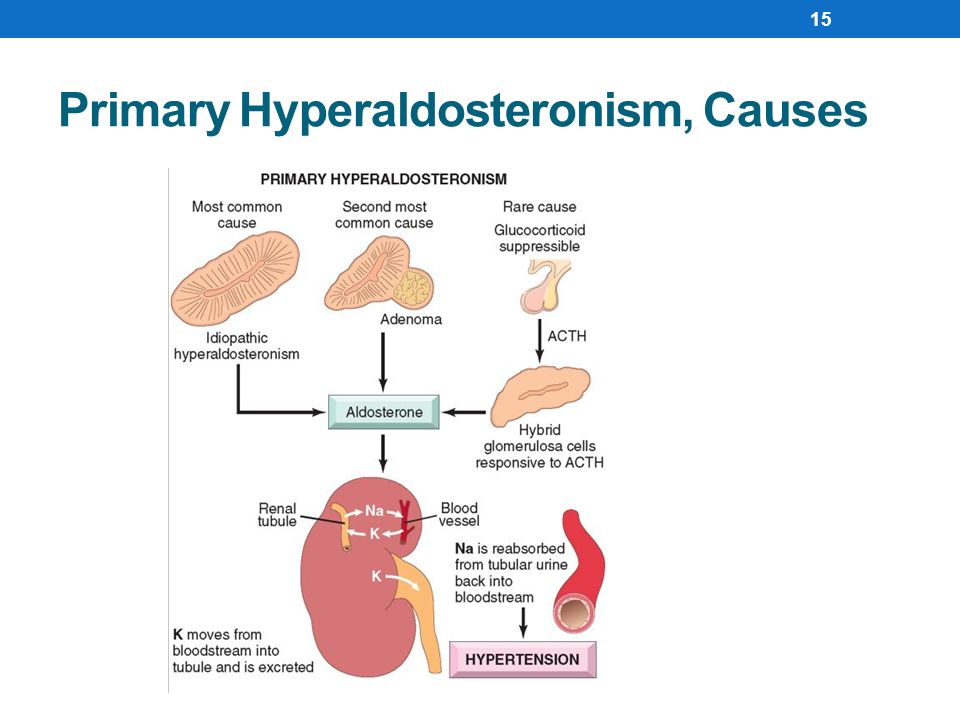
В зависимости от причины в клинической практике различаются:
1. Альдостеронизм с низкой секрецией ренина
- Первичный альдостеронизм в результате опухоли клубочкового слоя коры надпочечников (синдром Конна).
- Идиопатический гиперальдостеронизм – диффузная гиперплазия коры надпочечников.
- Дексаметазоновый гиперальдостеронизм, подавляемый глюкокортикоидами.
- Гиперальдостеронизм, вызванный эктопическими опухолями.
2. Альдостеронизм с нормальной или повышенной секрецией ренина (вторичный гиперальдостеронизм).
- Симптоматическая артериальная гипертензия при реноваскулярной патологии, заболевании почек, гипертонической болезни.
- Ренинсекретирующие опухоли (опухоль Вильмса).
- Ятрогенный и физиологический гиперальдостеронизм.
Патогенез заболевания связан с избыточной секрецией альдостерона. Основным действием альдостерона является регуляция реабсорбции натрия и экскреции калия в почечных канальцах. При гиперальдостеронизме развивается задержка ионов натрия и выведения калия, что сопровождается гиперкалиурией, гипокалиемией, гипернатриемией. В результате гипокалиемии возникает гипокалиемическая нефропатия, которая сопровождается полиурией, дистрофическими изменениями в мышцах, миокарде. Развитие гипертонии обусловлено задержкой натрия, накоплением его в стенках артерий, их набуханием, повышением тонуса и чувствительности к прессорным агентам. При наличии аденомы надпочечника синтез альдостерона автономен.
Клиническая картина. Начальным симптомом является ранняя гипертензия. Больные жалуются на головные боли, ноющие боли в области сердца. Стадия выраженной симптоматики характеризуется нарушением зрения, мышечной слабостью, судорогами, болями в мышцах. Выражены почечные симптомы: полиурия, изогипостенурия, никтурия, вторичная полидипсия. Со стороны сердечно-сосудистой системы: нарушение сердечного ритма, тахикардия, систолическая и диастолическая артериальная гипертензия.
Диагностические критерии:
- Сочетание гипертензии и миастенического синдрома.
- Гипернатриемия, гипокалиемия, гиперкалиурия.
- Полиурия, изо- и гипостенурия. Реакция мочи щелочная.
- Увеличение уровня альдостерона в плазме и его экскреция с мочой.
- Увеличение размеров надпочечников при ультразвуковой сонографии, КТ или ангиографии.
- Признаки гипокалиемии на ЭКГ.
Для уточнения диагноза проводятся функциональные пробы, пробы с верошпироном, с нагрузкой хлористым натрием, фуросемидом.
Лечение зависит от причин, обусловливающих гиперальдостеронизм. При первичном гиперальдостеронизме показано хирургическое лечение. При вторичном гиперальдостеронизме осуществляется длительное медикаментозное лечение спиронолактоном, препаратами калия, ингибиторами синтеза глюкокортикоидов. Независимо от этиологии заболевания диета должна содержать ограниченное количество поваренной соли и продукты, богатые калием (картофель, курага, рис, изюм).
Синдром первичного идиопатического гиперальдостеронизма: клиника, диагностика, лечение на примере клинических случаев | #02/06
Впервые Foley в 1955 г. предположил, что нарушение водно-электролитного баланса может быть обусловлено гормональными изменениями на фоне внутричерепной гипертензии. Это мнение было подтверждено другими авторами (M. B. A. Oldstone, 1966; M. Greer, 1964; R. D. Gordone, 1995). Однако выявить причинно-следственную связь этих нарушений не удалось.
В дальнейшем, в ходе изучения патогенеза так называемой эссенциальной гипертонии, у ряда больных был диагностирован гипоренинемический гиперальдостеронизм, а у части этих пациентов наблюдалась гипокалиемия. Процент данного типа гипертонии к настоящему времени, согласно результатам ряда исследований, достигает 20–30% (R. D. Gordone, M. Stowasser, T. Tunny et al., 1994; G. P. Ross, E. Ross, E. Pavan et al., 1998). При этом, как правило, при обследовании надпочечников выявляется двусторонняя диффузная или мелкоузелковая гиперплазия.
Однако механизм регуляции секреции альдостерона надпочечниками в подобных случаях и причины их гиперплазии оставались неясными. В то же время в литературе имеются указания на участие в синтезе и секреции альдостерона адренокортикотропного гормона (АКТГ), предсердного натрийуретического пептида, дофамина, серотонина.
Эти предположения не лишены основания, так как проопиомеланокортин (ПОМК), который предположительно синтезируется в промежуточной доле гипофиза, является предшественником АКТГ и находится под влиянием таких нейромедиаторов гипоталамуса, как дофамин и серотонин (В. М. Кеттайл, Р. А. Арки, 2001). Поэтому можно предположить, что нарушения в гипоталамо-гипофизарной системе любого генеза (инфекции, травмы и др. причины) могут изменить нормальную гормональную регуляцию различных органов и тканей-мишеней. В результате развивается соответствующая клиническая картина, которая чаще всего трактуется как гипоталамический синдром с различными метаболическими и соматическими нарушениями.
Развитие гипоталамического синдрома исследователи связывали с выявленной внутричерепной гипертензией. Однако нарушение функции клубочковой зоны коры надпочечников с патологией гипоталамических структур не рассматривалось. Патогенез развития ПИГА оставался неясным.
Впервые нами в 2002 г. была опубликована работа (З. И. Левитская, М. И. Балаболкин, 2002) с описанием истории болезни пациентки 50 лет, у которой наблюдалось развитие дексаметазонзависимого ПИГА на фоне внутричерепной гипертензии после двух перенесенных операций в детском возрасте по поводу гнойного некротического мастоидита.
В 2003 г. Weber и соавторы сообщили о двух женщинах 55 и 57 лет с длительным анамнезом заболевания, у которых ПИГА развился на фоне внутричерепной гипертензии. В обоих случаях имела место гиперплазия надпочечников. Weber и соавторы связывают патофизиологию данного заболевания с увеличением объема цереброспинальной жидкости, церебральным внутриклеточным отеком и/или увеличением внутримозгового объема крови. При этом патогенез заболевания остается под вопросом.
В 2002 г. у одной из пациенток мы, наряду с выявленными нарушениями водно-солевого обмена, обнаружили повышение в суточной моче содержания серотонина, 5-оксииндолуксусной кислоты (5-ОИУК), гистамина. Этот факт навел нас на мысль о причастности гипоталамо-гипофизарных структур к гиперплазии и гиперфункции клубочковой зоны коры надпочечников.
Синдром ПИГА диагностируется поздно, так как заболевание длительное время протекает с нерезко выраженными клиническими симптомами, такими, как «мягкая» артериальная гипертония, увеличение массы тела, задержка жидкости. Поскольку у больных имеется артериальная гипертония, то назначение мочегонных препаратов препятствует своевременной диагностике нарушения водно-солевого обмена.
Основными жалобами у этих больных являются головная боль, иногда довольно сильная, с тошнотой и рвотой, головокружение, периодически наблюдаются нарушения зрения, редко судороги с потерей сознания, иногда нарушение сердечного ритма, могут иметь место изменение поведенческих реакций и транзиторная гипергликемия.
В связи с гетерогенностью жалоб больные часто обращаются к врачам различных специальностей, не получая должной оценки клинического состояния. В лучшем случае диагностируется гипоталамический синдром с нарушением жирового обмена и проводится симптоматическая терапия, в том числе и гипотензивная. Клинический эффект, как правило, оказывается неубедительным.
В связи с вышесказанным мы приводим анализ анамнестических, клинических, лабораторных данных 11 больных (1 мужчина и 10 женщин), которые находились под нашим наблюдением. Возраст больных колебался от 21 до 65 лет. У всех больных характерными симптомами явились жалобы на головную боль различной интенсивности и продолжительности, задержку жидкости при отсутствии отеков, увеличение массы тела — от 28 до 80 кг сверх нормы в течение нескольких лет, артериальную гипертонию с повышением артериального давления — у различных пациентов от 160/90 до 300/170 мм рт. ст. У 4 больных периодически возникал судорожный синдром с кратковременной потерей сознания. Иногда судороги сопровождались рвотой. У 2 больных наблюдалась полидипсия до 5–6 л/сут при суточном диурезе 1,0–1,5 л.
Все больные задолго до развития клинической картины описываемого заболевания болели ангиной, гайморитом, отитом с развитием гнойного мастоидита либо имели черепно-мозговую травму (как правило, во время родов).
В связи с этим представляют интерес диагнозы, с которыми пациенты обратились к нам.
- Больная Г., 42 г. Диагноз: синдром «пустого турецкого седла», эпилепсия. По поводу эпилепсии длительное время лечилась у психиатра.
- Больная С., 29 лет. С 6 лет страдала артериальной гипертонией, внутричерепной гипертензией после родовой травмы.
- Больная В., 40 лет; больной Б., 40 лет. Диагноз: гипоталамический синдром пубертатного периода.
- Больная К., 66 лет. Диагноз: гипоталамический синдром с нарушением водно-солевого обмена; синдром Пархона на фоне внутричерепной гипертензии.
- Больная У., 46 лет. Диагноз: вегетососудистая дистония по гипертоническому типу.
- Больная Б., 50 лет. Диагноз: артериальная гипертония, тяжелое течение.
- Больная Г., 46 лет; больная З., 28 лет; больная Л., 30 лет. Диагноз: ожирение; артериальная гипертония.
Анализируя анамнез заболевания, жалобы и клиническую картину, мы пришли выводу, что у обследуемых больных имеется гипоталамический синдром с нарушением жирового и водно-солевого обмена. Причем нарушение водно-солевого обмена связано с вторичной гиперплазией коры надпочечников и гиперсекрецией альдостерона. Кроме того, у всех пациентов были выявлены признаки внутричерепной гипертензии — по данным рентгенологического исследования. Причинами изменений на краниограммах, скорее всего, являлись перенесенные в детстве нейроинфекции, которые осложняют течение хронических воспалительных заболеваний носоглотки, а также черепно-мозговые травмы.
Причем нарушение водно-солевого обмена связано с вторичной гиперплазией коры надпочечников и гиперсекрецией альдостерона. Кроме того, у всех пациентов были выявлены признаки внутричерепной гипертензии — по данным рентгенологического исследования. Причинами изменений на краниограммах, скорее всего, являлись перенесенные в детстве нейроинфекции, которые осложняют течение хронических воспалительных заболеваний носоглотки, а также черепно-мозговые травмы.
С целью выявления нарушения водно-электролитного баланса были рекомендованы измерение массы тела утром и вечером, контроль суточного диуреза и артериального давления в различное время суток.
Результат измерения массы тела показал, что разница между утренними и вечерними показателями составляла от 1,5 до 2,5 кг в сутки (при норме до 1,0 кг). Разница в количестве потребляемой и выделяемой жидкости колебалась от 0,5 до 2,5 л в сутки. Подъем артериального давления находился в прямой зависимости от задержки жидкости.
Мы исследовали электролиты в суточной моче и крови (натрий, калий, кальций), ренин и альдостерон крови, серотонин, 5-ОИУК и суточную экскрецию гистамина в моче.
Полученные результаты исследования показали, что у 10 больных концентрация в крови калия и натрия оставалась в пределах нормы. И только у одной больной отмечалась незначительная гипокалиемия. В суточной моче результаты были более информативны: у 2 больных экскреция натрия с мочой оказалась в норме. У 9 пациентов отмечалось снижение суточной экскреции натрия, что свидетельствовало о задержке выделения натрия из организма. В анализах 3 больных, у которых исследовалась экскреция кальция с мочой, также отмечалась его задержка.
Исследования ренина крови показало нижнюю границу нормы у 3 больных, у остальных отмечалась гипоренинемия. Концентрация альдостерона в крови у 10 из 11 была умеренно повышена. В отношении суточной экскреции альдостерона с мочой были получены следующие результаты: в 10 случаях отмечалось повышение и еще в одном — нормальная экскреция альдостерона при снижении экскреции ренина. Что касается нейромедиаторов, то у 10 больных экскреция серотонина и 5-ОИУК с мочой была повышена, и только у одной пациентки отмечалось повышение суточной экскреции 5-ОИУК при нормальной экскреции серотонина.
Что касается нейромедиаторов, то у 10 больных экскреция серотонина и 5-ОИУК с мочой была повышена, и только у одной пациентки отмечалось повышение суточной экскреции 5-ОИУК при нормальной экскреции серотонина.
Компьютерная томография надпочечников выявила наличие двусторонней гиперплазии у 6 больных.
На основании полученных результатов всем больным был поставлен диагноз ПИГА на фоне внутричерепной гипертензии.
Как уже сообщалось выше, одним из клинических вариантов ПИГА является дексаметазонзависимый гиперальдостеронизм. Возможно, данный вариант ПИГА связан с образованием ПОМК, который находится под влиянием серотонина и дофамина и одновременно является предшественником АКТГ. Кортиколиберин, стимулирующий синтез и секрецию АКТГ, из срединного возвышения выделяется одновременно с аргинин-вазопрессином и с разной степенью чувствительности подавляется глюкокортикоидами. С учетом вышесказанного для подавления секреции АКТГ при лечении больных мы использовали дексаметазон в дозе 0,25 мг на ночь. При этом учитывался не только АКТГ-подавляющий эффект препарата, но и его супрессивное влияние на серотонин и аргинин-вазопрессин.
Из 11 больных у 6 на фоне приема дексаметазона нормализовались показатели электролитного баланса, снизился уровень альдостерона и, самое главное, снизилось или нормализовалось артериальное давление. Масса тела у двух больных уменьшилась за 10 дней на 3 кг, еще одна больная за 20 дней похудела на 8 кг, другая — за 8 мес на 20 кг. Кроме того, у всех пациентов улучшилось общее состояние, исчезли судороги.
Для остальных больных подбиралась индивидуальная терапия с учетом рассмотренных выше клинико-патогенетических особенностей артериальной гипертонии данной категории больных. Предлагаемый антигипертензивный препарат должен воздействовать на ключевые патогенетические механизмы данного варианта артериальной гипертонии.
С учетом задержки натрия у наших пациентов и повышенной экскреции калия препаратом выбора является верошпирон, который обладает антиальдостероновым эффектом. Нами препарат назначался в дозе от 25 до 150 мг/сут. Иногда было достаточно только монотерапии этим препаратом (у 3 больных). В двух случаях клинически значимого эффекта удалось добиться при использовании комбинации верошпирона и дексаметазона. Больным, у которых была снижена суточная экскреция кальция с мочой, проводилось лечение антагонистами кальция (кордафлекс ретард) с хорошим эффектом.
Нами препарат назначался в дозе от 25 до 150 мг/сут. Иногда было достаточно только монотерапии этим препаратом (у 3 больных). В двух случаях клинически значимого эффекта удалось добиться при использовании комбинации верошпирона и дексаметазона. Больным, у которых была снижена суточная экскреция кальция с мочой, проводилось лечение антагонистами кальция (кордафлекс ретард) с хорошим эффектом.
Наряду с гипотензивными препаратами больным, не получавшим дексаметазон, назначался ацетазоламид (диакарб) 250 мг 2 раза в неделю. Данный препарат уменьшал внутричерепную гипертензию и положительно влиял на общее состояние пациентов.
Препараты, улучшающие функцию и метаболический фон мозга, также показаны для данной категории больных.
С учетом инсулинорезистентности возможно назначение больным с ожирением метформина (сиофор). В связи с выявлением у данной категории больных нарушений серотонинергической регуляции в гипоталамических структурах целесообразно назначение препаратов из группы сибутрамина (меридиа) в дозе от 10 до 15 мг в сутки. Фармакологическое действие данной группы препаратов заключается в ингибировании обратного захвата серотонина и норадреналина в ЦНС.
Таким образом, ПИГА представляет собой сложную цепочку нарушений синтеза и секреции альдостерона со стороны гипоталамических структур, травмированных в результате какого-либо патологического процесса (инфекция, травма). Все это приводит к нарушению обмена нейромедиаторов (В. М. Кеттайл, Р. А. Арки, 2001). Изменения нейромедиаторных взаимодействий вызывают соответствующие нарушения нейроэндокринных процессов.
Последнее обстоятельство объясняет клиническую картину, которая требует анализа причинно-следственных связей, диагностического поиска, назначения патогенетической терапии.
З. И. Левитская, кандидат медицинских наук
Е. В. Перистая
ММА им. И. М. Сеченова, Москва
М. Сеченова, Москва
Гиперальдостеронизм и методы борьбы с ним
Гиперальдостеронизм – клинический синдром, обусловленный нарушением в работе надпочечников. Они в избытке вырабатывают альдостерон, из-за чего в организме нарушается калиево-натриевый баланс. При отсутствии надлежащего лечения у больного могут развиться гипернатриемия и ряд других, не менее неприятных заболеваний. Гиперальдостеронизм подразделяют на первичный и вторичный, но поскольку второй встречается крайне редко, речь пойдет преимущественно о первом.
Классификация гиперальдостеронизма
Для успешной борьбы с любой болезнью нужно знать характерные ей особенности. В случае с гиперальдостеронизмом первым делом следует оценить, с какой разновидностью заболевания вы столкнулись. Классификаций у недуга много, однако наибольшее распространение получила та, что во главу угла ставит нозологический принцип. Согласно ей выделяют:
- Синдром Конна.
- Идиопатический гиперальдостеронизм.
- Первичную одностороннюю гиперплазию надпочечников.
- Семейный гиперальдостеронизм (первого или второго типа).
- Альдостеронпродуцирующую карциному.
- Альдостеронэктопированный синдром
Вторичный гиперальдостеронизм развивается, когда в организме наблюдается острая нехватка натрия или, напротив, переизбыток калия. Возникает он преимущественно у тех, кто страдает заболеваниями печени, почек, сердечно-сосудистой системы. Выражается это в:
- Аденомах, продуцирующих альдостерон, – результате моноклональной гиперплазии.
- Односторонней или двусторонней гиперплазии коры надпочечников.
- Семейном гиперальдостеронизме первого типа (поражающем ген CYP11β1), второго (CYP11β2) или третьего (связанного с мутацией KCNJ5).
- Поражении коры надпочечников, отвечающих за выработку альдостерона.
- Опухолях и различных злокачественных новообразованиях.

Симптоматика заболевания
Самостоятельно диагностировать гиперальдостеронизм обычному человеку практически невозможно. Крайне важно не затягивать с визитом к эндокринологу при любых недомоганиях, перечисленных ниже. Симптомы, формирующие клиническую картину первичного гиперальдостеронизма (ПГА), традиционно подразделяют на три категории.
1. Сердечно-сосудистые:
- Учащенные головные боли.
- Развитие (или обострение) артериальной гипертензии.
- Головокружение.
- Беспричинное повышение/снижение артериального давления (особенно в вечерние и ночные часы).
- Кардиалгии.
- Нарушение сердечных ритмов, аритмия.
- Повышенная утомляемость.
2. Нейромышечные:
- Мышечная слабость.
- Судороги.
- Онемение пальцев рук и ног, шеи.
- Внезапный транзиторный паралич отдельных частей тела, длительность которого варьирует от пары часов до нескольких суток.
3. Почечные:
- Полидипсия.
- Внутриклеточный ацидоз почечных канальцев и их дистрофия.
- Полиурия.
- Нарушение концентрационной функции почек.
- Никтурия.
- Увеличение размера надпочечников.
- Прирост альдостерона в плазме (оценивается при экскреции с мочой).
Диагностика гиперальдостеронизма
Чем раньше эндокринологу удастся диагностировать заболевание, тем больше шансов у пациента на успешное выздоровление. Чтобы оценить клиническую картину, необходимо выяснить этиологические причины недуга или основное заболевание, приведшее к его появлению.
Наиболее эффективными для диагностики гиперальдостеронизма сегодня называют следующие методы:
- Анализы крови.
- Селективная венография.
- Анализы мочи.
- МРТ и КТ при первичной форме заболевания / ЭКГ, УЗИ, дуплексное сканирование, УЗДГ – при вторичной.

- Сцинтиграфия.
- Ультразвуковая сонография.
Не всегда диагноз удается поставить с первого раза. Поэтому для уточнения диагноза врачи нередко назначают дополнительный забор проб. При этом используются диуретики (обычно верошпирон или фуросемид) или хлористый натрий.
Современные методы лечения
Лечение должно быть комплексным. Конкретные меры назначаются в зависимости от причин, вызвавших заболевание. При вторичном гиперальдостеронизме используется преимущественно медикаментозное лечение следующими лекарственными средствами:
- Ингибиторами синтеза глюкокортикоидов.
- Препаратами калия.
- Гормональными средствами.
- Спиронолактоном.
- Препаратами, показанными при лечении первичного недуга.
Первичный гиперальдостеронизм рекомендовано лечить хирургическим путем (резекцией пораженного надпочечника). После чего восстанавливать организм при помощи правильно подобранной медикаментозной терапии.
Также в обоих случаях пациенту показана диета. В нее входят блюда с пониженным содержанием солей и богатые калием продукты (например, рис, картофель, изюм).
Если вы обнаружили у себя первые симптомы заболевания, не стоит откладывать визит к врачу. Специалисты медицинского центра «Гармония» используют современное диагностирующее оборудование, а потому могут выявлять гиперальдостеронизм даже на ранней стадии. Запишитесь на прием, и получите результативное лечение.
Стоимость услуг
| Код | Наименование услуги | Стоимость |
|---|---|---|
| 7002 | Первичный прием врача | 1400 руб |
| 7003 | Повторный прием врача | 1200 руб |
Первичный гиперальдостеронизм под маской резистентной эссенциальной гипертензии: редкое заболевание или редкий диагноз? | Коротин А.С., Посненкова О.М., Шевченко О.
 В., Генкал Е.Н., Киселев А.Р., Попова Ю.В.
В., Генкал Е.Н., Киселев А.Р., Попова Ю.В.Симптоматическая артериальная гипертензия (АГ) составляет значительную долю вструктуре причин резистентной гипертензии [1]. Одной изчастых, норедко выявляемых причин симптоматической АГявляется первичный гиперальдостеронизм (ПГА). Вклинической практике кардиолога такой диагноз встречается нечасто, несмотря нато, что АГ— наиболее постоянный симптом ПГА, итакие пациенты, как правило, обращаются замедицинской помощью именно попричине повышения давления.
ПГА — клинический синдром, обусловленный избыточной продукцией альдостерона клубочковой зоной коркового вещества надпочечников [2]. В настоящее время выделяют несколько форм ПГА (табл. 1), среди которых чаще всего встречается изолированная односторонняя альдостерон-продуцирующая аденома надпочечника [3].
Ранее считалось, что ПГА встречается лишь у 0,05–2% лиц с АГ. Появление и внедрение в клиническую практику скрининга привели к повышению выявляемости этого состояния, и в настоящее время около 10% случаев резистентной АГ связывают с гиперальдостеронизмом. Однако систематический учет случаев ПГА в клинической практике, как правило, не ведется. Поэтому отсутствуют и актуальные отечественные данные о распространенности ПГА.
У ПГА нет специфичных симптомов, что чрезвычайно затрудняет диагностику данного состояния. Наиболее частым клиническим проявлением является АГ, которая встречается в 75–98% случаев. Группу, где наиболее вероятно выявить гиперальдостеронизм, составляют больные с дебютом АГ в молодом возрасте, пациенты с тяжелой или резистентной АГ, т. е. контингент сугубо кардиологического профиля. Вместе с тем в рекомендациях по АГ уделено мало внимания проблеме диагностики и лечения ПГА. Наиболее подробные клинические рекомендации по ПГА подготовлены Международным эндокринологическим обществом. Но даже в этом детальном клиническом руководстве отсутствуют алгоритмы динамического наблюдения за больными, в т. ч. после оперативного лечения.
ч. после оперативного лечения.
В клинической картине ПГА кроме гипертензивного также встречаются нейромышечный и дизурический синдромы. Мышечная слабость, судороги, парестезии наблюдаются у 38–75% больных. Около 50–70% пациентов отмечают полиурию, полидипсию, никтурию. По данным ряда исследований, только у 20–70% больных встречается гипокалиемия, т. е. уровень калия в крови, определение которого входит в стандарт обследования больных АГ, является недостаточно чувствительным методом и поэтому не подходит для скрининга [4]. Основной метод скрининга — определение альдостерон-ренинового соотношения (АРС). Правила подготовки к определению АРС представлены в таблице 2. Пациентам, у которых по результатам определения АРС подозревается ПГА, рекомендовано выполнить один из четырех подтверждающих тестов (табл. 3):
- с натриевой нагрузкой;
- с изотоническим раствором натрия хлорида;
- супрессивный тест с флудрокортизоном;
- с каптоприлом.
Если наличие ПГА подтверждено по данным тестирования, необходимо определить источник гиперпродукции альдостерона. Для этого может быть использовано несколько методик [5]:
- Компьютерная томография (КТ) надпочечников — позволяет определить размеры и структуру надпочечников, выявить опухоли.
- Магнитно-резонансная томография (МРТ) надпочечников — позволяет определить размеры и структуру надпочечников, но обладает несколько меньшим пространственным разрешением, чем КТ, и является более дорогим методом.
- Сравнительный селективный венозный забор крови — стандартный тест для дифференцирования одностороннего поражения от двустороннего.
- Больным с дебютом гиперальдостеронизма в возрасте до 20 лет и с отягощенным семейным анамнезом по данному заболеванию или острому нарушению мозгового кровообращения в возрасте до 40 лет предлагается генетическое тестирование на глюкокортикоид-зависимую форму ПГА.

Другие ранее применявшиеся методики — тест с постуральной нагрузкой, сцинтиграфия с йодхолестеролом, исследование 18-гидроксикортикостерона — малоэффективны в дифференциальной диагностике ПГА.
Тактика лечения зависит от морфофункционального типа заболевания. При одностороннем ПГА — односторонней надпочечниковой гиперплазии или альдостерон-продуцирующей аденоме надпочечников — оптимальным вариантом лечения является эндоскопическая адреналэктомия. После операции у 30–60% больных наблюдается стабилизация АД без дальнейшей гипотензивной терапии, у трети пациентов удается снизить количество гипотензивных препаратов.
При отказе от операции и в неоперабельных случаях следует использовать антагонисты минералокортикоидных рецепторов. Антагонисты минералокортикоидных рецепторов применяются при двусторонней гиперплазии надпочечников. Препаратом первой линии является спиронолактон, а при плохой индивидуальной переносимости или развитии побочных эффектов — эплеренон. В случаях глюкокортикоид-зависимого ПГА следует использовать минимальные титровальные дозы глюкокортикостероидов и лишь при неэффективности стероидной терапии добавить к лечению антагонисты минералокортикоидных рецепторов.
Несмотря на развитие диагностических методик и наличие клинических рекомендаций, выявление ПГА в повседневной практике кардиолога остается достаточно проблематичным. Иллюстрацией проблем диагностики является случай впервые выявленного ПГА у больной с 20-летним стажем рефрактерной АГ.
Клинический случай
Больная Л., 61 года, обратилась в специализированную кардиологическую клинику в связи с дестабилизацией АД в течение последнего месяца, выраженной слабостью, утомляемостью, снижением работоспособности.
О повышении АД пациентке известно в течение 20 лет. Она отмечает частые кризы с максимальным повышением АД до 200 и 110 мм рт. ст., которые сопровождаются ощущением общей слабости, головокружением, тяжестью в голове. Около 10 лет назад перенесла гипертонический криз, осложнившийся развитием острой гипертонической энцефалопатии с мнестическими нарушениями. В течение последних 5 лет отмечает появление одышки при физической нагрузке (подъем до 2-го этажа, ходьба в гору) и периодические отеки ног. В течение года беспокоят эпизоды неритмичного сердцебиения и перебои в работе сердца. Однократно госпитализировалась с пароксизмом фибрилляции предсердий, который зарегистрирован на электрокардиограмме (ЭКГ). В настоящее время регулярно принимает комбинацию амлодипина и валсартана 160/10 мг/сут, индапамид 1,5 мг/сут, бисопролол 2,5 мг/сут, этацизин 50 мг 3 р./сут, ацетилсалициловую кислоту (АСК) 100 мг/сут. На фоне терапии АД поддерживается на уровне 150 и 100 мм рт. ст., периодически беспокоят перебои в работе сердца.
Около 10 лет назад перенесла гипертонический криз, осложнившийся развитием острой гипертонической энцефалопатии с мнестическими нарушениями. В течение последних 5 лет отмечает появление одышки при физической нагрузке (подъем до 2-го этажа, ходьба в гору) и периодические отеки ног. В течение года беспокоят эпизоды неритмичного сердцебиения и перебои в работе сердца. Однократно госпитализировалась с пароксизмом фибрилляции предсердий, который зарегистрирован на электрокардиограмме (ЭКГ). В настоящее время регулярно принимает комбинацию амлодипина и валсартана 160/10 мг/сут, индапамид 1,5 мг/сут, бисопролол 2,5 мг/сут, этацизин 50 мг 3 р./сут, ацетилсалициловую кислоту (АСК) 100 мг/сут. На фоне терапии АД поддерживается на уровне 150 и 100 мм рт. ст., периодически беспокоят перебои в работе сердца.
Из анамнеза также известно, что пациентка страдает мочекаменной болезнью с двумя эпизодами отхождения конкремента.
Пациентка среднего телосложения. При объективном осмотре выявлено смещение левой границы сердца до срединно-ключичной линии, над аортой акцент II тона. ЧСС 72 уд./мин. Дефицита пульса нет. АД 150 и 100 мм рт. ст. Пациентка отмечает учащенное обильное мочеиспускание в ночные часы, не связанное с избыточным употреблением жидкости. Поколачивание по поясничной области безболезненное. Другие органы и системы — без особенностей.
В общем анализе крови отклонения не выявлены. В общем анализе мочи определено снижение удельного веса до 1009, при микроскопии осадка — аморфные фосфаты в значительном количестве. Остальные параметры в норме. В биохимическом анализе крови определяется дислипидемия (общий холестерин — 6,5 ммоль/л, триглицериды — 1,1 ммоль/л, ЛПНП — 4 ммоль/л, ЛПВП — 1,8 ммоль/л). При исследовании электролитов крови Na+ — 143 ммоль/л, К+ — 2,8 ммоль/л, Cl- — 98,3 ммоль/л.
На ЭКГ определяется синусовый ритм с ЧСС 60 уд./мин, электрическая ось сердца расположена нормально, частые, монотопные, мономорфные, желудочковые экстрасистолы, зубец Т сглажен, волны U в отведениях V1-V4 (рис.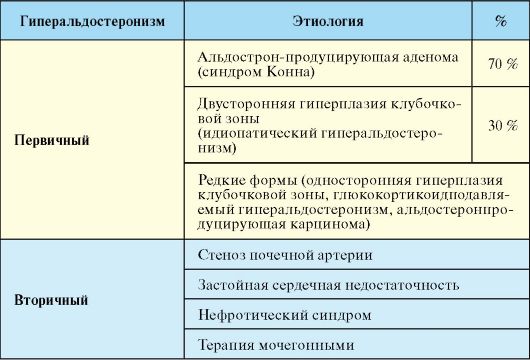 1).
1).
При холтеровском мониторировании ЭКГ: основной ритм — фибрилляция предсердий. В вечерние и дневные часы регистрировалась частая политопная желудочковая эктопическая активность.
При эхокардиографии размеры полости левого желудочка — в пределах нормы. Небольшая гипертрофия левого желудочка. Толщина миокарда в диастолу до 1,2 см. Индекс массы миокарда — 98 г/м2. Достоверных нарушений локальной сократимости левого желудочка не выявлено. Глобальная сократимость левого желудочка не снижена. Фракция выброса левого желудочка — 60%. Диастолическая функция левого желудочка нарушена по релаксационному типу. Признаков декомпенсации кровообращения по большому и малому кругу кровообращения не выявлено.
При ультразвуковом исследовании почек выявлена избыточная подвижность правой почки, область надпочечников не изменена.
С учетом рефрактерности АГ, жалоб больной на выраженную слабость и учащенное обильное мочеиспускание в ночные часы, не связанное с избыточным употреблением жидкости, лабораторных данных (гипокалиемия: К+ 2,8 ммоль/л) было высказано предположение о наличии у пациентки гиперальдостеронизма.
С учетом рекомендаций по подготовке к определению АРС в лечении были отменены все гипотензивные препараты, способные оказать влияние на результат исследования. Для контроля АД были назначены верапамил 240 мг/сут, доксазозин 4 мг/сут. Через 4 нед. у пациентки исследован уровень альдостерона и ренина крови. Получен результат: альдостерон — 370 пг/мл (норма: 13,0–145,0 пг/мл), ренин <0,50 мкМЕ/мл (норма: 4,4–46,1 мкМЕ/мл). Выполнена МРТ надпочечников, где выявлено объемное образование в правом надпочечнике размером 1,8×1,5 см. Пациентка консультирована эндокринологом и хирургом, рекомендовано оперативное лечение. Была выполнена эндоскопическая односторонняя адреналэктомия. После операции продолжен прием соталола в дозе 40 мг 2 р./сут (в связи с пароксизмальной формой фибрилляции предсердий), АСК — 75 мг/сут, аторвастатина — 20 мг/сут.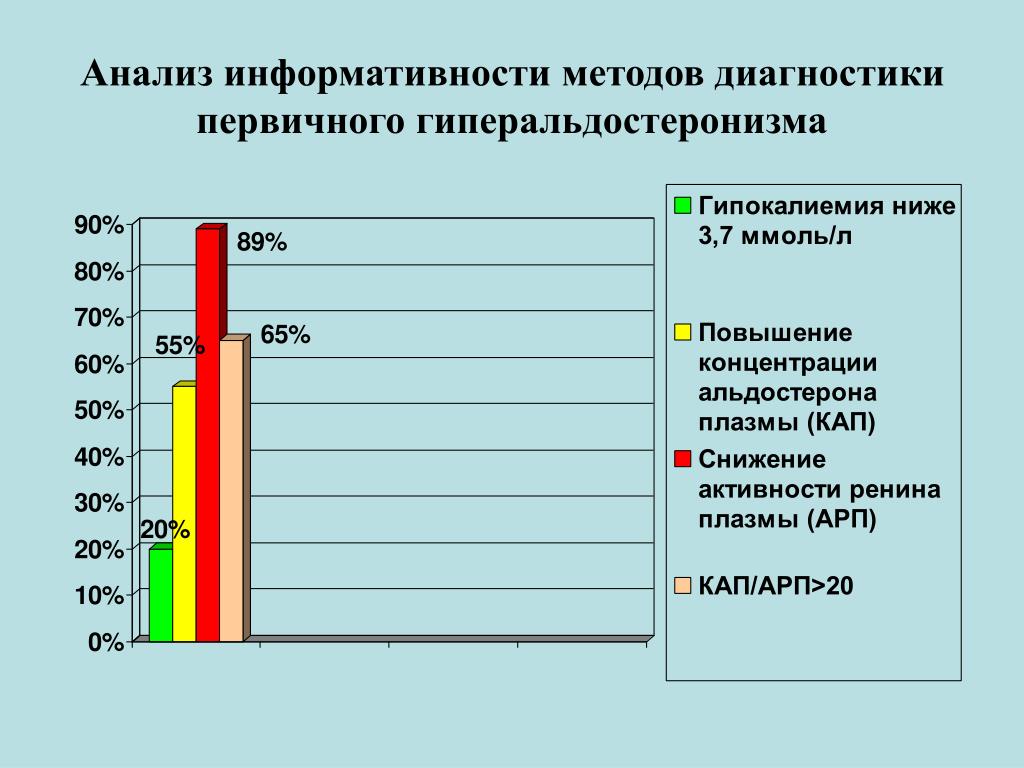 Через 1 мес. после операции выполнен суточный мониторинг АД. Выявлено повышение систолического АД в течение суток. При холтеровском мониторировании ЭКГ определяется синусовый ритм с частыми желудочковыми экстрасистолами, преимущественно в вечерние и ночные часы. К лечению добавлены валсартан 160 мг/сут и амлодипин 5 мг/сут. От приема пероральных антикоагулянтов пациентка отказалась. На фоне проводимой терапии перебои в работе сердца не беспокоят, увеличилась толерантность к физическим нагрузкам. АД стабилизировалось на уровне 130–140 и 80 мм рт. ст., показатель К+ нормализовался (К+ 5,1 ммоль/л). От повторного исследования уровня альдостерона и АРП пациентка отказалась.
Через 1 мес. после операции выполнен суточный мониторинг АД. Выявлено повышение систолического АД в течение суток. При холтеровском мониторировании ЭКГ определяется синусовый ритм с частыми желудочковыми экстрасистолами, преимущественно в вечерние и ночные часы. К лечению добавлены валсартан 160 мг/сут и амлодипин 5 мг/сут. От приема пероральных антикоагулянтов пациентка отказалась. На фоне проводимой терапии перебои в работе сердца не беспокоят, увеличилась толерантность к физическим нагрузкам. АД стабилизировалось на уровне 130–140 и 80 мм рт. ст., показатель К+ нормализовался (К+ 5,1 ммоль/л). От повторного исследования уровня альдостерона и АРП пациентка отказалась.
Обсуждение
За последние десятилетия арсенал гипотензивных препаратов значительно расширился. Но несмотря на это, у большинства больных АГ не удается достичь целевого уровня АД [6–9]. Одной из частых причин резистентной АГ является ПГА.
В 1994 г. в США были опубликованы результаты масштабного исследования, включавшего 4429 пациентов, в котором оценивали распространенность вторичных форм АГ. Распространенность вторичных форм АГ составила 10,2%, наиболее часто встречающейся формой стала АГ, связанная с патологией почек и их артерий. Следующей по значимости причиной АГ стал ПГА [10].
Похожие результаты получены в российском многоцентровом исследовании РЕГАТА. В нем приняли участие 532 больных с неконтролируемой АГ. 89,3% пациентов имели первичную резистентную АГ, вторичную АГ — 10,7% больных. При этом ПГА был выявлен у 15,8% — третий показатель среди всех причин симптоматической АГ [11].
Еще большая распространенность ПГА выявляется при скрининговом определении уровня ренина и альдостерона. В исследовании P. Mulatero et al., в котором приняли участие 5 крупных медицинских центров с 5 континентов, определение АРС в качестве скрининга привело к увеличению выявляемости ПГА в 5–15 раз в зависимости от центра [12].
Высокую распространенность ПГА показало также исследование, проведенное в Чили. У 10,3% больных с эссенциальной АГ при определении АРС выявлен ПГА. Интересно, что частота встречаемости ПГА зависела от степени повышения АД. Так, при 1-й степени АГ гиперальдостеронизм выявлен у 1,99% пациентов, а при 2-й и 3-й степени АГ — уже у 8,02% и 13,2% больных соответственно [13].
У 10,3% больных с эссенциальной АГ при определении АРС выявлен ПГА. Интересно, что частота встречаемости ПГА зависела от степени повышения АД. Так, при 1-й степени АГ гиперальдостеронизм выявлен у 1,99% пациентов, а при 2-й и 3-й степени АГ — уже у 8,02% и 13,2% больных соответственно [13].
Таким образом, реальная распространенность ПГА в России, как и во всем мире, в настоящее время недооценена, и она может оказаться значительной, учитывая широкую распространенность АГ среди населения.
В то же время, в случае своевременно и обоснованно выполненной адреналэктомии, по данным A. M. Sawka et al., у 33% больных с односторонним поражением удается достичь целевых цифр АД без приема гипотензивных препаратов [14]. Еще более оптимистичные результаты были получены в ходе наблюдения за 30 пациентами с ПГА после проведения адреналэктомии. У 29 больных из 30 нормализовался уровень калия. АГ сохранилась только у 10 из 30 пациентов, при этом у 9 из них удалось уменьшить объем медикаментозной терапии [15]. В похожем исследовании, опубликованном в 2012 г., у 68 из 124 (54,8%) пациентов после адреналэктомии АД нормализовалось, у 43 (34,4%) удалось добиться контроля АД меньшим количеством препаратов, и только у 13 (10,8%) больных сохранялась резистентная АГ [16]. В этих исследованиях было показано, что при одностороннем поражении наиболее важным предиктором положительного исхода лечения является стаж заболевания, т. е. своевременно поставленный диагноз и своевременно проведенная адреналэктомия с большой вероятностью позволяют излечить АГ, в то время как длительный стаж заболевания ассоциирован с худшим исходом оперативного лечения.
В представленном клиническом случае пациентка с ПГА длительное время наблюдалась у терапевта и кардиолога по месту жительства по поводу тяжелой АГ. Мнение о возможном ПГА возникло только после того, как врач обратил внимание на гипокалиемию и симптомы дизурии, по поводу которых сама пациентка активных жалоб не предъявляла. Больная после консультации эндокринолога была направлена к хирургу, который провел адреналэктомию. Проведенная операция не избавила больную от АГ, но позволила добиться целевых значений АД, снизить дозу гипотензивных препаратов, значительно улучшить самочувствие. Дальнейшее наблюдение за больной продолжил врач-кардиолог в связи с необходимостью контроля уровня АД.
Больная после консультации эндокринолога была направлена к хирургу, который провел адреналэктомию. Проведенная операция не избавила больную от АГ, но позволила добиться целевых значений АД, снизить дозу гипотензивных препаратов, значительно улучшить самочувствие. Дальнейшее наблюдение за больной продолжил врач-кардиолог в связи с необходимостью контроля уровня АД.
Именно врачи-кардиологи должны быть наиболее ориентированы на выявление ПГА, в особенности у пациентов с АГ 2-й и 3-й степени, резистентной АГ, с сочетанием АГ с гипокалиемией и при отягощенном семейном анамнезе. При подозрении на ПГА, в соответствии с международными рекомендациями, следует проводить скрининг с определением АРС.
При верификации диагноза ПГА врачи сталкиваются с рядом сложностей. Первой является необходимость контроля за уровнем АД у пациента с тяжелой АГ в период подготовки к определению АРС с помощью ограниченного числа препаратов, что может спровоцировать развитие сердечно-сосудистых осложнений. Вторая заключается в сложности диагностических методик, которые требуют значительных материальных затрат. Третья связана с отсутствием технической возможности проведения диагностических процедур в лечебном учреждении. Последние две ситуации, а также явная картина альдостерон-продуцирующей аденомы надпочечников приводят к необоснованному оперативному вмешательству при гормонально-неактивных аденомах надпочечников [3]. Чтобы избежать необоснованных оперативных вмешательств, а также избыточных материальных затрат в связи с дорогостоящими исследованиями, необходимо использовать единый алгоритм ведения пациента на всех этапах лечения. Международные клинические рекомендации по ПГА содержат сведения, руководствуясь которыми врач может заподозрить ПГА, провести скрининг на ранних этапах с последующими диагностическими исследованиями, обеспечить адекватное лечение. Алгоритм динамического наблюдения за больным в настоящее время отсутствует.
Заключение
В ежедневной практике врачи должны помнить о ПГА как о причине резистентной АГ. Представленный клинический случай иллюстрирует недостаточное использование методов диагностики ПГА в повседневной практике. Это приводит к постановке неверного диагноза и отсутствию адекватного лечения. Выполнение клинических рекомендаций позволит своевременно поставить диагноз и провести необходимое лечение. В подавляющем большинстве случаев это избавит пациента от АГ или смягчит ее течение, что позволит снизить риск развития сердечно-сосудистых осложнений.
Представленный клинический случай иллюстрирует недостаточное использование методов диагностики ПГА в повседневной практике. Это приводит к постановке неверного диагноза и отсутствию адекватного лечения. Выполнение клинических рекомендаций позволит своевременно поставить диагноз и провести необходимое лечение. В подавляющем большинстве случаев это избавит пациента от АГ или смягчит ее течение, что позволит снизить риск развития сердечно-сосудистых осложнений.
.
Первичный гиперальдостеронизм: диагностика и лечение | Подзолков
1. Conn J.W., Primary aldosteronism: a new clinical.syndrome. J Lab Clin Med 1955:45: 5-17.
2. Шхвацабая И.К., Чихладзе Н.М. Гиперальдостеронизм и артериальная гипертония (Диагностика и лечение). М, 1984.
3. Павленко А.К., Фадеев В.В., Мельниченко Г.А. Диагностика первичного гиперальдостеронизма. Пробл. эндокринол. 2001; (2): 15-25.
4. Шустов С.В., Баранов В.Л., Яковлев В.А., Карпов В.А. Артериальные гипертензии. СПб, 1997.
5. Fardella С.E., Mosso L., Gomez-Sanchez С. Primary hyperaldosteronism in essential hypertensives: prevalence, biochemical profile, and molecular biology. J Clin Endocrinol Metab 2000; 85:1863-7.
6. Gordon R.D., Stowasser M., Tunny T.J. et al. High incidence of primary aldosteronism in Inpatients referred with hypertension. Clin Exp Pharmacol Physiol 1994; 21: 315-8.
7. Lazurova I., Schwartz P., Trejbal D. et al. Incidence of primary hyperaldosteronism in hospitalized patients with hypertension. Bralisl Lek listy 1999; 100: 200-3.
Bralisl Lek listy 1999; 100: 200-3.
8. Lim P.O., Dow E., Brennan G. High prevalence of primary aldosteronism in the Tayside hypertension clinic population. J Hum Hypertens 2000; 14: 311-5.
9. Lim P.O., Young W.F., MacDonald T.M. A review of the medical treatment of primary aldosteronism. J Hypertens 2001; 19:363-6.
10. Ветшев П.С., Ипполитов Л.И., Соловьева Н.А. и др. Диагностика и хирургическое лечение первичного гиперальдостеронизма. Хирургия 2002; (9): 7-16.
11. Арабидзе Г.Г., Чихладзе Н.М. Апьдостерома (синдром Копна). Кардиология 1991: (12): 90-5.
12. Хирургия надпочечников / Под ред. А.П. Капинина, Н.А. Майстренко. М, 2000.
13. Ganguly A. Primary aldosteronism. New Engl J Med 1998; 339: 1828-34.
14. Gordon К.D., Stowasser M., Rutherford J.С. Primary aldosteronism: are we diagnosing and operating on too few patients? World J Surg 2001: 25: 941-7.
15. Stewart P.M. Mineralocorticoid hypertension. Lancet 1999: 353: 1341-7.
16. Лукьянчиков В.С., Калинин А.Н., Гарагезова A.Р. Адьдостеронизм. Медицинская газета, 1999.
17. Ветшев П.С., Шкроб О.С., Ипполитов Л.И., Полунин Г.В. Диагностика и хирургическое лечение артериальных гипертензий надпочечников генеза. Хирургия 2001: (1): 33-40.
18. Агаев А.В., Богатырев О.П., Гарагезова А.Р. и др. Некоторые аспекты диагностики и хирургического лечения первичного гиперальдостеронизма. Мат. конгресса «Современные аспекты хирургической эндокринологии». М, 1999; 6-8.
19. Калинин А.Н., Тишенина Р.С., Богатырев О.П. И др. Клинико-биохимические тесты в изучении отдаленных результатов хирургического лечения первичного гиперальдостеронизма и феохромоцитомы. М., 2000.
20. Маколкин В.И., Подзолков В.И., Старовойтова С.И. и др. Сложности диагностики эндокринных артериальных гипертоний. Тер. архив 1999; (10): 26-8.
21. Conn J.W., Knopf R.Е., Nesbit R.M. Clinical characteristics of primary aldosteronism from an analysis of 145 causes. Amer J Surg 1964: 107: 159-72.
22. Arganini M., Pascucci S., Cecchini M.G. et al. Primary hyperaldosteronism: our experience with 34 patients.Ann ltal Chir 1990; 61: 603-6.
23. Mosso L., Fardella С., Montero J. High prevalence of undiagnosed primary hyperaldosteronism among patients with essential hypertension. Rev Med Chil 1999; 127: 800-6.
24. Nishikawa T., Omura M. Clinical characteristics of primaiy aldosteronism: its prevalence and comparative studies on various causes of primary aldosteronism in Yokohama Rosat Hospital. Biomed Pharmacother 2000; 54:83s-85s.
25. Rayner B.L., Opie J.H., Davidson J.S. The aldosterone/renin ratio as a screening test for primary aldosteronism, S. Afr Med J 2000; 90; 394-400.
Afr Med J 2000; 90; 394-400.
26. Foo R., O’Shaughnessy K.M., Brown M.J. Hyperaldosteronism: recent concepts, diagnosis, and management. Postgrad Med J 2001; 77: 639-44.
27. Маколкин В.И., Подзолков В.И. Гипертоническая болезнь. М. 2000.
28. Carpene G., Rocco S., Opocher G., Mantero E. Acute and chronic effect of nifedipine in primary aldosteronism. Clin Exp Hypertens 1989; 11: 1263-72.
29. Nadler J.L., Hsuch W., Horton R. Therapeutic effect of calcium channel blockade in primary aldosteronism. J Clin Endocrinol Metab 1985: 60: 896-9.
30. Yokoyama T., Shimamoto K., Limura O. Mechanism of inhibition of aldosterone secretion by a Ca2+ channel blocker in patients with essential hypertension and patients with primary aldosteronism. Nippon Naibunpi Gakkai Zasshi 1995: 71: 1059-74.
31. Brown M.J., Hopper R.V. Calcium-channel blockade can mask the diagnosis of Conn’s syndrome. Postgrad Med J 1999: 75: 235-6.
32. Bursztyn M., Grossman E., Rosenthal. The absence of long-term therapeutic effect of calcium channel blockade in the primary aldosteronism of adrenal adenomas. Am J Hypertens 1988: (1): 88S-90S.
33. Stimpel M., Ivens K., Volkmann H.P. et al. Therapeutic value ofcalcium antagonists in autonomous hyperaldosteronism. Klin Wocbenschr 1989; 67; 248-52.
34. Stimpel M. , Ivens K., Wanbach G., Kaufmann W. Are calcium antagonists helpful in the management of primaiy aldosteronism? / Cardiol use Pharmacol 1988: 12: S131-S134.
, Ivens K., Wanbach G., Kaufmann W. Are calcium antagonists helpful in the management of primaiy aldosteronism? / Cardiol use Pharmacol 1988: 12: S131-S134.
35. Octkers W., Diederich S., Babr V. Primary hyperaldosteronism without sup pressed renin due to Secondary hypertensive kidney damage. J Clin Endocrinol Metab 2000; 85:3266-70.
36. Mansoor G.A. Tendler B.E., Anwar Y.A. et al. Coexistence of atherosclerotic reenal artery stenosis with primary hyperaldosteronism. J Hum Hypertens 2000: 14: 151-3.
37. Бондаренко В.О., Шапиро Н.А., Путилина О.А. и др. Сочетание альдостеромы и злокачественной феохромоцитомы в одном надпочечнике. Пробл. Эндокринол. 1998: (4): 35-7.
38. Miyazawa К., Kigoshi T., Nakano S. et at. Hypertension due to coexisting pheochromocytoma and aldosterone-producing adrenal cortical adenoma. Am J Nephrol 1998; 18: 547-50.
39. Phillips J.L., Walther M.M., Pezzullo J.C. et al. Predictive value of preoperative tests in discriminating bilateral adrenal hyperplasia from an aldosterone-producing adrenal adenoma. J Clin Endocrinol Metab 2000; 85:4526-33.
40. Ветшев П.С., Шкроб О.С., Кондрашин С.А. и др. Случайно выявленные опухоли надпочечников. Хирургическое лечение или динамическое наблюдение? Хирургия 1999; (5): 4-10.
41. Ветшев П.С., Шкроб О.С., Кузнецов Н.С. и др. Комплексное ультразвуковое исследование при хирургических заболеваниях надпочечников. Пробл. Зндокринол. 1994; (6): 34-7.
42. Ветшев П.С., Ипполитов Л.И., Лотов А.Н. и др. Инциденталомы надпочечников. Пробл. эндокринол. 1998; (5): 20-6.
Ветшев П.С., Ипполитов Л.И., Лотов А.Н. и др. Инциденталомы надпочечников. Пробл. эндокринол. 1998; (5): 20-6.
43. Шкроб О.С., Ветшев П.С., Кузнецов Н.С. Диагпостика, хирургическое лечение и прогноз при эндокринных гипертониях надпочечникового генеза. Хирургия 1996; (3): 17-23.
44. Xiao X.R. Ye L.Y., Shi L.X. et al. Diagnosis and treatment of adrenal tumours: a review of 35 years’ experience. Br J Urol 1998; 82: 199-205.
45. Young W.F. Primary aldosteronism: A common and curable form of hypertension. Cardiol Rev 1999; 7: 207-14.
46. Дедов И.И., Беленков Ю.Н., Шкроб О.С. и др. Магнитно-резонансная томография надпочечников в диагностике тотального и парциального гиперкортицизма. Пробл. зндокринол. 1989; (5): 24-7.
47. Пустовитова Т.С. Клиническое применение магнитно-резонансной томографии для оценки состояния надпочечников у больных артериальной гипертонией. Бюл. Всесоюз. кардиол. науч. центра АМН СССР. 1988; (2): 80-8.
48. Rossi G.P., Chiesura-Corona M., Tregnaghi A et al. Imaging of aldosterone-secreting adenomas: a prospective comparison of computed tomography and magnetic resonance imaging in 27 patients with suspected primary aldosteronism. J Hum Hypertens 1993; 7: 357-63.
49. Ветшев П.С., Кондрашин С.А., Миннибаев М.Т. Ангиологические методы в диагностике и хирургическом лечении заболеваний надпочечников. Пробл. Эндокринол. 1999; (6): 42-5.
50. Magill S.B., Hershel R., Shaker J.I. et al. Comparison of adrenal vein sampling and computed tomography in the differentiation of primary aldosteronism. J Clin Endocrinol Metab 2001; 86: 1066-72.
Magill S.B., Hershel R., Shaker J.I. et al. Comparison of adrenal vein sampling and computed tomography in the differentiation of primary aldosteronism. J Clin Endocrinol Metab 2001; 86: 1066-72.
51. Sheaves R., Goldin J., Reznek R.H. et al. Relative value of computed tomography scanning and venous sampling in establishing the cause of primary hyperaldosteronism. Eur J Endocrinol 1996: 134: 308-13.
52. Чихладзе И.М., Бронштейн М.Э., Казеев К.Н., Арабидзе Г.Г. Кризовое течение артериальной гипертонии у больных первичным альдостеронизмом. Кардиология 1989; (II): 95-9.
53. Чихладзе И.М., Бронштейн М.Э., Соколова Р.И., Чазова И.М. Особенности течения артериальной гипертонии у больных первичным альдостеронизмом. Ежегод. конф. общества специалистов по сердечной недостаточности «От артериальной гипертензии к сердечной недостаточности». Сб. тез. докл. М, 2001; 120-1.
54. Imai Y., Abe К., Munakata M. et al. Does ambulatory blood pressure monitoring improve the diagnosis of secondary hypertension? J Hypertens 1990; 8 (Suppl.): 71-5.
55. Mansoor G.A., White W.B. Circadian blood pressure variation in hypertensive patients with primary hyperaldosteronism. Hypertension 1998: 31: 843-7.
56. Kimura Y., Kawamura M., Onodera S., Hiramori K. Controlled study of circadian rhythm of blood pressure inpatients with aldosterone-producing adenoma compared with those with essential hypertension. J Hypertens 2000; 18: 21 -5.
57. Penzo M., Palatini P. , Rossi G.P. et al. In primary aldosteronism the circadian blood pressure rhythm is similar to that in primary hypertension. Clin Exp Hypertens 1994; 16: 659-73.
, Rossi G.P. et al. In primary aldosteronism the circadian blood pressure rhythm is similar to that in primary hypertension. Clin Exp Hypertens 1994; 16: 659-73.
58. Fratolla A., Parati G., Cuspidi С. et al. Prognostic value of 24-hour pressure variability J Hypertens 1993; 11: 1133-7.
59. Rossi G.P., Sacchetio A., Pavan E. et al. Remodeling of the left ventricle in primary aldosteronism due to Conn’s adenoma. Circulation 1997; 95: 1471-8.
60. Shigematsu Y., Homada M., Okayama H. et al. Left ventricular hypertrophy precedes other larget-organ damage in primary aldosteronism. Hypertension 1997; 29: 723-7.
61. Баранов В.Л., Кадин Д.В. Состояние миокарда у больных первичным гиперальдостеронизмом до и в различные сроки хирургического лечения. Мат. конгресса «Современные аспекты хирургической эндокринологии». М., 1999: 47-51.
62. Юренев А.Л., Devereux R.B., Гончарова Н.Л. и др. Оценка функционального состояния миокарда у бальных гипертонической болезнью и гиперальдостеронизмом. Кардиология 1997; 9: 22-5.
63. Weber К.Т., Brilla C.G. Pathological hypertrophy and cardiac inters/ilium: fibrosis and renin-angiotensin-aldosteronesystem. Circulation 1991; 83: 1849-65.
64. Young M., Fullerton M., Dilley R., Funder J. Mineralocorticoids, hypertension, and cardiac fibrosis. J Clin Invest 1994; 93: 2578-83.
65. Арабидзе Г.Г., Чихладзе И.М., Сергакова Л.М. , Яровая Е.Б. Структурное и функциональное состояние миокарда левого желудочка у больных с первичным альдостеронизмом. Тер. архив 1999: 9: 13-9.
, Яровая Е.Б. Структурное и функциональное состояние миокарда левого желудочка у больных с первичным альдостеронизмом. Тер. архив 1999: 9: 13-9.
66. Щустов С.Б., Баранов В.Л., Успенская М.К. и др. Взаимосвязь гипертрофии миокарда левого желудочка и его диастолической функции у больных симптоматическими гипертензиями эндокринного генеза. Мат. И междунар. симпоз. «Кчинич. эхокардиография»,СПб, 1996; 108-9.
67. Rossi G.P.б Sacchetto A., Visentin P. et al. Changes in left ventricular anatomy and function in hypertension and primary aldosteronism. Hypertension 1996: 27: 1039-45.
68. Фолков Б., Нил Э. Кровообращение. М, 1976.
69. Korsgaard N., Aalkjaer C., Heagerty A.M. et al. Histology of subcutaneous small resistance arteries from patients и 4th essential hypertension. Hypertension 1993: 22: 523-6.
70. Rizzoni D., Posteri E., Castellano M. et al. Vascular hypertrophy and remodeling in secondary hypertension. Hypertension 1996: 28: 785-90.
71. Калинин А.П., Полякова Г.А., Гарагезова А.Р. и др. Почки и артериальная гипертензия надпочечникового генеза. М., 2001.
72. Liu D., Zheng C., Chen Q. Factors for postoperative persistent hypertension in patients with aldosterone-producing adenoma. Chung Hua Wal Ко Tsa Chih 1997; 35: 437-9.
73. Dorairajan N., Pardhasaradhi К., Sivakumar S. et al. Surgical treatment of endocrine hypertension experience in India. J Indian Med Assoc 1999; 97: 233-6.
J Indian Med Assoc 1999; 97: 233-6.
74. Калинин А.П., Полякова Г.А., Гарагезова А.Р., Безуглова Т.В. Изучение биоптата почек при первичном гиперальдостеронизме. Мат. IV Росс. конгресса эндокринологов. Сб. тез. докл. СПб, 2001; 494.
75. Ветшев П.С., Ипполитов Л.И., Габаидзе Д.И. Эндоскопическая адреналэктомия: Обзор. Пробл эндокринол. 1998; 3; 49-53.
76. Калинин А.П., Полякова Г.А., Гарагезова А.Р., Лукъянчиков В.С. Современные аспекты альдостеронизма. Мат. конгресса «Современные аспекты хирургический эндокринологии». М., 1999; 156-60.
77. Rutherford J.C., Taylor W.L., Stowasser M., Gordon R.D. Success of surgery for primary aldosteronism judged by residual autonomous aldosterone production. World J Surg 1998: 22: 1243-5.
78. Bravo E.L., Fouad F.M., Tarazi R.C. Calcium channel blockade with nifedipine in primary aldosteronism. Hypertension 1986: 8 (Suppl. 1): 1191-1194.
79. Эндокринология / Под ред. Н. Лавина. М., 1999.
80. Blumenfeld J.D., Vaughan E.D. Diagnosis and treatment of primary aldosteronism. World J Urol 1999; 17: 15-21.
81. Cook M.D., Phillips M.L., Cook V.I. et al. Angiotensin II receptor suptipes on adrenal adenoma in primary hyperaldosteronism. J Am Soc Nephrol 4: 111-6.
82. Gruffing G.T., Melby J.C. The therapeutic effect of a new angiotensin-converting enzyme inhibitor, enalapril maleate, in idiopathic hyperaldosteronism. J Clin Hypertens 1985: 3: 265-76.
J Clin Hypertens 1985: 3: 265-76.
83. Stokes G.S., Monaghan J.C., Ryan M., Woodward M Efficacy of an angiotensin II receptor antagonist in managing hyperaldosteronism. J Hypertens 2001; 19: 1161-5.
84. Proye C.A., Mulliez E.A., Carnaille B.M. et al. Essential hypertension; first reason for persistent hypertension after unilateral adrenalectomy for primary aldosteronism. Surgery 1998; 124: 1128-33.
85. Sapienza P., Cavallaro A. Persistent hypertension after removal of adrenal tumours. Eur J Surg 1999: 165: 187-92.
86. Fronticelli C.M., Ferrero A., Quiriconi F. et al. Primary hyperaldosteronism. Analysis of risk factors associated with persistent postoperative hypertension. Int Surg 1995: 80: 175-7.
87. Simon D., Gorelzki P.E., Lottern A., Rober H.D. Persistent hypertension after successful adrenal operation. Surgery 1993: 114: 1189-95.
88. Пальцев M.А., Ветшев П.С., Кузнецов Н.С. и др. Клинико-морфологический анализ надпочечников. Хирургия 1997; 7: 22-8.
89. Ohara T., Ito Y., Okamoto T. et al. Risk factors associated with postoperative persistent hypertension in patients with primary aldosteronism. Surgery 1992: 112: 987-93.
Альдостерон-рениновое соотношение (альдостерон, ренин, соотношение)
Метод определения №205 «Альдостерон» и №206 «Ренин (прямой метод)» – см. описания соответствующих тестов, АРС – расчет.
Исследуемый материал Плазма крови (ЭДТА)
Используется в целях скрининга и диагностики первичного гиперальдостеронизма.
Состав профиля:- альдостерон, плазма;
- ренин, плазма;
- альдостерон-рениновое соотношение (расчет).
Первичный гиперальдостеронизм – собирательный диагноз, характеризующий состояния с повышенным уровнем альдостерона, секреция которого относительно независима от ренин-ангиотензиновой системы и натриевой нагрузки. Повышение уровня альдостерона является причиной артериальной гипертензии, сердечно-сосудистых расстройств, задержки натрия и ускоренного выделения калия (что приводит к гипокалиемии). Причиной первичного гиперальдостеронизма могут быть аденома надпочечника, односторонняя или двусторонняя надпочечниковая гиперплазия, в редких случаях – наследственно обусловленный гиперальдостеронизм.
Ранее предполагалось, что частота встречаемости первичного гиперальдостеронизма составляет менее 1% пациентов с эссенциальной гипертензией, и считалось, что гипокалиемия является обязательным критерием этого диагноза. Данные, накопленные к настоящему времени, привели к пересмотру этих представлений. Исследования показали, что первичный гиперальдостеронизм отмечается более чем у 10% пациентов с артериальной гипертензией, являющейся наиболее частым и общим проявлением данной патологии, а гипокалиемия обнаруживается при тяжелом течении заболевания (концентрации калия в сыворотке крови менее 3,5 ммоль/л определяется у половины больных с альдостерон-продуцирующей аденомой и у 17% пациентов с идиопатическим гиперальдостеронизмом).
Диагностика первичного гиперальдостеронизма имеет большое значение, как из-за его распространенности, так и в связи с более высокой частотой сердечно-сосудистых поражений по сравнению с эссенциальной артериальной гипертензией (при аналогичной степени повышения артериального давления). Своевременный диагноз позволяет применить адекватное лечение и улучшить качество жизни пациента.
Своевременный диагноз позволяет применить адекватное лечение и улучшить качество жизни пациента.
В настоящее время экспертами рекомендован трехступенчатый подход к диагностике первичного гиперальдостеронизма (скрининг, подтверждение диагноза, определение специфического подтипа патологии). Для первичного гиперальдостеронизма характерно высокое содержание альдостерона в крови при низком уровне ренина. Но показатели распределения альдостерона и ренина в нормальной популяции и группах пациентов с эссенциальной гипертензией или первичным гиперальдостеронизмом в значительной степени перекрываются. Поэтому в качестве начального скринингового исследования рекомендовано определение альдостерон-ренинового соотношения (АРС). Диагностическая информативность АРС превосходит информативность отдельно применяемых показателей – уровней альдостерона, калия (оба теста характеризуются низкой чувствительностью при скрининге), ренина (низкая специфичность).
Отрицательный результат скрининговой оценки АРС свидетельствует об отсутствии первичного гиперальдостеронизма. При получении положительного результата по АРС рекомендовано проведение одного из подтверждающих тестов. В подтверждающем тесте с солевой нагрузкой в виде инфузии физиологического раствора уровень альдостерона после инфузии менее 50 пг/мл свидетельствует о низкой вероятности первичного гиперальдостеронизма, уровень альдостерона более 100 пг/мл – о высокой вероятности этого диагноза (подробнее о вариантах подтверждающих тестов см. «Клинические рекомендации по материалам консенсуса по первичному гиперальдостеронизму».Кроме увеличенного значения альдостерон-ренинового соотношения, некоторые эксперты рассматривают в качестве дополнительного критерия обязательное наличие достаточно высокого уровня альдостерона (>150 пг/мл). Другие специалисты считают, что следует избегать формального значения границы нормы для альдостерона, но необходимо учитывать, что существует повышенная вероятность ложноположительного результата альдостерон-ренинового соотношения при низком уровне ренина.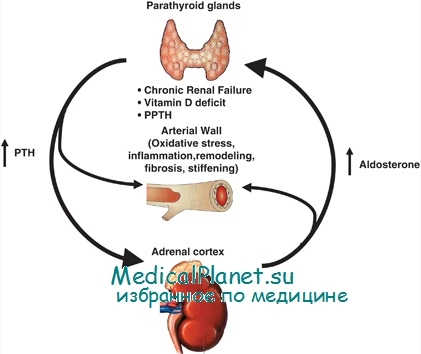 Таким образом, не существует жестких указаний по диагностическому значению АРС. Важно понимать все относительные преимущества и недостатки методики, принимать во внимание влияющие на результат АРС факторы для корректной индивидуальной интерпретации данных.
Таким образом, не существует жестких указаний по диагностическому значению АРС. Важно понимать все относительные преимущества и недостатки методики, принимать во внимание влияющие на результат АРС факторы для корректной индивидуальной интерпретации данных.
Исследование АРС на фоне приема некоторых лекарственных препаратов или несоблюдение правил взятия крови могут исказить результаты. Поэтому его следует проводить после соответствующей подготовки (см. ниже). При интерпретации результатов следует учитывать, что, как и для других биохимических тестов, в этом исследовании возможно получение ложноположительных или ложноотрицательных результатов. В случае сомнения в правильности результата исследование необходимо повторить. Влияние приема лекарств и других условий – см. табл. в разделе «Интерпретация».
Литература
- Клинические рекомендации по материалам консенсуса по первичному гиперальдостеронизму. Российская ассоциация эндокринологов, ФГБУ ЭНЦ МЗ России. 2008. http://www.endocrincentr.ru/images/material-images/2008(1).pdf.
- Funder J.W., Carey R.M., Fardella C., Gomez-Sanchez C.E., Mantero F., Stowasser M., Young W.F. Jr., Montori V.M. Case detection, diagnosis, and treatment of patients with primary aldosteronism: An endocrine society clinical practice guideline. Journal of Clinical Endocrinology and Metabolism. 2008;93(9):3266-3281.
- Материалы фирмы DiaSorin.
Первичный гиперальдостеронизм (синдром Конна) | Отделение хирургии Колумбийского университета
Альдостерон помогает контролировать кровяное давление, удерживая соль и теряя калий из крови. Повышенное содержание соли повышает кровяное давление. Гиперальдостеронизм — это заболевание, при котором надпочечники вырабатывают слишком много альдостерона, что приводит к гипертонии ( высокое кровяное давление ) и низкому уровню калия в крови.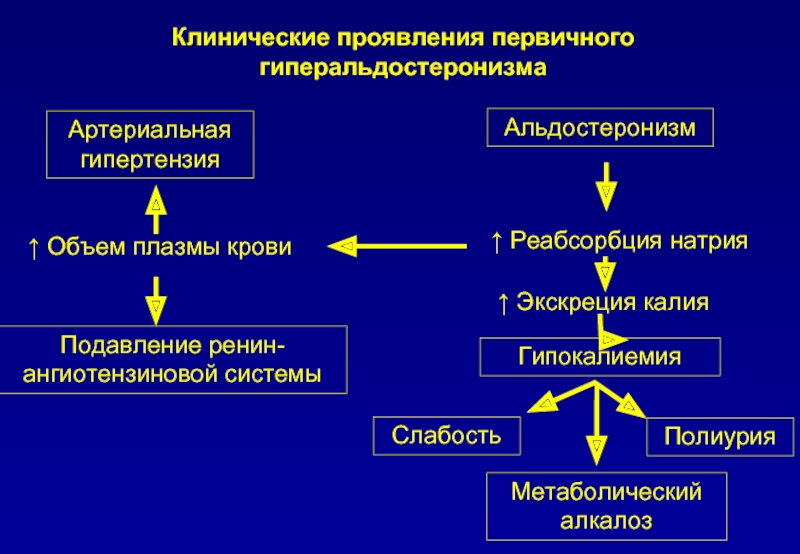
Первичный гиперальдостеронизм может быть вызван гиперактивностью одного надпочечника (одностороннее заболевание) или обоих (двустороннее заболевание). Одностороннее заболевание обычно вызывается аденомой (доброкачественной опухолью), продуцирующей альдостерон, и реже раком надпочечников или гиперплазией (когда вся железа гиперактивна). Двустороннее заболевание обычно вызывается двусторонней гиперплазией (когда обе железы гиперактивны). Есть редкие генетические синдромы, такие как семейный гиперальдостеронизм I и II типов, которые могут вызывать гиперактивность обеих желез.
Признаки и симптомы
Высокое кровяное давление часто является единственным признаком гиперальдостеронизма . Гипертонию обычно трудно контролировать, и пациенты часто принимают 4 или более лекарств от кровяного давления. Гипертония может вызвать головные боли, помутнение зрения и головокружение. В то время как пациенты с гиперальдостеронизмом могут иметь нормальный уровень калия, многие пациенты могут иметь низкий уровень калия. Гипокалиемия (низкий уровень калия) может вызывать такие симптомы, как усталость, онемение, учащенное мочеиспускание, повышенная жажда, мышечные судороги и мышечная слабость.Гиперальдостеронизм приводит к повышенному риску сердечных приступов, сердечной недостаточности, инсультов, почечной недостаточности и ранней смерти.
Диагностика
Первичный гиперальдостеронизм диагностируется путем измерения уровня альдостерона и ренина (гормона, вырабатываемого почками) в крови. Чтобы лучше всего измерить эти гормоны, образцы крови следует брать утром. При первичном гиперальдостеронизме уровень альдостерона будет высоким, а уровень ренина будет низким или неопределяемым. Уровень калия может быть низким или нормальным.Если эти тесты положительны, пациенты могут пройти еще один тест для подтверждения диагноза. Эти тесты пытаются снизить количество вырабатываемого альдостерона, давая лекарство или добавляя соль с пищей или внутривенным введением жидкости. Если после этих тестов уровень альдостерона высокий, а уровень ренина низкий, диагноз подтверждается. Некоторые лекарства, особенно лекарства от артериального давления, могут помешать этим тестам. Ваш врач рассмотрит ваши лекарства и решит, нужно ли их прекратить за 4-6 недель до тестирования.Как правило, пациенты с давней историей гипертонии или трудно контролируемой гипертонией должны быть обследованы на предмет гиперальдостеронизма.
Если после этих тестов уровень альдостерона высокий, а уровень ренина низкий, диагноз подтверждается. Некоторые лекарства, особенно лекарства от артериального давления, могут помешать этим тестам. Ваш врач рассмотрит ваши лекарства и решит, нужно ли их прекратить за 4-6 недель до тестирования.Как правило, пациенты с давней историей гипертонии или трудно контролируемой гипертонией должны быть обследованы на предмет гиперальдостеронизма.
Соотношение PAC: PRA
Этот анализ крови — это скрининговый тест, то есть его проводят, если есть подозрение на гиперальдостеронизм, но еще не диагностировано. Высокое соотношение PAC и PRA предполагает первичный гиперальдостеронизм, но для подтверждения диагноза может потребоваться дополнительное тестирование.
Тест подавления каптоприла
Этот анализ крови измеряет реакцию организма на каптоприл, лекарство, используемое для лечения высокого кровяного давления.Результаты этого теста могут подтвердить, есть ли у человека первичный гиперальдостеронизм.
Тест на суточную экскрецию альдостерона с мочой
Пациенты придерживаются высокосолевой диеты в течение пяти дней, а затем сдают анализов мочи в течение 24 часов. Если уровень альдостерона в моче высок, такие результаты могут подтвердить, что у пациента первичный гиперальдостеронизм.
Испытание на подавление солевого раствора
В этом тесте пациент получает раствор соли через капельницу .Затем анализ крови измеряет у пациента уровни альдостерона и ренина. Первичный гиперальдостеронизм может быть подтвержден, если уровень альдостерона в крови остается высоким, а ренин — низким после этой солевой нагрузки.
Локализация
Для пациентов с доказанным первичным гиперальдостеронизмом следующим шагом является выяснение, является ли это односторонним или двусторонним заболеванием. Это очень важно, потому что лечение для каждого разное. Компьютерная томография (КТ или КТ) или магнитно-резонансная томография (МРТ) будут выполнены, чтобы увидеть, есть ли опухоль в любом надпочечнике.Если пациенту моложе 40 лет и опухоль есть только в одном надпочечнике (особенно если он составляет от 1 до 2 см), то пациент может сразу обратиться к лечению. Если пациенту больше 40 лет и / или опухоли в обоих надпочечниках не обнаружены, то пациенту будет проведен специальный тест, называемый селективным отбором венозных проб. В этом тесте хирург или радиолог возьмет кровь непосредственно из вен, дренирующих оба надпочечника, чтобы определить, вырабатывают ли один или оба гормона слишком много гормона.Значительно более высокий уровень гормонов с одной стороны только подтверждает диагноз одностороннего заболевания. Выборочный забор венозной крови обычно проводится амбулаторно.
Это очень важно, потому что лечение для каждого разное. Компьютерная томография (КТ или КТ) или магнитно-резонансная томография (МРТ) будут выполнены, чтобы увидеть, есть ли опухоль в любом надпочечнике.Если пациенту моложе 40 лет и опухоль есть только в одном надпочечнике (особенно если он составляет от 1 до 2 см), то пациент может сразу обратиться к лечению. Если пациенту больше 40 лет и / или опухоли в обоих надпочечниках не обнаружены, то пациенту будет проведен специальный тест, называемый селективным отбором венозных проб. В этом тесте хирург или радиолог возьмет кровь непосредственно из вен, дренирующих оба надпочечника, чтобы определить, вырабатывают ли один или оба гормона слишком много гормона.Значительно более высокий уровень гормонов с одной стороны только подтверждает диагноз одностороннего заболевания. Выборочный забор венозной крови обычно проводится амбулаторно.
Лечение
Лечение гиперальдостеронизма зависит от основной причины. У пациентов с единственной доброкачественной опухолью ( аденома, ) хирургическое удаление ( адреналэктомия, ) является лечебным. Эта операция обычно выполняется лапароскопически через несколько очень маленьких разрезов.(См. Хирургия надпочечников). После успешной адреналэктомии примерно 95% пациентов замечают значительное улучшение гипертонии. Из этих 95% одна треть излечивается от высокого кровяного давления, а остальные принимают меньшее количество лекарств или более низкие дозы. Для пациентов с двусторонней гиперплазией лучшее лечение — это лекарство, называемое антагонистом альдостерона (спиронолактон, эплеренон), которое блокирует действие альдостерона. Кроме того, пациенты придерживаются диеты с низким содержанием соли.
Без надлежащего лечения пациенты с гиперальдостеронизмом часто страдают от плохо контролируемого высокого кровяного давления и имеют повышенный риск сердечных приступов, сердечной недостаточности, инсультов, почечной недостаточности и ранней смерти. Однако при соответствующем лечении это заболевание поддается лечению и имеет отличный прогноз. Пациенты с трудно контролируемой или длительно существующей артериальной гипертензией должны быть обследованы на первичный гиперальдостеронизм.
Однако при соответствующем лечении это заболевание поддается лечению и имеет отличный прогноз. Пациенты с трудно контролируемой или длительно существующей артериальной гипертензией должны быть обследованы на первичный гиперальдостеронизм.
Следующие шаги
Если вы имеете дело с проблемой надпочечников, наша команда в Колумбийском адреналинном центре всегда готова помочь. Позвоните по телефону (212) 305-0444 или запишитесь на прием онлайн.
Первичный альдостеронизм — Диагностика и лечение
Диагноз
Если ваш врач подозревает первичный альдостеронизм, вам, скорее всего, придется пройти тест для измерения уровней альдостерона и ренина в крови.Ренин — это фермент, выделяемый почками, который помогает контролировать кровяное давление. Если у вас очень низкий уровень ренина и высокий уровень альдостерона, возможно, у вас первичный альдостеронизм.
Дополнительные тесты
Если тест на альдостерон-ренин предполагает первичный альдостеронизм, вам потребуются другие тесты для подтверждения диагноза и поиска потенциальных причин. Возможные тесты включают:
- Испытание на загрузку соли. Есть несколько способов сделать этот анализ крови или мочи.Вы можете придерживаться диеты с высоким содержанием натрия в течение нескольких дней или принимать физиологический раствор в течение нескольких часов, прежде чем врач измерит уровень альдостерона. Вам также могут назначить флудрокортизон — препарат, имитирующий действие альдостерона — в дополнение к диете с высоким содержанием натрия перед тестом.
- Брюшная полость КТ . Сканер CT может обнаружить опухоль на надпочечнике или увеличить надпочечник, что свидетельствует о его сверхактивности.
Анализ крови по надпочечниковой вене.
 Радиолог берет кровь из правой и левой надпочечников и сравнивает эти два образца. Если уровень альдостерона повышен только на одной стороне, врач может заподозрить рост надпочечника.
Радиолог берет кровь из правой и левой надпочечников и сравнивает эти два образца. Если уровень альдостерона повышен только на одной стороне, врач может заподозрить рост надпочечника.Этот тест включает в себя введение трубки в вену в паху и продвижение ее до вен надпочечников. Хотя этот тест необходим для определения правильного лечения, он несет в себе риск кровотечения или образования тромба в вене.
Лечение
Лечение первичного альдостеронизма зависит от основной причины.Основная цель — вернуть уровень альдостерона к норме или заблокировать эффект высокого альдостерона для предотвращения осложнений.
Лечение опухоли надпочечника
Опухоль надпочечника можно лечить с помощью хирургического вмешательства или приема лекарств и изменения образа жизни.
Удаление железы хирургическим путем. Обычно рекомендуется хирургическое удаление надпочечника с опухолью (адреналэктомия). Хирургическое удаление может привести к нормализации артериального давления, калия и альдостерона.Ваш врач будет внимательно следить за вами после операции и постепенно корректировать или отменять лекарства от высокого кровяного давления.
Риск хирургического вмешательства включает кровотечение и инфекцию. Замещение гормона надпочечников не требуется, потому что другой надпочечник может вырабатывать достаточно всех гормонов, необходимых вашему организму.
- Препараты, блокирующие альдостерон. Если ваш первичный альдостеронизм вызван доброкачественной опухолью и вы не можете делать операцию или предпочитаете ее не делать, вас можно лечить с помощью препаратов, блокирующих альдостерон, называемых антагонистами минералокортикоидных рецепторов (спиронолактон и эплеренон), и изменить образ жизни.Высокое кровяное давление и низкий уровень калия вернутся, если вы перестанете принимать лекарства.

Лечение гиперактивности обоих надпочечников
Комбинация лекарств и изменения образа жизни могут эффективно лечить первичный альдостеронизм, вызванный гиперактивностью обоих надпочечников.
Лекарства. Антагонисты рецепторов минералокортикоидов блокируют действие альдостерона в организме. Ваш врач может сначала назначить спиронолактон (альдактон).Это лекарство помогает снизить высокое кровяное давление и низкий уровень калия, но может вызвать другие проблемы.
Помимо блокирования рецепторов альдостерона, спиронолактон может подавлять действие других гормонов. Побочные эффекты могут включать увеличение мужской груди (гинекомастию) и нарушения менструального цикла у женщин.
Более новый и более дорогой антагонист минералокортикоидных рецепторов под названием эплеренон (Inspra) устраняет побочные эффекты половых гормонов, связанные со спиронолактоном.Ваш врач может порекомендовать эплеренон, если у вас есть серьезные побочные эффекты спиронолактона. Вам также могут потребоваться другие лекарства от высокого кровяного давления.
- Изменение образа жизни. Лекарства от высокого кровяного давления более эффективны в сочетании со здоровым питанием и образом жизни. Вместе с врачом составьте план по снижению содержания натрия в рационе и поддержанию здорового веса тела. Регулярные упражнения, ограничение употребления алкоголя и отказ от курения также могут улучшить вашу реакцию на лекарства.
Образ жизни и домашние средства
Здоровый образ жизни необходим для поддержания низкого артериального давления и сохранения здоровья сердца в долгосрочной перспективе. Вот несколько советов по здоровому образу жизни:
- Соблюдайте здоровую диету. Диеты, в которых особое внимание уделяется разнообразным здоровым продуктам, включая злаки, фрукты, овощи и нежирные молочные продукты, могут помочь с потерей веса и помочь снизить кровяное давление.
 Попробуйте диетические подходы к борьбе с гипертонией (DASH) — она доказала свою пользу для вашего сердца. Здоровая диета также ограничивает потребление натрия, добавленного сахара, насыщенных жиров и алкоголя.
Попробуйте диетические подходы к борьбе с гипертонией (DASH) — она доказала свою пользу для вашего сердца. Здоровая диета также ограничивает потребление натрия, добавленного сахара, насыщенных жиров и алкоголя. - Добейтесь здорового веса. Если ваш индекс массы тела (ИМТ) составляет 25 или более, потеря всего лишь от 3% до 5% массы тела может снизить кровяное давление.
- Упражнение. Регулярные аэробные упражнения помогают снизить кровяное давление. Вам не обязательно ходить в тренажерный зал — 30-минутная прогулка в умеренном темпе в большинство дней недели может улучшить ваше здоровье.Попробуйте прогуляться с другом за обедом, а не ужинать вне дома.
- Не курите. Отказ от курения улучшает общее состояние здоровья сердца и кровеносных сосудов. Поговорите со своим врачом о лекарствах, которые помогут вам бросить курить.
Подготовка к приему
Поскольку симптомы первичного альдостеронизма не всегда очевидны, ваш врач может посоветовать вам пройти обследование на это заболевание. Ваш врач может заподозрить первичный альдостеронизм, если у вас высокое кровяное давление и:
- Ваше артериальное давление остается постоянно высоким, особенно если вы уже принимаете как минимум три лекарства от него (резистентная гипертензия)
- У вас низкий уровень калия в крови — хотя у многих людей с первичным альдостеронизмом уровень калия нормальный, особенно на ранних стадиях заболевания
- У вас опухоль на одном из надпочечников, обнаруженная при визуализации по другой причине
- У вас в личном или семейном анамнезе было высокое кровяное давление или инсульт в молодом возрасте
- У вас также синдром обструктивного апноэ сна
Скрининговый тест на первичный альдостеронизм может потребовать некоторого планирования.Тест можно проводить, пока вы принимаете большинство лекарств от кровяного давления, но вам может потребоваться прекратить прием некоторых лекарств, таких как спиронолактон (альдактон) и эплеренон (Inspra), не позднее чем за четыре недели до тестирования. Ваш врач может также попросить вас избегать настоящих продуктов солодки за пару недель до теста, так как они могут вызвать изменения, имитирующие избыток альдостерона.
Ваш врач может также попросить вас избегать настоящих продуктов солодки за пару недель до теста, так как они могут вызвать изменения, имитирующие избыток альдостерона.
После тестирования вы обратитесь к врачу для повторного осмотра, или вас могут направить к врачу, занимающемуся лечением гормональных нарушений (эндокринологу).Вот некоторая информация, которая поможет вам подготовиться к встрече.
Что вы можете сделать
При записи на прием составьте список из:
- Ваши симптомы, включая те, которые кажутся не связанными с причиной вашего приема
- Ключевая личная информация, , включая серьезные стрессы, недавние изменения в жизни и семейный анамнез
- Все лекарства, витамины или другие добавки , которые вы принимаете, включая дозы
- Вопросы, которые следует задать своему врачу
При первичном альдостеронизме вам нужно задать врачу следующие основные вопросы:
- Что означают мои результаты теста?
- Нужны ли мне дополнительные тесты?
- Мое состояние временное или всегда будет?
- Какие методы лечения доступны? Как вы думаете, что будет лучше в моем случае?
- У меня другие проблемы со здоровьем.Как мне лучше всего управлять ими вместе?
- Есть ли какие-либо диетические ограничения, которые мне нужно соблюдать?
- Могу ли я получить брошюры или другие печатные материалы? Какие сайты вы рекомендуете?
Чего ожидать от врача
Ваш врач, вероятно, задаст вам несколько вопросов, включая:
- Кажется, что-нибудь улучшает ваши симптомы?
- Что может ухудшить ваши симптомы?
Октябрь09, 2019
Гиперальдостеронизм
Обзор
НадпочечникиЧто такое гиперальдостеронизм?
Гиперальдостеронизм — это состояние, при котором один или оба надпочечника вырабатывают слишком много гормона альдостерона. Альдостерон — это гормон (вещество, вырабатываемое организмом), который помогает контролировать уровень калия и натрия в крови.
Альдостерон — это гормон (вещество, вырабатываемое организмом), который помогает контролировать уровень калия и натрия в крови.
Надпочечники являются частью эндокринной системы. Они производят гормоны, необходимые организму для выполнения повседневных функций, включая тестостерон, альдостерон и адреналин. Надпочечники расположены над каждой почкой и размером примерно с ваш большой палец.
Симптомы и причины
Что вызывает гиперальдостеронизм?
Гиперальдостеронизм может быть вызван доброкачественной (доброкачественной) опухолью надпочечника.Еще одна возможная причина гиперальдостеронизма — гиперплазия (повышенная активность) надпочечников. В некоторых случаях гиперальдостеронизм является наследственным заболеванием.
Каковы симптомы гиперальдостеронизма?
Гиперальдостеронизм может снизить уровень калия в организме, что может вызвать следующие симптомы:
Диагностика и тесты
Когда подозревается гиперальдостеронизм?
Наибольшему риску гиперальдостеронизма подвержены люди с гипертонией (высоким кровяным давлением), которую трудно контролировать, даже если пациент принимает несколько лекарств одновременно.Гиперальдостеронизм также чаще встречается у людей, которые:
Как диагностируется гиперальдостеронизм?
Если ваш врач считает, что у вас может быть гиперальдостеронизм, он или она назначит анализ крови, чтобы проверить уровни альдостерона и ренина (белка, который выделяется почками и помогает поддерживать уровень артериального давления в пределах нормы). Если уровень альдостерона высокий, а уровень ренина низкий, врач назначит другие анализы или направит вас к специалисту. Например, врач может назначить компьютерную томографию (КТ), чтобы увидеть, есть ли опухоль на надпочечнике.
Например, врач может назначить компьютерную томографию (КТ), чтобы увидеть, есть ли опухоль на надпочечнике.
Чтобы проверить гиперплазию (гиперактивность) надпочечников, врач может назначить анализ, при котором пробы крови берутся непосредственно из обоих надпочечников. Если в одной железе повышен уровень альдостерона, скорее всего, причиной является опухоль; если в обеих железах высокий уровень альдостерона, то, вероятно, это гиперплазия.
Ведение и лечение
Как лечится гиперальдостеронизм?
Лечение гиперальдостеронизма зависит от причины.Если причиной является гиперплазия обоих надпочечников, ваш врач может назначить лекарство, блокирующее действие альдостерона. Эти препараты включают спиронолактон (Aldactone®), эплеренон (Inspra®) или амилорид (Midamor®).
Если причиной является опухоль одного из надпочечников, железу можно удалить хирургическим путем или использовать те же лекарства. Они должны улучшить контроль артериального давления и могут уменьшить количество лекарств, необходимых для контроля артериального давления.
Первичный альдостеронизм (гиперальдостеронизм) | Сидарс-Синай
Не то, что вы ищете?Обзор
Первичный альдостеронизм (гиперальдостеронизм) — это состояние, которое возникает, когда надпочечники вырабатывают слишком много альдостерона, гормона, отвечающего за баланс калия и натрия в организме.
Избыточное производство альдостерона заставляет организм удерживать больше натрия и терять калий, что приводит к повышению артериального давления. Пациенты с этим заболеванием подвержены повышенному риску сердечных заболеваний и инсульта.
Симптомы
Основным симптомом, который испытывают пациенты с первичным альдостеронизмом, является высокое кровяное давление от умеренного до тяжелого, которое часто невосприимчиво к медикаментозному лечению и сопровождается низким уровнем калия.
Другие симптомы включают:
- Усталость
- Головные боли
- Слабость мышц
- Онемение
- Временный спорадический паралич
Причины и факторы риска
Многие случаи первичного альдостеронизма вызваны доброкачественной опухолью надпочечника; некоторые из них вызваны гиперактивностью обоих надпочечников, состоянием, известным как двусторонняя гиперплазия надпочечников.
В редких случаях заболевание может быть вызвано раковыми опухолями в наружном слое надпочечников или генетическим заболеванием, известным как излечимый глюкокортикоидами альдостеронизм.
Заболевание чаще всего встречается у людей в возрасте от 30 до 50 лет.
Диагностика
При диагностике первичного альдостеронизма врач часто сначала назначает анализ крови, чтобы определить у пациента уровни альдостерона и ренина. Ренин — это фермент, выделяемый почками, который помогает регулировать кровяное давление.Если обнаружено повышенное количество альдостерона и минимальное количество ренина, это может быть признаком первичного альдостеронизма, и для подтверждения диагноза могут быть назначены другие тесты.
Эти тесты могут включать солевую нагрузку, которая включает потребление высокого уровня натрия с последующим анализом крови и мочи, чтобы определить, как организм обрабатывает соль и реагирует на нее производством альдостерона.
Дополнительное тестирование может включать компьютерную томографию (КТ) или отбор образцов вены надпочечников (AVS), в которых опытный радиолог, например специалисты Центра гипертонии Cedars-Sinai, использует катетер для взятия образцов крови из обоих надпочечников для измерения выработки альдостерона. .
Лечение
Когда первичный альдостеронизм вызван доброкачественной опухолью надпочечника, это состояние можно лечить хирургическим путем или с помощью лекарств.
Если операция — лучший вариант, можно выполнить адреналэктомию для удаления как опухоли, так и надпочечника, к которому она прикреплена. Это часто навсегда решает первичный альдостеронизм, и врач будет внимательно следить за прогрессом пациента, корректируя или отменяя лекарства пациента по мере необходимости.
Когда операция невозможна, для лечения этого состояния можно использовать препараты, блокирующие альдостерон. Однако они не излечивают заболевание и должны приниматься регулярно, чтобы справиться с симптомами.
Если первичный альдостеронизм вызван гиперактивностью надпочечников, лекарства могут помочь справиться с этим состоянием. Лекарства, известные как антагонисты минералокортикоидных рецепторов, блокируют действие альдостерона на организм пациента и помогают снизить кровяное давление и повысить уровень калия.
Не то, что вы ищете?Первичный альдостеронизм (синдром Конна) | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
Wisse, B. (Обновлено 24 июля 2015 г.). Гиперальдостеронизм — первичный и вторичный. MedlinePlus. Доступно на сайте https://medlineplus.gov/ency/article/000330.htm. По состоянию на июнь 2017 г.
Funder, J.W. и другие. (2 марта 2016 г.). Ведение первичного альдостеронизма: выявление случаев, диагностика и лечение: руководство по клинической практике эндокринного общества. Журнал клинической эндокринологии и метаболизма . Доступно в Интернете по адресу http://press.endocrine.org/doi/10.1210/jc.2015-4061. По состоянию на июнь 2017 г.
Castellino, A.M. (2016 3 мая). Ведение первичного альдостеронизма: обновление рекомендаций. Medscape. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/862781#vp_2. По состоянию на июнь 2017 г.
Гроссман, А. (Пересмотрено, май 2016 г.). Вторичный альдостеронизм. Руководство Marck Профессиональная версия. Доступно в Интернете по адресу http: // www.merckmanuals.com/professional/endocrine-and-metabolic-disorders/adrenal-disorders/secondary-aldosteronism. По состоянию на июнь 2017 г.
Доступно в Интернете по адресу http: // www.merckmanuals.com/professional/endocrine-and-metabolic-disorders/adrenal-disorders/secondary-aldosteronism. По состоянию на июнь 2017 г.
(проверено 7 ноября 2016 г.). Первичный альдостеронизм. Клиника Майо. Доступно в Интернете по адресу http://www.mayoclinic.org/diseases-conditions/primary-aldosteronism/home/ovc-20262038. По состоянию на июнь 2017 г.
Увайфо, Г. I. (Обновлено 2 марта 2017 г.). Первичный альдостеронизм. Medscape. Доступно в Интернете по адресу http://emedicine.medscape.com/article/127080-overview. По состоянию на июнь 2017 г.
Straseski, J.A. (Обновлено в марте 2017 г.). Альдостеронизм. Аруп Консалт. Доступно на сайте https://arupconsult.com/content/aldosteronism. По состоянию на июнь 2017 г.
Гроссман, А. Б. (© 2017). Первичный альдостеронизм. Руководство Merck. Доступно в Интернете по адресу http://www.merckmanuals.com/professional/endocrine-and-metabolic-disorders/adrenal-disorders/primary-aldosteronism. По состоянию на июнь 2017 г.
(© 2017). Первичный альдостеронизм. Сеть гормонального здоровья. Доступно в Интернете по адресу http: // www.гормон.org/diseases-and-conditions/adrenal/primary-aldosteronism. По состоянию на июнь 2017 г.
(© 2017). Что такое альдостерон? Сеть гормонального здоровья. Доступно в Интернете по адресу http://www.hormone.org/hormones-and-health/what-do-hormones-do/what-does-aldosterone-do. По состоянию на июнь 2017 г.
(© 2017). Что такое синдром Конна? Первичный гиперальдостеронизм. Доступно в Интернете по адресу https://www.urologyhealth.org/urologic-conditions/conns-syndrome. По состоянию на июнь 2017 г.
Источники, использованные в предыдущих обзорах
Томас, Клейтон Л., Редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (2001). Справочник по диагностическим и лабораторным испытаниям Мосби, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
Plouin, P. et. al. (2004). Тенденции распространенности первичного альдостеронизма, альдостерон-продуцирующих аденом и альдостерон-зависимой гипертензии, поддающейся хирургической коррекции. Dial Transplant (2004) 19: 774-777 [Электронный журнал].Доступно в Интернете по адресу http://ndt.oxfordjournals.org/cgi/content/full/19/4/774.
(© 1995-2005) Гиперальдостеронизм. Руководство Merck — Second Home Edition [Электронная информация]. Доступно в Интернете по адресу http://www.merck.com/mmhe/sec13/ch264/ch264e.html.
Джайн, Т. (2 февраля 2004 г.). Гиперальдостеронизм — первичный и вторичный. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000330.htm.
Хан, А.et. др., (8 сентября 2005 г., обновлено). Гиперальдостеронизм. EMedicine [Он-лайн информация]. Доступно в Интернете по адресу http://www.emedicine.com/radio/topic354.htm.
Онуско Е. (2003, 1 января). Диагностика вторичной гипертонии. Американский семейный врач [Электронный журнал]. Доступно в Интернете по адресу http://www.aafp.org/afp/20030101/67.html.
Мротек, Дж., И Чейз, К. [Хенвуд, М. и Аннасвами, Р., редакторы] (январь 2005 г., обзор). Эндо 101, Эндокринная система, гормоны и железы.Гормональный фонд [Он-лайн информация]. Доступно в Интернете по адресу http://www.hormone.org/endo101/endo101_2.html.
Янг, W. (7 марта 2003 г.). Мини-обзор: Первичный альдостеронизм — изменение представлений в диагностике и лечении. Эндокринология Vol. 144, № 6 2208-2213 [Электронный журнал]. Доступно в Интернете по адресу http://endo.endojournals.org/cgi/content/full/144/6/2208.
(© 2002). Синдром Конна. Центр заболеваний поджелудочной железы и желчевыводящих путей, Университет Южной Калифорнии, отделение хирургии [онлайн-информация].Доступно в Интернете по адресу http://www.surgery.usc.edu.
Кларк В. и Дюфур Д. Р., редакторы (© 2006). Современная практика клинической химии: AACC Press, Вашингтон, округ Колумбия. С. 380-381.
Томас, Клейтон Л., редактор (© 1997). Циклопедический медицинский словарь Табера, 18-е издание: F.A. Davis Company, Филадельфия, Пенсильвания. Стр. 432.
Джаббур, С. (Обновлено 9 августа 2007 г.). Синдром Конна. eMedicine [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/117280-overview.Проверено 18.01.09.
(обзор января 2011 г.). Фонд помощи урологам. Первичный гиперальдостеронизм (синдром Конна). Доступно в Интернете по адресу http://www.urologyhealth.org/urology/index.cfm?article=13. По состоянию на январь 2013 г.
(обзор января 2011 г.). MayoClinic.com. Первичный альдостеронизм. Доступно в Интернете по адресу http://www.mayoclinic.com/health/primary-aldosteronism/DS00563. По состоянию на январь 2013 г.
(обзор июль 2011 г.). PubMed Health. Гиперальдостеронизм — первичный и вторичный.Доступно в Интернете по адресу http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0001371/. По состоянию на январь 2013 г.
(обновлено в августе 2012 г.). Medscape. Первичный альдостеронизм. Доступно в Интернете по адресу http://emedicine.medscape.com/article/127080-overview. По состоянию на январь 2013 г.
Руководство Merck. Первичный альдостеронизм. Доступно на сайте http://www.merckmanuals.com. По состоянию на январь 2013 г.
Гиперальдостеронизм: как современные концепции трансформируют диагностическую и терапевтическую парадигму
Abstract
Прошло почти семь десятилетий с тех пор, как клинические и биохимические особенности первичного гиперальдостеронизма (ПА) были описаны Конн.ПА в настоящее время широко признана самой распространенной формой вторичной гипертензии. PA имеет сильную корреляцию с сердечно-сосудистыми заболеваниями, и неспособность распознать и / или правильно диагностировать это состояние имеет серьезные последствия для здоровья. При правильном выявлении и лечении ПА может быть излечена хирургическим путем у части больных. Диагностическое стремление к PA — не простое стремление, особенно потому, что более глубокое понимание процесса болезни постоянно меняет определение алгоритма диагностики и лечения.Эти новые концепции появились во всех областях этого клинического состояния, включая идентификацию, диагностику и лечение. Здесь мы рассматриваем последние достижения в этой области и резюмируем влияние этих достижений как на диагностические, так и на терапевтические методы.
Введение
Гипертония является самым сильным модифицируемым фактором риска сердечно-сосудистых заболеваний во всем мире. Несмотря на рост осведомленности о болезни, распространенность неконтролируемой гипертензии остается высокой (1). Недавно Комиссия по артериальной гипертензии «Ланцет» определила ключевые меры по улучшению лечения АД во всем мире (2).Среди ключевых шагов, предложенных для борьбы с повышенным АД, была лучшая идентификация лиц с вторичной гипертензией. Есть надежда, что более рациональная оценка вторичной гипертонии приведет к лучшему выявлению, лечению и потенциальным излечениям для людей с вторичными формами гипертонии.
Первичный гиперальдостеронизм (ПА) — одна из наиболее распространенных форм вторичной гипертензии. Хотя распространенность ПА сильно различается в зависимости от исследуемой популяции, распространенность ПА может достигать 22% среди лиц с резистентной гипертензией (3).Более того, люди с ПА разделяют поразительно непомерно тяжелое бремя сердечно-сосудистых заболеваний по сравнению с людьми с эссенциальной гипертензией (ЭГ) (4-6). По сравнению с людьми с ГГ наличие гиперальдостеронизма увеличивало риск инфаркта миокарда, инсульта и фибрилляции предсердий (ФП) в 4, 6 и 12 раз соответственно (4). Улучшение идентификации людей с ПА имеет решающее значение, учитывая сильную корреляцию между альдостероном и сердечно-сосудистыми заболеваниями.
Оценка PA — это не простая задача. Руководства и алгоритмы клинической практики для оценки и лечения ПА были разработаны с целью стандартизации диагностических методов и оптимизации лечения заболеваний. Общая оценка валидности и применимости клинических руководств по ПА демонстрирует несоответствие диагностических подходов и значительные проблемы с простотой реализации (7). Эти проблемы часто приводят к клинической неопределенности, которая может задерживать, замедлять или даже останавливать диагностические исследования ПА в клинических условиях.В этой статье освещаются некоторые развивающиеся концепции ПА, которые улучшают наше понимание клинической сущности и трансформируют текущие диагностические и терапевтические модели оказания помощи.
Калий в сыворотке и PA
Исторически гипокалиемия считалась важным компонентом клинической картины пациентов с ПА. В ранних клинических исследованиях гипокалиемия не рассматривалась как обязательное условие conditio sine qua non для ПА. Например, исследование первичной распространенности альдостеронизма при гипертонии (PAPY) представляло собой проспективное исследование 1180 последовательных пациентов с впервые диагностированной гипертензией, которые были оценены на предмет PA с использованием строгого протокола (8).В этой когорте только 48% участников, у которых были обнаружены аденомы, продуцирующие альдостерон (APA), имели сопутствующую спонтанную гипокалиемию. Наличие гипокалиемии действительно предполагает более яркий клинический фенотип ПА и может быть полезным инструментом для классификации подтипов и прогнозирования хирургического ответа на адреналэктомию. В исследовании PAPY распространенность гипокалиемии была значительно выше при APA по сравнению с двусторонней гиперплазией надпочечников (BAH) (49% против 16%). Пациенты с гипокалиемией и APA, как правило, имели более высокие значения отношения альдостерон / ренин (ARR), что в целом способствовало более полному клиническому ответу на хирургическую адреналэктомию.Взятые вместе, эти результаты предоставляют убедительные данные о том, что гипокалиемия не является постоянным признаком ПА, а, скорее, является грубым инструментом для дифференциации АПА от БАГ и для прогнозирования ответа на хирургическую адреналэктомию при АПА.
Более недавнее исследование показало противоречивые наблюдения относительно распространенности гипокалиемии при ПА по сравнению с ранними наблюдениями. Burrello et al. (9) исследовал распространенность гипокалиемии и ПА у 5100 пациентов, поступивших в отделение третичной гипертензии, и наблюдал ступенчатую взаимосвязь между уровнем калия в сыворотке и распространенностью ПА.Среди пациентов со спонтанной гипокалиемией распространенность ПА увеличилась с 22% у пациентов с концентрацией калия 3,5–3,6 ммоль / л до 89% у пациентов с концентрацией калия <2,5 ммоль / л. Фактически, гипокалиемическая гипертензия была более частым фенотипом в этой когорте пациентов, направленных на лечение гипертонии. Поскольку имеющиеся данные демонстрируют широкий разброс в распространенности гипокалиемии при ПА, гипокалиемия, вероятно, имеет неадекватную чувствительность и специфичность, чтобы служить ценным инструментом для выявления случаев ПА.
Наличие гипокалиемии при ПА может иметь значение, выходящее за рамки идентификации заболевания и классификации подтипов. Все больше данных демонстрируют, что гипокалиемия на фоне ПА связана с более серьезными сердечно-сосудистыми и метаболическими заболеваниями и смертностью. В вышеупомянутом исследовании Burrello et al. (9), частота сердечно-сосудистых событий была выше у пациентов с гипокалиемией по сравнению с нормокалиемией (11% против 6%, P <0.001). В частности, пациенты с гипокалиемией демонстрировали более высокий риск аритмий (3% против 2%, P = 0,006), сердечной недостаточности (1% против 0,4%, P = 0,032) и инсульта (3% против 1%, P <0,001). Наконец, пациенты с гипокалиемией продемонстрировали более высокую распространенность ХБП (9% против 3%, P <0,001). Дальнейшие исследования необходимы для дальнейшего выяснения связи между гипокалиемией и ПА с повышенным риском сердечно-сосудистых заболеваний и поражением целевых органов-мишеней.
Новые сведения о распространенности заболеваний
Недавно выпущенный кросс-секционный анализ предоставил современное понимание распространенности ПА, а также переопределил наше концептуальное понимание ренин-независимой продукции альдостерона применительно к гипертонии (рис. 1) (10 ). В этом исследовании изучалась распространенность ПА среди> 1000 пациентов из четырех географически разнесенных центров США. Две трети пациентов имели адекватное подавление ренина для оценки ренин-независимой продукции альдостерона.Распространенность первичного альдостеронизма среди пациентов с нормотензией, гипертензией 1 стадии, гипертонией 2 стадии и резистентной гипертензией составляла 11%, 16%, 22% и 22% соответственно. Помимо демонстрации того, что ПА является более распространенным состоянием, чем считалось ранее (даже среди людей с нормальным АД и нормокалиемией), авторы описали спектр ренин-независимой продукции альдостерона, который соответствует степени тяжести гипертензии. Основываясь на этих результатах, становится очевидным, что наше представление о том, что ПА является редким заболеванием, необходимо пересмотреть, потому что даже среди лиц с нормальным давлением распространенность ренин-независимого гиперальдостеронизма была высокой.Важно отметить, что клиническое проявление ПА может представлять собой более клинически очевидную и яркую фазу, казалось бы, развивающегося спектра ренин-независимой, опосредованной альдостероном гипертензии.
Рисунок 1.Распределение ренин-независимой продукции альдостерона по категориям АД. (A) Не скорректированная скорость экскреции альдостерона с мочой (ось y ) для каждого отдельного участника в порядке от наименьшего к наибольшему (ось x ). Пунктирная линия представляет пороговое значение 12 мкг г / 24 ч для диагностики первичного гиперальдостеронизма.(B) Не скорректированные графики плотности ренин-независимого производства альдостерона по категориям BP. (C) Средние показатели экскреции альдостерона с мочой для каждой категории АД, нескорректированные (сплошные линии с кружками) и скорректированные (пунктирные линии с квадратами). Изменено по ссылке 10, с разрешения.
Новые ассоциации между PA и клиническими заболеваниями
Возникают новые ассоциации между PA и клиническими заболеваниями, в частности, AF и обструктивное апноэ во сне (OSA). В последнее десятилетие наблюдается сильная связь между ПА и ФП.Milliez et al. (11) недавно исследовал частоту сердечно-сосудистых событий у пациентов с ПА и обнаружил 12-кратное увеличение риска ФП при ПА по сравнению с ЭГ (PA, 7,3; EH, 0,6; отношение шансов, 12,1; P <0,001). . Эти результаты были подтверждены Monticone et al. (4), которые выполнили систематический обзор и метаанализ 31 исследования, чтобы изучить частоту сердечно-сосудистых событий у участников с ПА по сравнению с ГЭ. Риск ФП составил 3,52 (95% ДИ от 2,06 до 5.99) у участников с ПА по сравнению с ЭГ.
Интересно, что полнота блокады альдостерона при ПА может повлиять на будущий риск развития ФП. Hundemer et al. (12) исследовали, влияет ли терапия антагонистами минералокортикоидных рецепторов (MR) (MRA) или адреналэктомия при PA на риск развития AF. Пациенты с ПА, которым была проведена хирургическая адреналэктомия, не имели статистически значимой разницы в риске развития ФП по сравнению с ЭГ. Несмотря на аналогичный контроль АД, пациенты с ПА, получавшие MRA, имели более высокий риск развития AF по сравнению с EH, когда уровни ренина оставались подавленными при блокаде MR.Напротив, пациенты с ПА, которые лечились MRA и испытали повышение уровня ренина или перенесли хирургическую адреналэктомию, не имели статистически значимых различий в риске возникновения ФП по сравнению с пациентами с ЭГ. Аналогичным образом Росси и др. (13) недавно опубликовали результаты, показывающие, что адреналэктомия значительно снижает частоту возникновения ФП у пациентов с ПА. После среднего периода наблюдения 11,8 лет у пациентов с ПА, леченных медикаментозно, была более низкая выживаемость без ФП, чем у пациентов с ПА, леченных хирургическим путем.В совокупности, люди с явно неспровоцированной ФП должны проходить скрининг на ПА, а пациенты с ПА должны проходить соответствующую терапию для снижения риска повторной ФП.
Связь между альдостероном и OSA усиливается, и возможные механизмы, ответственные за эту связь, исследуются. Связь между симптомами OSA и наличием PA была оценена Calhoun et al. (14). Пациенты с высоким риском СОАС почти в два раза чаще имели ПА (36% против 19%).Частота ПА у пациентов с СОАС оценивалась в исследовании Di Murro et al. (15). Авторы включили 325 последовательных пациентов с впервые диагностированной артериальной гипертензией. У 34% пациентов с СОАС также была диагностирована ПА, и БАГ был определен как наиболее частый подтип ПА. В исследовании Resist-POL последовательно оценивались 204 пациента с резистентной артериальной гипертензией (16). ОАС был незначительно, но значительно выше у лиц с ПА, чем у лиц без ПА. ОАС от умеренной до тяжелой степени чаще встречается у пациентов с ПА, чем у пациентов без ПА.Кроме того, коморбидный OSA и PA были связаны с более выраженным поражением органа-мишени. Было высказано предположение, что альдостерон ухудшает OSA, способствуя накоплению жидкости в верхних дыхательных путях, что приводит к сопротивлению дыхательных путей (17). Таким образом, существует сильная двунаправленная связь между OSA и PA, которая опосредуется альдостероном.
Клинические данные установили тесную связь между избытком альдостерона, резистентной гипертензией и СОАС (18). Более того, терапия, направленная на избыток альдостерона при СОАС и резистентной гипертензии, по-видимому, имеет глубокие клинические преимущества.Например, Ян и др. (19) исследовали влияние спиронолактона на пациентов с резистентной гипертензией (не подтверждено наличие ПА) и СОАС. Через 12 недель наблюдения индекс апноэ-гипопноэ (21,8–1,8, P <0,05), уровни альдостерона в плазме нг / дл (9,8–2,9, P <0,05), клиническое АД и амбулаторное АД были значительно снизился в группе лечения по сравнению с контрольной группой. Подобные результаты были выявлены у пациентов с ПА. Wolley et al. (20) набрали пациентов, прошедших диагностическую оценку ПА, у которых были симптомы, указывающие на СОАС. Пациентам с подтвержденной ПА была проведена полисомнография на исходном уровне и, по крайней мере, через 3 месяца после специфического лечения ПА. Пациентам с альдостерон-секретирующими аденомами и БАГ проводилась хирургическая адреналэктомия и МР блокада соответственно. Для пациентов, которым был поставлен диагноз и впоследствии лечился ПА, средний индекс апноэ-гипопноэ упал с 22,5 до 12,3 ( P = 0.02) (20). Эти исследования предполагают тесную связь между избытком альдостерона, гипертонией и СОАС, с которой можно эффективно бороться с помощью стратегий снижения уровня альдостерона.
Подтверждающее тестирование
Руководства по клинической практике обычно отдают предпочтение подтверждающему тестированию на положительный ARR перед классификацией подтипа (21). Подтверждающее тестирование на ПА может быть выполнено с помощью пероральной натриевой нагрузки, теста с инфузией физиологического раствора, теста подавления флудрокортизона или теста с провокацией каптоприла. Эти тесты являются громоздкими, требуют много времени, а рекомендации дают ограниченное представление о предпочтительном подтверждающем тесте.
Подтверждающее тестирование не является практикой, основанной на доказательствах. В недавно опубликованном исследовании соотношения альдостерон-ренин для первичного гиперальдостеронизма (AQUARR) была изучена ценность подтверждающего тестирования для диагностики ПА (22). Исследование выявило три основных вывода, применимых к этому обсуждению. Во-первых, исследование не показало диагностической выгоды от систематического использования теста с провокацией каптоприла по сравнению с исходным ARR в популяции с высокой распространенностью PA. Во-вторых, чувствительность и специфичность ARR была подтверждена в популяции с высокой распространенностью PA.Наконец, ARR предоставил важную количественную информацию при оценке PA, то есть прогрессивно увеличивающиеся значения ARR подразумевали экспоненциальное увеличение специфичности и снижение количества ложноположительных результатов. И диагностическое отношение шансов, и положительное отношение правдоподобия были высокими (6,35 и 17,7 соответственно) для значений ARR> 50. Взятые вместе, эти результаты означают, что ARR является высокоэффективным скрининговым тестом на PA, и, что еще более удивительно, значение ARR> 50 обладает той же диагностической силой, что и подтверждающее тестирование.
В рекомендациях эндокринного общества для ПА говорится, что подтверждающее тестирование можно обойти только у пациентов с сопутствующей гипокалиемией, выраженным подавлением ренина и концентрацией альдостерона в плазме (PAC)> 20 нг / дл (21). Поскольку гипокалиемия встречается только у меньшинства пациентов с ПА, неудивительно, что только очень небольшой процент пациентов удовлетворяет этим критериям. По сути, это делает подтверждающее тестирование обязательным в подавляющем большинстве случаев. Учитывая низкую эффективность подтверждающего тестирования в клинических исследованиях, широкомасштабное применение подтверждающего тестирования при оценке ПА представляется ошибочным (22–24).
Нормальный альдостерон PA
PA может возникать при относительно нормальном PAC (20). Есть несколько правдоподобных объяснений этого парадоксального явления. Альдостерон секретируется пульсирующим образом, что обычно происходит быстрее ранним утром (25). Если образцы PAC получены во время латентной фазы, это приведет к ложно нормальному уровню альдостерона. Нормальный уровень альдостерона при ПА также является результатом сильной физиологической реакции на высокое потребление натрия (26).Уровни PAC могут быть нормальными, несмотря на клинический фенотип PA из-за различий в чувствительности к альдостерону. Возраст и раса, по-видимому, являются основными детерминантами чувствительности к альдостерону. Ту и др. (27) обнаружили, что влияние альдостерона на АД усиливается с возрастом, особенно у чернокожих ( P <0,01), что свидетельствует о повышении чувствительности к альдостерону с возрастом. По сравнению с чернокожими людьми возрастные изменения чувствительности к альдостерону у белых не были статистически значимыми.Эти результаты вызывают озабоченность по поводу использования абсолютного значения PAC в качестве критерия включения для PA.
Визуализация для классификации PHA
Большинство руководств по PA рекомендуют компьютерную томографию (CT) или магнитно-резонансную томографию (MRI) в качестве наилучшего начального теста для классификации подтипов PA. Эти методы визуализации являются привлекательным вариантом для классификации подтипов ПА по сравнению с взятием образцов надпочечников (AVS), потому что они, как правило, безопасны, широко доступны и могут быстро дать результаты.К сожалению, диагностические характеристики поперечной визуализации для PA демонстрируют широкие вариации и могут служить препятствием для лечебной адреналэктомии у подходящих кандидатов (28). В следующем разделе описывается несколько подводных камней визуализации при диагностической оценке PA, которые требуют рассмотрения.
КТ и МРТ все чаще используются для обнаружения аденом, несмотря на многочисленные исследования, которые ставят под сомнение точность изображения поперечного сечения. В исследовании Mayo Clinic 203 пациента с ПА были проспективно отобраны для лечения АВС на основе степени избытка альдостерона, возраста, желания хирургического лечения и результатов компьютерной томографии (29).Только на основании результатов компьютерной томографии почти 22% пациентов были бы необоснованно исключены из адреналэктомии. Более того, почти 25% пациентов могли подвергнуться ненужной или несоответствующей адреналэктомии. В систематическом обзоре Kempers et al. (30) обнаружили, что результаты КТ / МРТ не совпадают с результатами АВС у 38% пациентов. Более конкретно, если бы только результаты КТ / МРТ использовались для определения латерализации аномалии надпочечников, несоответствующая адреналэктомия произошла бы у 15% пациентов (где АВС выявила двустороннюю проблему), неправильное исключение из адреналэктомии произошло бы у 19% ( где АВС показала одностороннюю секрецию), а адреналэктомия на неправильной стороне произошла бы в 4% (где АВС показала секрецию альдостерона на противоположной стороне).В более свежем исследовании из Мюнхена у 175 пациентов, перенесших одностороннюю лапароскопическую адреналэктомию по поводу ПА после КТ / МРТ и латерализации с помощью АВС, КТ и МРТ показали противоречивые результаты в 39% и 41% соответственно (31). Эти исследования подчеркивают опасность использования КТ или МРТ как для диагностики, так и для лечения ПА.
Визуализация может быть более надежной для диагностики БАГ, чем дискретные аденомы надпочечников. Lingam et al. (32) обнаружили, что надпочечники у пациентов с БАГ были значительно ( P <0.05) больше, чем у пациентов с APA или у здоровых контрольных субъектов. Чувствительность 100% была достигнута, когда средняя ширина конечности> 3 мм использовалась для диагностики БАГ, а специфичность 100% была достигнута, когда средняя ширина конечности была ≥5 мм. В будущем широкое применение измерения ширины конечностей надпочечников может стать надежным и точным инструментом для диагностики БАГ.
AVS
AVS широко считается золотым стандартом для классификации подтипов в PA.Текущие руководства по клинической практике рекомендуют использовать АВС с измерением концентрации кортизола в плазме и PAC. Многочисленные исследования продемонстрировали превосходство АВС над визуализацией для определения подтипов PHA (33–35). Несмотря на эти рекомендации, использование AVS для классификации подтипов остается низким. В Международном исследовании отбора проб надпочечников (AVIS) АВС систематически выполнялась только у 77% пациентов с подтвержденной ПА (36).
До недавнего времени практика, которая требовала применения АВС до хирургической адреналэктомии, оставалась относительно неизменной.В исследовании SPARTACUS (подтип первичного альдостеронизма: рандомизированное испытание, сравнивающее отбор пробы надпочечников и компьютерную томографию) изучались исходы пациентов с гиперальдостеронизмом, получавших лечение только с помощью КТ или АВС (37). Первичной конечной точкой этого исследования была интенсивность медикаментозного лечения для достижения целевого АД. Вторичными конечными точками были биохимические исходы у пациентов, которым была проведена адреналэктомия, качество жизни, связанное со здоровьем, экономическая эффективность и безопасность.После 1 года наблюдения исследование показало, что лечение ПА на основе КТ или АВС не показало значительных различий в интенсивности антигипертензивного лечения или клинических преимуществах. Кроме того, КТ и АВС были признаны безопасными, но подход на основе АВС был значительно дороже, чем подход на основе КТ для ПА. Критики исследования подчеркивают, что исследуемая популяция предпочитала более яркий клинический фенотип ПА, который с меньшей вероятностью приведет к излечению АД после адреналэктомии (38). Как результаты SPARTACUS должны быть включены в текущую парадигму PA, остается нерешенным.
Нормотензивный ПА
Хотя артериальная гипертензия считается отличительной чертой ПА, клинический спектр ПА может включать нормотензивных людей. Эта зарождающаяся форма гиперальдостеронизма была недавно охарактеризована. Браун и др. (39) выполнил продольный анализ, изучающий, связаны ли концентрации альдостерона в контексте фенотипов физиологической активности ренина плазмы с возникновением артериальной гипертензии. Подавленный фенотип ренина был связан с более высокой частотой возникновения гипертонии, чем другие фенотипы активности ренина в плазме (уровень заболеваемости на 1000 человеко-лет наблюдения: подавленный фенотип ренина, 85.4 события [95% ДИ, 73,4–99,3 события]; неопределенный фенотип ренина, 53,3 случая [95% ДИ, 42,8–66,4 случая]; несупрессированный фенотип ренина, 54,5 случая [95% ДИ, 41,8–71,0 случая]). При подавлении ренина более высокие концентрации альдостерона были независимо связаны с повышенным риском развития артериальной гипертензии, тогда как связь между альдостероном и гипертензией не наблюдалась, когда ренин не подавлялся. Более высокие концентрации альдостерона были связаны с более низким содержанием калия в сыворотке и более высокой экскрецией калия с мочой, но только при подавлении ренина.Эти результаты подтверждают спектр субклинических ПА, которые представляют значительный риск развития гипертонии в будущем. Определение того, каких пациентов следует обследовать на этот спектр ПА, остается непростым вопросом.
Успешная адреналэктомия
После определения локализованного поражения надпочечников хирургическая адреналэктомия предоставляет наилучшую возможность для длительного контроля АД. В настоящее время идентифицировано несколько факторов, которые предсказывают ответ на хирургическую адреналэктомию. Ван и др. (40) выполнил многомерный регрессионный анализ, который изучил основные детерминанты послеоперационного излечения ПА.Основными детерминантами хирургического излечения были: продолжительность артериальной гипертензии <5 лет, количество антигипертензивных препаратов меньше или равно двум, предоперационный ответ на спиронолактон, генотип TT гена CYP11B2 и наличие аденомы, а не гиперплазии. (Таблица 1) (40). Эти факторы могут служить мощным инструментом, помогающим в оценке пациентов для адреналэктомии. Кроме того, эти факторы могут идентифицировать пациентов, которые могут менее благоприятно реагировать на адреналэктомию и нуждаются в более тщательном постадреналэктомическом мониторинге.
Таблица 1.Переменные, связанные с успешными хирургическими исходами при первичном гиперальдостеронизме
Генетика при спорадической РА
Наблюдаются огромные успехи в нашем понимании генетики, ответственной за спорадическую РА. Преобладающая информация, полученная за последнее десятилетие, позволяет предположить, что PA преимущественно является генетическим заболеванием, вызываемым соматическими мутациями (41–43). Наиболее частой генетической вариацией APA является соматическая мутация гена KCNJ5 , которая была впервые описана Choi et al. (41). Соматические мутации в фильтре селективности канала KCNJ5 в APA приводят к проникновению натрия (44), деполяризации мембраны и мобилизации кальция, что приводит к конститутивному высвобождению альдостерона (42). Распространенность соматических мутаций KCNJ5 в APA составляет 40–50% во всем мире, хотя более высокая распространенность зарегистрирована в популяциях из Китая и Японии (45,46).
Идентификация гена KCNJ5 имеет значение для клинического и терапевтического лечения спорадической ПА.В ряде исследований изучали влияние наличия мутации гена KCNJ5 , поскольку это связано с исходом хирургического лечения ПА. В ретроспективном исследовании Almeida с коллегами (47) было включено 100 пациентов с ПА, перенесших адреналэктомию. Наличие мутации KCNJ5 было единственным независимым предиктором ремиссии гипертонии после адреналэктомии ( P = 0,004) (47). В японском исследовании пациенты с APA с мутациями гена KCNJ5 и без них оценивались на жесткость артерий и АД после адреналэктомии (48).Группа с мутацией KCNJ5- показала значительное улучшение индекса массы левого желудочка ( P <0,001), но не в группе дикого типа ( P = 0,26). Недавние исследования показали, что макролиды избирательно ингибируют мутантные калиевые каналы KCNJ5 и могут снижать выработку альдостерона у лиц с APA (49,50). Хотя необходимы дальнейшие исследования, эти антибиотики могут быть многообещающими для лечения APA, несущих эту мутацию. Генетическое тестирование мутации KCNJ5 теперь коммерчески доступно, а подробную информацию для заказа можно найти в Реестре генетического тестирования Национального института здравоохранения.Однако в настоящее время клиническая применимость идентификации мутации гена KCNJ5 остается изолированной для прогнозирования хирургического ответа на адреналэктомию при APA и, потенциально, при стратификации риска сердечно-сосудистых заболеваний.
Инновационная медицинская терапия
Несколько важных достижений в медицинской терапии за последние несколько лет могут иметь терапевтические последствия для ПА в ближайшем будущем. Одним из таких достижений является появление нового класса лекарств, называемых нестероидными MRA. Несколько препаратов этого класса находятся в стадии разработки, в том числе апараренон, финеренон и эсаксеренон.Эсаксерернон недавно получил разрешение на продажу в Японии для лечения артериальной гипертензии на основании положительных результатов исследований фазы 3 (51). Нестероидные MRA, как правило, обладают большей селективностью к рецепторам по сравнению со спиронолактоном и более сильным сродством связывания MR, чем эплеренон (52). Эти новые классы препаратов, как правило, обладают улучшенными профилями побочных эффектов, несмотря на повышенную эффективность (53). Кроме того, нестероидные MRA имеют более низкий риск гиперкалиемии, чем традиционные MRA (54). Это может дать возможность безопасно комбинировать ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина с нестероидными MRA для более полной инактивации рецепторов альдостерона при ПА без последующего риска гиперкалиемии.Эти агенты значительно расширят арсенал доступной медикаментозной терапии ПА, особенно у пациентов с БАГ и АПА, которые не являются кандидатами на хирургическую адреналэктомию.
Активация МР, атеросклероз и воспаление
Изменения АД, связанные с высоким уровнем альдостерона, не объясняют независимо огромное бремя сердечно-сосудистых и почечных заболеваний в этой популяции (4). Хотя все механизмы, ответственные за повышенный риск сердечно-сосудистых заболеваний и заболеваний почек, остаются неопределенными, воспаление и атеросклероз являются двумя предполагаемыми факторами, которые были последовательно идентифицированы (55,56).Новые исследования выявляют новые механизмы, с помощью которых активация МР инициирует каскад последующих событий, кульминацией которых является сосудистое воспаление и прогрессирующий атеросклероз (рис. 2) (57). Активация MR, по-видимому, модулирует преобразование клонов моноцитов / макрофагов в более воспалительный фенотип (58). Благоприятные эффекты блокады MR как на воспаление, так и на атеросклероз дополнительно указывают на активацию MR как причинный путь. В настоящее время авторы проводят проспективное рандомизированное контролируемое клиническое исследование антагонизма МРТ у пациентов с диабетом 2 типа, подверженных высокому риску сердечно-сосудистых заболеваний (ClinicalTrials.идентификатор gov, NCT02169089) (59). Цель исследования — оценить влияние антагонизма МР на прогрессирование атеросклероза и пластичность моноцитов с течением времени. Эти важные результаты и будущие исследования помогут прояснить важные пробелы в наших знаниях, которые в конечном итоге улучшат уход за людьми с альдостерон-опосредованными заболеваниями, включая ПА. Иммунная модуляция может быть будущей терапевтической целью для уменьшения сердечно-сосудистых и почечных заболеваний при высоком уровне альдостерона.
Рисунок 2.Неблагоприятные последствия активации минералокортикоидных рецепторов. DM, сахарный диабет; MR, минералокортикоидный рецептор.
Заключение
Прошло почти семь десятилетий с тех пор, как Конном были описаны биохимические и клинические особенности PA. Несмотря на значительный промежуток времени, PA остается недооцененной причиной как гипертензии, так и поражения целевых органов-мишеней. Неспособность распознать PA оказывает огромное влияние на контроль АД и, что более важно, на частоту сердечно-сосудистых заболеваний.Новые концепции в области ПА быстро улучшают наше понимание болезни и постоянно формируют наш диагностический подход. Эти концепции в отношении ПА в конечном итоге приведут к большему количеству вариантов лечения, применяемых в этой популяции пациентов с высоким риском. Это сложное и динамичное заболевание требует современного подхода, который включает в себя как историческое, так и современное понимание, чтобы обеспечить значимые клинические результаты.
Раскрытие информации
Всем авторам нечего раскрывать.
Выражение признательности
Доктор Мэтью Р. Вейр сообщает о получении поддержки от Akebia, AstraZeneca, Boehringer-Ingelheim, Boston Scientific, Janssen, Merck, Национального института сердца, легких и крови, Национального института диабета, болезней пищеварения и почек и Vifor / Relypsa, вне представленной работы.
Вклад авторов
М. Латтанцио отвечал за сбор данных и исследования; М. Латтанцио и М. Вейр разработали концепцию исследования, несли ответственность за ресурсы, написали первоначальный черновик, а также просмотрели и отредактировали рукопись; И м.Weir отвечал за надзор, проверку и визуализацию.
- Получено 24 февраля 2020 г.
- Принято 16 июля 2020 г.
- Авторские права © 2020 Американского общества нефрологов
Первичный альдостеронизм | Сеть гормонального здоровья
Что такое первичный альдостеронизм?
Первичный альдостеронизм (ПА) — это разновидность избытка альдостерона (гиперальдостеронизм). Это состояние возникает, когда ваши надпочечники, две маленькие железы, расположенные в верхней части почки, производят слишком много альдостерона.Альдостерон — это гормон, который помогает сбалансировать уровни натрия (соли) и калия в организме. Избыток альдостерона заставляет организм удерживать натрий, что приводит к накоплению соли и воды и повышению артериального давления. Неконтролируемое высокое кровяное давление может подвергнуть вас риску инсульта, сердечного приступа, сердечной недостаточности или почечной недостаточности. Риск сердечных заболеваний и инсульта может быть даже выше у людей с ПА, чем у других людей с высоким кровяным давлением.
Когда повышение уровня альдостерона вызвано проблемой надпочечников, это состояние называется первичным альдостеронизмом.Когда проблема возникает вне надпочечников, это называется вторичным альдостеронизмом. Основными причинами ПА являются:
- Повышенная активность обоих надпочечников, которая встречается примерно в двух третях случаев
- Доброкачественное новообразование или опухоль в одном надпочечнике (также называемое синдромом Конна), которое встречается примерно в одной трети случаев
- Наследственное заболевание, влияющее на выработку альдостерона, встречается редко
- Раковая опухоль надпочечника, встречается крайне редко
Каковы клинические признаки первичного альдостеронизма?
- Высокое кровяное давление, для лечения которого требуется более трех лекарств
- Высокое кровяное давление, начавшееся в молодом возрасте (до 30 лет)
- Семейный анамнез инсульта в молодом возрасте
- Низкий уровень калия в крови (гипокалиемия)
Как диагностируется первичный альдостеронизм?
Для диагностики ПА ваш врач измерит уровни альдостерона и ренина в вашей крови.Ренин — это белок, вырабатываемый почками, который помогает регулировать кровяное давление. При ПА уровень ренина низкий, а уровень альдостерона высокий. Если диагностирована ПА, ваш врач проведет визуализацию надпочечников (обычно КТ или МРТ), чтобы определить, есть ли у вас одна опухоль или двусторонние опухоли надпочечников (с обеих сторон).
Как лечится первичный альдостеронизм?
Лечение ПА зависит от его причины и может включать прием лекарств или хирургическое вмешательство. Если вы и ваш врач решите продолжить операцию, ваш врач много раз будет назначать тест, называемый «взятием пробы из надпочечниковой вены», с взятием образцов крови из каждой надпочечниковой вены для измерения уровня альдостерона и кортизола.Этот тест продемонстрирует, какие надпочечники вырабатывают избыток альдостерона. Если оба надпочечника гиперактивны, лечение с помощью лекарств и изменение образа жизни часто предпочтительнее хирургического вмешательства. Ваш врач может прописать специальный тип мочегонного средства («водные таблетки»), который блокирует действие альдостерона в вашем организме. Вам также нужно будет ограничить потребление натрия (соли) в своем рационе.
Когда гиперактивен только один надпочечник, ЛА можно лечить с помощью лекарств и изменения образа жизни. Однако врачи обычно рекомендуют операцию по удалению главного надпочечника.После операции вам все еще может потребоваться прием лекарств. Также следует вести здоровый образ жизни по:
- Уменьшение содержания натрия в рационе
- Похудание, при необходимости
- Регулярные тренировки
- Ограничение употребления алкоголя
- Отказ от курения
Вопросы к врачу
- Следует ли мне пройти обследование, чтобы выяснить причину моего высокого кровяного давления?
- Какие у меня варианты лечения?
- Какие лекарства мне следует принимать? Как часто мне следует его принимать?
- Как долго мне нужно будет принимать лекарства?
- Каковы преимущества и риски моих лекарств?
- Как часто мне следует посещать врача?
- Следует ли мне обратиться за помощью к эндокринологу?




 Радиолог берет кровь из правой и левой надпочечников и сравнивает эти два образца. Если уровень альдостерона повышен только на одной стороне, врач может заподозрить рост надпочечника.
Радиолог берет кровь из правой и левой надпочечников и сравнивает эти два образца. Если уровень альдостерона повышен только на одной стороне, врач может заподозрить рост надпочечника.
 Попробуйте диетические подходы к борьбе с гипертонией (DASH) — она доказала свою пользу для вашего сердца. Здоровая диета также ограничивает потребление натрия, добавленного сахара, насыщенных жиров и алкоголя.
Попробуйте диетические подходы к борьбе с гипертонией (DASH) — она доказала свою пользу для вашего сердца. Здоровая диета также ограничивает потребление натрия, добавленного сахара, насыщенных жиров и алкоголя.