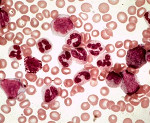
Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
Общие сведения
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.

Хронический миелолейкоз
Причины
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
- При первой, хронической (неактивной) фазе отмечается постепенное усугубление патологических изменений при сохранении удовлетворительного общего состояния.
- Во второй фазе хронического миелолейкоза – фазе акселерации изменения становятся явными, развиваются прогрессирующие анемия и тромбоцитопения.
- Заключительной стадией хронического миелолейкоза является бластный криз, сопровождающийся быстрой экстрамедуллярной пролиферацией бластных клеток.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях – до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
- Монохимиотерапию. При повышении уровня лейкоцитов используют бусульфан. После нормализации лабораторных показателей и уменьшения селезенки пациентам с хроническим миелолейкозом назначают поддерживающую терапию или курсовое лечение бусульфаном. При бластных кризах осуществляют лечение гидроксикарбамидом.
- Полихимиотерапию. В прогрессирующей фазе хронического миелолейкоза возможно использование одного химиопрепарата или полихимиотерапии. Применяют митобронитол, гексафосфамид или хлорэтиламиноурацил. Как и в хронической фазе, проводят интенсивную терапию до стабилизации лабораторных показателей, в последующем переходят на поддерживающие дозы. Курсы полиохимиотерапии при хроническом миелолейкозе повторяют 3-4 раза в год.
- Гемокоррекцию. При неэффективности терапии используют лейкоцитаферез. При выраженной тромбоцитопении, анемии выполняют переливания тромбоконцентрата и эритроцитарной массы.
- ТКМ. Пересадку костного мозга проводят в первой фазе хронического миелолейкоза. Продолжительной ремиссии удается достичь у 70% пациентов.
- Удаление селезенки. При наличии показаний осуществляют спленэктомию. Экстренная спленэктомия показана при разрыве или угрозе разрыва селезенки, плановая – при гемолитических кризах, «блуждающей» селезенке, рецидивирующих периспленитах и резко выраженной спленомегалии, сопровождающейся нарушением функций органов брюшной полости.
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100×109/л, тромбоцитопению менее 150×109/л, тромбоцитоз более 500х109/л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Что такое ХМЛ и как с ним бороться
Врач-онкогематолог Михаил Фоминых про хронический миелоидный лейкоз

Михаил Фоминых — научный сотрудник Российского НИИ гематологии и трансфузиологии, Санкт-Петербург. Практикующий онкогематолог, который посвятил свою научную деятельность хроническому миелолейкозу, и в 2016 году защитил на эту тему диссертацию. В ходе дискуссии он раскрыл основные симптомы ХМЛ, рассказал про зоны риска и ограничения, а также объяснил, можно ли родить здорового ребенка с таким диагнозом.
Каковы основные симптомы ХМЛ?
Зачастую самого человека ничего особо не беспокоит. Очень часто пациент попадает к нам от другого специалиста: терапевта или хирурга. Люди сдают плановые анализы и выясняется, что у них повышенное количество белых кровяных телец. Обнаружив повышенные лейкоциты, терапевт или хирург направляет пациента к гематологу.
Если говорить о симптоматике, то это может быть повышенная усталость, потливость, немотивированные подъемы температуры тела до 38 без явных признаков инфекции, тяжесть в левом подреберье за счет того, что селезенка увеличивается в размере. Если следить за здоровьем и каждый год сдавать анализы, то хронический миелоидный лейкоз можно выявить на ранней стадии. На сегодняшний день 95% случаев ХМЛ диагностируется в хронической фазе и только 5% — в запущенных, продвинутых. Это фазы акселерации и бластного криза, когда начинают проявляться симптомы опухолевой интоксикации.
Самый яркий симптом ранней стадии ХМЛ — немотивированная потеря массы тела в течение полугода. Если вы не сидите на диете и не работаете над снижением веса, но теряете килограммы, а помимо этого наблюдается повышенная потливость и температура выше 38 — это повод насторожиться и пойти сдать анализы.
ХМЛ в «продвинутой» стадии проявляется слабостью и повышенной утомляемостью вследствие анемии, может появляться повышенная кровоточивость из десен или из носа, появление синяков. В принципе, эти симптомы характерны для всех гематологических болезней, которые связаны с поражением костного мозга.
Насколько должны быть повышены лейкоциты, чтобы заподозрить ХМЛ?
На сегодняшний день норма лейкоцитов составляет от 4 до 9 на десять в девятой степени в литре. Но нужно понимать, что эти цифры зависят от многих факторов: перенесенная инфекция, операция. Только по количеству лейкоцитов никто не скажет, что у вас лейкоз — в любом случае необходимо будет провести дополнительное обследование. Если повышенный лейкоцитоз 10-11 проявляется однократно — это еще не повод бежать к гематологу, так как это может быть вполне нормальная реакция организма на перенесенную вирусную или бактериальную инфекцию. Но если в течение трех месяцев наблюдается лейкоцитоз выше 15, то это повод обратиться к гематологу. Мы рекомендуем наблюдать за показателями крови и сдавать анализы хотя бы раз в год, чтобы вовремя выявить сбой и начать лечение, если оно необходимо.
Можно ли говорить о том, что кто-то находится в зоне риска? Есть ли предрасположенность? Влияет ли экология?
Наследственность здесь не играет абсолютно никакой роли. Если у родителей был ХМЛ, то далеко не факт, что он будет у детей: наследственная теория пока не нашла подтверждения. То же самое касается всех остальных существующих теорий: вирусной, бактериальной.
Не так давно произошла ужасная история, когда больных лейкозом детей выселяли из квартир, потому что жители дома считали, будто рак может передаваться воздушно-капельным путем. Это, разумеется, не так: онкологические заболевания не передаются таким способом. Если бы онкологические болезни передавались воздушно-капельным путем, то я и другие врачи-онкологи уже, наверное, поумирали бы: своего первого онкологического пациента я увидел на третьем курсе, за 15 лет практики я повидал их тысячи и пока, к счастью, жив, здоров и не имею никакого онкологического диагноза.
После получения ионизирующего излучения риск действительно повышается: после Чернобыля, Хиросимы и Нагасаки отмечался всплеск развития острых лейкозов. Это подтвержденный факт, но наследственность на возникновение лейкозов никаким образом не влияет. Другие теории пока тоже не нашли подтверждения. Врачи, к сожалению, пока не выявили причину.
Можно сказать, что ХМЛ — это несчастный случай, как кирпич на голову?
Да, это именно так. Я сейчас сижу перед вами, а вы сидите за своими гаджетами, и внутри каждого организма прямо в это время происходит энное количество мутаций. Это случается, пока мы спим, едим, идем по улице. Пока наша иммунная система справляется с возникающими мутациями, все хорошо. Когда возникает сбой и система перестает справляться, начинает развиваться опухолевый процесс. В случае с гематологическими болезнями, для этого достаточно мутации одной клетки. И это действительно, как кирпич на голову. Хронический лейкоз возникает спонтанно, мы не можем его спрогнозировать.
Как строится лечение при ХМЛ?
В первой линии терапии назначается Иматиниб. Если до 1999-го года после постановки диагноза пациенты проживали 3-4 года, то сегодня можно говорить о 20-летней выживаемости. Пациенты с ХМЛ продолжают жить полноценной спокойной жизнью и умирают также, как их сверстники от сердечно-сосудистых заболеваний, сахарного диабета и так далее. Лечение Иматинибом происходит амбулаторно. Пациент получает препарат в аптеке, принимает дома и живет, в общем, как совершенно обычный человек. Помимо Иматиниба, существуют препараты второго и третьего поколения. И даже уже четвертого, они пока проходят клинические исследования.
Можно ли беременеть при ХМЛ?
При лечении новыми препаратами, которые проходят клинические исследования, необходимо применять контрацептивы, потому что мы пока не знаем, как эти новые лекарства могут повлиять на плод. В случае с уже хорошо известными, необходимо принимать решение совместно с лечащим врачом, гематологом и гинекологом, ведущим беременность. Например, у Екатерины Юрьевны Челышевой, которая работает в НМИЦ гематологии, огромный опыт и большой регистр пациенток с хроническим миелолейкозом, которые забеременели и родили здоровых детишек. Если ситуация позволяет безопасно отменить терапию на время зачатия и хотя бы первый триместр, необходим ежемесячный мониторинг. Если мы видим, что молекулярный ответ потерян, то по жизненно важным показаниям терапию придется вернуть.
Полная отмена происходит, к сожалению, не так быстро, как нам хотелось бы. В случае с ингибиторами тирозинкиназы первого поколения – чуть дольше. Со вторым поколением – чуть раньше: примерно от трех до пяти лет постоянного приема. Достигаем молекулярного ответа, отменяем терапию, и там — пожалуйста. Снимаем ограничения в плане беременности и вообще, в принципе, большинство ограничений. Это обычный выздоровевший человек, излеченный от онкологического заболевания. Беременеть – можно. Единственное, что требуется — постоянный мониторинг со стороны именно гематолога.
Лечение препаратами второго и последующих поколений позволяют сохранить репродуктивные функции, хотя раньше это казалось нонсенсом. Сейчас даже в рекомендациях по лечению онкологических заболеваний рекомендовано обсудить с пациентами их репродуктивные планы, и только после этого назначать препарат. Сегодня существуют препараты, которые не так сильно влияют на фертильность, и у женщины остается возможность забеременеть и выносить здорового ребенка. Сейчас сохранение репродуктивных функций является нормой и одной из целей при лечении больных с ХМЛ. Это ли не счастье?
Есть ли какие-то ограничения, которые накладывает ХМЛ или их нет? Какова жизнь при ХМЛ и после ХМЛ, если мы добиваемся полной ремиссии и прекращаем лечение препаратами?
Я так радужно говорю о том, что все победили, все выиграли, но чтобы этого добиться, необходимо тесное сотрудничество между лечащим врачом и самим пациентом. Какие-либо изменения в жизни необходимо обсуждать с лечащим врачом, нельзя принимать решения самостоятельно — только после консультации с лечащим врачом.
Единственное строгое ограничение, которое действительно существует, — это употребление грейпфрутового сока. Это категорически запрещено. Если упростить, грейпфрутовой сок влияет на усваиваемость препаратов с ингибиторами тирозинкиназы, и они становятся неэффективными: то есть, ты принимаешь лекарство, а оно не действует так, как должно. Также существует ряд препаратов, которые могут усиливать эффект препаратов или снижать его, поэтому перед началом лечения у гематолога необходимо сообщить о всех лекарствах, которые вы принимаете постоянно. Если длительность приема препаратов не превышает неделю, то это ни на что не влияет, но если терапию назначают на постоянной основе, то может возникнуть конфликт. Особенно это касается гипотензивных препаратов для нормализации давления.
Если говорить о спорте, то можно постепенно возвращаться к нему после того, как всё — размеры селезенки, анализ крови, общее самочувствие — нормализуется. Умеренные физические нагрузки — это пожалуйста. Наши коллеги из США недавно провели исследования, которые доказали, что занятия йогой, дыхательные упражнения, цигун позитивно сказываются на качестве жизни пациентов с миелопролиферативными заболеваниями.
Можно ли ездить на море, проходить санаторно-курортное лечение?
Этот вопрос до конца неясен. Раньше каждый онкологический диагноз ставил крест на любой физиотерапии, любом санаторно-курортном лечении. Сейчас единственное, что я запрещаю всем, и не только своим пациентам, но и здоровым здоровым людям – избегать повышенного излучения солнечных лучей. В море купайтесь, сколько влезет, но от солнца следует закрываться. И мы сейчас говорим не только о тех, кто находится в ремиссии, но и о тех, кто находится на лечении, принимает медикаменты. Если чувствуете себя хорошо, анализ крови нормальный, то море — пожалуйста. Но вот активного солнца следует избегать — это пагубно сказывается на всех без исключения. Повышенное воздействие солнечных лучей, ультрафиолета повышает риск развития меланомы. Это доказано.
Можно ли полностью вылечить ХМЛ?
Хронический миелолейкоз — это заболевание, с которым можно жить, и мы этому учим. Существуют школы для диабетиков, школы для больных с артериальной гипертензией, а мы теперь проводим школы для больных с хроническим миелолейкозом: читаем лекции, консультируем больных, образовываем, чтобы они знали про болезнь больше, чем мы. При ХМЛ необходимо мониторить свое состояние и раз в полгода сдавать контрольные анализы. Сейчас проводятся общемировые исследования по поводу возможности полной отмены терапии. Примерно половине пациентов терапию отменяют. В другой половине случаев в течение первого полугода, к сожалению, приходится вернуться к терапии, потому что возникает рецидив. Все очень индивидуально.
Миелолейкоз – заболевание, имеющее прямое отношение к онкологии, заключается в поражении клеток крови. Миелоидный лейкоз действует на стволовые клетки костного мозга. Код по МКБ-10 у болезни C92. Патология распространяется стремительно, поэтому уже через некоторое время поражённые элементы прекращают выполнять функции. Способен продолжительное время протекать, не показывая симптомов. По статистике выявляется чаще у людей от 30 лет.
Причины
Как все онкологические заболевания, атипичный лейкоз не изучен. Сейчас исследователи, медики предполагают о возможных причинах возникновения патологии:
- распространённой теорией считается воздействие химических препаратов на человека;
- бактериальные заболевания;
- длительное воздействие веществ аренов;
- побочные действия от лечения опухолей;
- результат иного онкологического заболевания.
Учёные активно раскрывают возможные пути появления болезни, чтобы впоследствии изучить и искоренить нарушение.
Факторы риска
Ряд обстоятельств способен ощутимо повлиять на возникновение онкологии, а именно:
- воздействие радиации;
- пол;
- возраст.
Две трети факторов невозможно изменить, но постараться избежать первого – вполне осуществимо.
Виды
Работники медицины различают две видовые группы миелолейкоза.
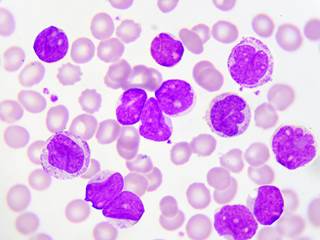

Клетки крови при миелолейкозе
Острый
При обостренной форме онкологии происходит заражение клеток, не поддающееся контролю. В короткий срок здоровая клетка заменяется поражённой. Своевременное лечение поможет продлить жизнь человека. Его отсутствие ограничивает существование человека сроком до 2 месяцев.
Первый симптом острого миелолейкоза может не вызвать тревожности, но полагается обратиться к врачу за вердиктом. Онкологические симптомы миелолейкоза проявляются одновременно либо нарастают постепенно.
Острый миелобластный синдром и симптомы:
- боли в костях и суставах;
- носовые кровоизлияния;
- повышенное выделение пота во время сна;
- сбои в кровотечении, что является причиной бледности кожи;
- частые заражения;
- воспаление дёсен;
- появление гематом по площади тела;
- проблемы с дыханием даже при низком уровне физической активности.
Проявление двух и более симптомов свидетельствует о серьёзных сбоях в организме, рекомендуется посетить поликлинику. Назначение своевременного лечения поможет сохранить жизнь.


Острый миелолейкоз обнаруживает классификацию, включающую массу факторов и причин, обособленных в группы:
- примитивные изменения в генах;
- изменения на почве нарушения развития тканей, органов;
- следствие иных заболеваний;
- синдром Дауна;
- миелоидная саркома;
- лечение, диагностика, симптомы и признаки могут различаться.
Хронический лимфоцитарный лейкоз
В этом случае учёными установлена связь, определяющая причину возникновения болезни и нарушения в генетической составляющей человека. Лимфолейкоз действует только на стволовые клетки, способные неограниченно делиться. Мутации происходят в новых клетках, так как за счёт незакончившегося формирования в них легче проникнуть. Здоровая кровяная клетка постепенно преобразовываются в лейкоцит. После скапливаются в костном мозге и уже оттуда циркулируют по телу, медленно заражая органы человека. Хронический миелолейкоз (ХМЛ) способен перейти в острый лимфобластный лейкоз.
Этапы хронического миелолейкоза:
Первый этап. Болезнь нарастает постепенно. Характеризуется увеличением селезёнки, вторичными признаками миелолейкоза: увеличивается уровень зернистых лейкоцитов, а также безъядерных элементов в периферической крови. Симптомы первого этапа хронического миелолейкоза можно сопоставить с симптомами при остром миелолейкозе: появляется одышка, тяжесть в желудке, потливость. Серьёзные ощущения, свидетельствующие об усилении онкологии:
- боль под рёбрами, перетекающая в боль спины;
- истощение организма.
На фоне этого может развиться инфаркт селезёнки, а после появятся проблемы с печенью.


Второй этап хронической онкологии характеризуется ускоренным развитием живой злокачественной опухоли. Начальная стадия болезни не показывается либо выражается в крайне малой степени. Для такого состояния характерны:
- повышение температуры тела;
- анемия;
- быстрая утомляемость;
- также продолжает увеличиваться количество белых кровяных клеток;
- помимо лейкоцитов увеличиваются и другие кровяные клетки.
Прогностические результаты и оперативное прохождение нужных процедур приводят к тому, что в крови обнаруживаются компоненты, которых не должно быть при нормальном развитии организма. Повышается степень несозревших лейкоцитов. Это влияет на периодический зуд кожного покрова.
Третья (заключительная) стадия характеризуется патофункциональными изменениями, при которых происходит кислородное голодание каждой части человеческой ткани, а также нарушение внутреннего обмена веществ. Больше кислородным голоданием страдают клетки мозга. Наиболее серьезные проявления терминальной стадии:
- суставные боли;
- усталость;
- повышение температуры до 40 градусов;
- резко снижается масса больного;
- инфаркт селезенки;
- позитивный pH.
Среди дополнительных симптомов отмечают проблемы с нервными окончаниями, изменения внутренней составляющей крови. Продолжительность жизни при данной стадии болезни зависит от используемых препаратов и терапии.
Диагностика
Современные методы преуспевают в вычислении онкологических заболеваний. Распространенные, стандартные процессы, которые позволяют выявить у человека злокачественный элемент клетки крови:


- Проводится ОАК. Благодаря этой процедуре устанавливается степень общего количества клеток. Что это дает? У пациентов, страдающих миелолейкозом, увеличивается количество незрелых клеток, а также зафиксировано снижение количества эритроцитов и тромбоцитов.
- Биохимический анализ крови позволяет выявить перебои в функционировании печени и селезенки. Такие неполадки спровоцированы проникновением в органы лейкозных клеток.
- Забор тканей и клеток, а также проникновение инородных тел в костный мозг. Эти две процедуры проводятся в одно время. Прототипы мозга берутся из бедренной кости.
- Метод исследования генетики и развития человека посредством исследования хромосом. В структуре генов человека при болезни онкологией содержатся лейкозные клетки, именно они позволяют обнаружить острый миелоидный лейкоз.
- Смешение разных орбиталей атома молекулы. Таким методом изучают хромосомы, при болезни онкологией находится аномальная.
- Миелограмма показывает статистику костного мозга в виде таблицы.
- Гемограмма позволяет обследовать пациента и точно установить диагноз. Для нее характерно быстрое распределение компонентов, развернутый метод установление локализации.
Применяются и стандартные методы диагностики: МРТ, УЗИ и т.д. Они не могут обещать больному выявления точного диагноза или стадии.
Лечение
Так как есть отличия между симптомами хронического и острого заболевания, следовательно, и лечение предусмотрено разное.
Лечение хронического миелолейкоза
Фазы разделяют степени поражения организма человека, поэтому лечение предусматривается в зависимости от этапа болезни. При хроническом или неактивном этапе рекомендуется соблюдать общие нормы лечения, вести здоровый образ жизни, питание должно быть насыщено витаминами. Отдых на этом этапе сопоставляется труду, количество витаминов также прописывается.


Если уровень лейкоцитов продолжает увеличиваться, замечаются осложнения, больным прописывают цитостатические медикаменты. После прохождения курса лечения лекарственным препаратом поддерживается терапия, которая направлена на восстановление правильного функционирования селезёнки. Радиотерапия используется, когда селезёнка не приняла первоначальный облик. После чего курс лечения прерывается сроком на 31 день, затем повторяется, проводя восстанавливающую терапию.
Фаза кислородного голодания чаще всего практикует один, реже два химических препарата. Чаще ими являются специализированные препараты, в которых заложены некоторые группы витаминов, способствующие поддержанию здоровья и жизни в человеке. Принцип применения такой же, как и в неактивной фазе: сначала проводится эффективная терапия, а затем поддерживающее применение. Курсы внутривенного введения химических препаратов проводятся от трех раз в год. Если методика не срабатывает, проводится процедура разделения крови на плазму и иные составляющие. При симптомах ХМЛ применяются переливания донорской крови, в состав которой входят непосредственно клетки, плазма, а также примеси эритроцитов и тромбоцитов. Радиотерапию вводят при значительных величинах злокачественной опухоли.
Гарантию на выздоровление 70% страдающих миелолейкозом получили при пересадке костного мозга. Данная процедура проводится на начальном этапе недомоганий. И может быть следствием удаления селезенки. Этот орган может быть «убран» двумя путями: незапланированный заключается в разрыве селезенки, а основной зависит от ряда факторов. Костный мозг для пересадки должен быть идентичен мозгу больного.
Лечение острого миелолейкоза
Химиотерапию принято считать фундаментом лечения при миелолейкозе. Процесс разделяется на две части: до ремиссии и после неё. Следует помнить о мерах безопасности. После химиотерапии может наступить рецидив либо инвалидность.
Какие клинические рекомендации прослеживаются? На индукционной ступени лечения проводится комплекс мероприятий, направленных на устранение причин и симптомов заболевания, удаление ненужных лейкозных клеток. Консолидационные мероприятия устраняют возможности рецидива, поддерживают нормальное состояние человека. Классификация влияет на принцип лечения ОМЛ, возраст, пол, индивидуальную переносимость и возможности.

Распространение получила методика внутривенного введения цитостатического препарата. Процесс продолжается в течение недели. Первые три дня сочетаются с иным медикаментом группы антибиотиков.
Когда присутствует риск развития телесных заболеваний либо инфекционных, применяется менее интенсивная процедура, суть которой состоит в создании комплекса мероприятий для больного. Сюда входит хирургическое вмешательство, психотерапевтическая помощь больному и т. д.
Индукционные мероприятия дают положительные результат более чем у 50% больных. Отсутствие второй степени консолидации приводит к рецидиву, поэтому считается необходимым мероприятием. При возможности возвращения рака после стандартно-прописанных 3-5 процедур поддерживающей химиотерапии проводится пересадка костного мозга. Кроветворение способствует восстановлению организма. Для анализа требуется периферическая кровь. В Израиле показатели выздоровления от лимфолейкоза высоки за счет того, что неблагоприятные условия для человека ликвидируются сразу, опухолевый процесс спадает. Метод обнаружения бласт в периферической крови также используется и там.
Бластный криз – злокачественный процесс, считается заключающим. На данной стадии синдромы невозможно излечить, лишь поддерживать процессы жизнедеятельности, так как этиология и патогенез фазы до конца не изучены. Негативный опыт говорит о том, что лейкоциты превышают нужный объём.
Прогноз острого миелолейкоза
Онкологи дают разную оценку выживаемости при ОМЛ, так как обуславливается некоторым количеством факторов, например, возраст, пол и другие. Стабильная оценка классификаций ОМЛ показала, что средняя выживаемость разнится от 15 до 65%. Прогноз возвращения болезни от 30 до 80%.
Наличие телесных, инфекционных расстройств становится причиной худшего прогноза для людей пожилого возраста. Наличие параллельных недугов делает недоступной химиотерапию, так необходимую для лечения миелолейкоза. При гематологических заболеваниях картина выглядит гораздо неутешительнее, чем при возникновении злокачественной опухоли как результата сопутствующей болезни. Острый миелобластный лейкоз редко наблюдается у детей, чаще у взрослых.
Прогноз хронического миелолейкоза
Определяющей причиной положительного результата является момент начала лечения. От продолжительности и вероятности вылечить рак зависят последующие факторы: величина расширения печени, селезёнки, количество безъядерных элементов крови, белых кровяных клеток, незрелых клеток костного мозга.
Возможность летального исхода растёт вместе с количеством признаков, определяющих развитие онкологии. Частой причиной смерти становятся сопутствующие инфекции или подкожные кровоизлияния частей тела. Средняя продолжительность жизни – два года. Оперативное определение и лечение болезни способно умножить этот срок в десяток раз.
Медикаментозное лечение:
Лечение до установления окончательного клинического диагноза:
В период обследования, до получения результатов цитогенетического исследования, подтверждающих наличие Ph+хромосомы в клетках костного мозга, больному назначается циторедуктивная терапия препаратом –гидроксикарбамид, с целью снижения уровня лейкоцитов и/или тромбоцитов (УД – D). Доза препарата определяется с учетом количества лейкоцитов и веса больного. При лейкоцитозе более 100 х109/л гидроксикарбамид назначают в дозе 50 мкг/кг ежедневно. В дальнейшем при снижении количества лейкоцитов в крови дозу гидроксикарбамида уменьшают: при лейкоцитозе 40–100 х109/л назначают 40 мг/кг, при 20-40 х 109/л – 30 мг/кг, при 5 – 20 х 109/л – 20 мг/кг ежедневно.
При наличии клинических признаков лейкостаза с нарушениями микроциркуляции (энцефалопатия, снижение зрения, почечная недостаточность) показан лейкоферез. Для профилактики осложнений, связанных с синдромом лизиса опухоли в период циторедукции, обязательно введение адекватного объема жидкости (до 2-2,5 л/м2 поверхности тела при отсутствии сердечной недостаточности), аллопуринола в дозе 300-600 мг/сут. (УД – D).
После подтверждения диагноза ХМЛ показано назначение ИТК.
Проводить лечение возможно в амбулаторных условиях, терапию ИТК можно начинать при любом количестве лейкоцитов (УД – А).
Принципы выбора ИТК
При использовании препаратов ИТК улучшились показатели общей выживаемости, достижение хорошего качества жизни, восстановления нормального кроветворения, путем подавления лейкозного клона.
Эффективность иматиниба доказана положительным опытом применения в клинических исследованиях (IRIS, CML IV). Однако, резистентные к лечению иматинибом и подобными препаратами больные ХМЛ нуждаются в раннем переводе на другую терапию.
Необходимо отметить, что абсолютных противопоказаний к использованию ИТК у пациентов с ХМЛ нет. При выборе конкретного препарата в первую и последующие линии лечения необходимо учитывать фазу ХМЛ, сопутствующие заболевания и риск развития побочных эффектов в процессе терапии, а также мутационный спектр.
Выбор терапии ИТК первой линии у пациента должен основываться на оценке риска, профиле токсичности ИТК, возрасте пациента, способности переносить терапию и наличии сопутствующих заболеваний.
Терапия ИТК первой и второй линии должна быть выбрана с учетом наибольшей эффективности и наименьшего риска побочных явлений. Аллогенная трансплантация гемопоэтических стволовых клеток должна быть обязательно рассмотрена для ХМЛ ХФ с высокой группой риска прогрессии, у больных с неудачей терапии первой линии, а также в продвинутых фазах ХМЛ, но в гематологической ремиссии. Ранняя оценка ответа на лечение, предупреждение развития резистентности и быстрое переключение на максимально эффективную терапию при отсутствии оптимального ответа должны быть основаны принципами современной терапии ХМЛ (УД – А).
Иматиниб (50 мг, 100мг, 200 мг, 400 мг таблетка/капсула).
Противоопухолевое средство, ингибитор протеинтирозинкиназы (BCR-ABL1 тирозинкиназы) — аномального фермента, продуцируемого филадельфийской хромосомой при хроническом миелолейкозе. Подавляет пролиферацию и индуцирует апоптоз BCR-ABL1 -позитивных клеточных линий, а также молодых лейкозных клеток с положительной филадельфийской хромосомой при хроническом миелолейкозе (ХМЛ). После приема внутрь иматиниб хорошо абсорбируется, биодоступность — 98%. Начальная доза составляет 400 мг/сут для ХФ, ежедневно, длительно, однократно в сутки; для ФА и БК 600 мг/сут у взрослых. Препарат следует принимать во время еды, запивая полным стаканом воды. Показанием для повышения дозы является неудача лечения (до 600 мг/сут в ХФ и 800 мг/сут для ФА и БК). Снижение дозы необходимо проводить при развитии токсичности (до 300 мг/сут в ХФ и 400 мг/сут для ФА и БК).
Во французском исследовании SPIRIT сообщалось о более высоких показателях БМО (большой молекулярный ответ) у пациентов, получавших лечение иматинибом по 600 мг в сутки по сравнению с 400 мг/сут.49 Эти данные предполагают, что иматиниб по 600 мг/сут возможно ближе к оптимальной дозе, чем 400 мг, и ее следует использовать в качестве компаратора в проспективных исследованиях эффективности [15].
Нилотиниб (150 мг, 200мг, таблетка/капсула).
Противоопухолевый препарат, ингибитор протеин-тирозинкиназы. Нилотиниб мощно ингибирует тирозинкиназную активность BCR-ABL1 онкопротеина клеточных линий и первично положительных по филадельфийской хромосоме (Ph-положительных) лейкозных клеток. Оказывает выраженное ингибирующее влияние на BCR-ABL1 онкопротеин дикого типа, а также демонстрирует активность в отношении 32 и 33 основных иматинибрезистентных мутантных форм BCR-ABL1-тирозинкиназы, за исключением Т3151 мутации.
В первой линии терапии показан больным ХФ ХМЛ в начальной дозе 600 мг/сут и в ФА ХМЛ в дозе 800 мг/сут. Во второй линии терапии назначается в дозе 800 мг/сут в ХФ и ФА. Независимо от фазы ХМЛ принимается 2 раза в сутки в равных дозах с интервалом 12 часов. Прием рекомендуется осуществлять натощак или не ранее чем через 2 часа после еды, после приема нилотиниба пищу следует принимать не ранее чем через 1 час. Капсулы запивать достаточным количеством воды. При развитии токсических проявлений доза может быть снижена до 400 мг 1 раз в сутки. При недостаточной эффективности препарата возможно повышение дозы до 800 мг в сутки больным в ХФ.
С осторожностью применять при панкреатите в анамнезе, сахарном диабете, атеросклерозе сосудов, окклюзионной болезни периферических артерий.
Дазатиниб (20 мг, 50 мг, 70 мг, 100 мг, таблетка/капсула).
Противоопухолевое средство, многоцелевой препарат, ингибитор протеинтирозинкиназ: BCR-ABL1, семейство SRC (SRC, LCK, YES, FYN), c-KIT, EPHA2 и PDGFR бета. Связывается со многими формами ABL киназы, активен в лейкозных клеточных линиях, как чувствительных, так и резистентных к иматинибу. Дазатиниб подавляет активность не только ABL-тирозинкиназы, c-Kit- и PDGFR-киназ, но и активность около 30 других различных киназ: семейства SRC (SRC, LCK, YES, FIN), семейства TYR и SER/THR (GAK, MAPK14, MAP3K, MAP3K4), DDR1, EPHA, ZAK и др., может связываться как с активной, так и неактивной конформацией киназного домена ABL. Активен в отношении мутантных форм BCR-ABL-тирозинкиназы, за исключением T315I. Рекомендуемая доза дазатиниба для ХФ составляет 100 мг/сут, а для ФА и БК – 140 мг/сут. При явлениях токсичности доза дазатиниба больным в ХФ может быть снижена до 80 мг 1 раз в сутки, больным в ФА и БК – до 100 мг 1 раз в сутки, при повторных эпизодах токсичности – до 80 мг/сут. При недостаточной эффективности препарата возможно повышение дозы до 140 мг 1 раз в сутки больным в ХФ. С учетом фармакокинетики Дазатиниб характеризуется приемом, вне зависимости от приема пищи. Показана возможность Дазатиниба проникать через гематоэнцефалический барьер.
С осторожностью применять при хронических сердечно-сосудистых заболеваниях, хронических обструктивных заболеваниях легких, бронхиальной астме, пневмонии, травма грудной клетки, хронических заболеваниях ЖКТ с высоким риском развития кровотечений.
Рекомендации по лечению ХМЛ.
Хронический миелолейкоз
Хронический миелолейкоз — это злокачественное заболевание крови, при котором происходит избыточное образование и нарушение созревания гранулоцитов в костном мозге. Уникальной особенностью данного вида лейкоза является наличие в опухолевых клеток специфического маркера — филадельфийской хромосомы. Она образуется в результате транслокации t(9;22), при которой один фрагмент 22 хромосомы меняется местами с фрагментом девятой хромосомы. В итоге образуется химерный ген, который нарушает процесс деления и созревания клеток миелоидного ряда.
Причины развития хронического миелолейкоза
Причиной развития хронического миелолейкоза является та самая мутация, которая приводит к образованию филадельфийской хромосомы. Ее обнаруживают у 90-95% больных. Но вот что становится причиной ее образования до сих пор неизвестно.
Из эпидемиологических данных известно, что заболевание чаще развивается у пожилых людей, преимущественно мужчин. Дети страдают крайне редко, на их долю приходится около 2% всех случаев хронического миелолейкоза.
Патогенез хронического миелолейкоза
Филадельфийская хромосома является результатом взаимной транслокации между 9 и 22 хромосомами. При этом онкоген ABL из 9 хромосомы переносится на 22 хромосому и присоединяется к гену BCR. В результате образуется гибридный BCR-ABL ген, который регулирует синтез особого онкогенного белка — тирозинкиназы bcr-abl. Этот онкопротеин нарушает процесс клеточного деления, защищает опухолевые клетки от запрограммированной гибели (апоптоза) и нарушает их сцепление со стромой костного мозга, благодаря чему недозревшие клетки выходят в кровяное русло.
Чаще всего хронический миелолейкоз развивается в результате мутации в плюрипотентной гемопоэтической стволовой клетке, которая располагается в костном мозге, но есть случаи, когда первичный очаг находится в печени или селезенке.
При хроническом миелолейкозе в основном преобладает патология гранулоцитарного ростка, но могут страдать все линии гемопоэза — эритроцитарный росток, моноциты и др. Здоровые стволовые клетки сохраняются и могут давать начало новому кроветворению после проведения химиотерапии.
Стадии хронического миелолейкоза
В течении хронического миелолейкоза выделяют 4 стадии, которые отражают прогрессирование патологии. При этом заболевание может быть выявлено на любой из них.
Хроническая или доклиническая стадия — не имеет клинических симптомов, диагноз можно заподозрить по общему анализу крови, который пациенты могут сдавать либо в рамках диспансеризации, либо по поводу диагностики другого заболевания. В большинстве случаев хронический миелолейкоз выявляется именно на этой стадии.
Фаза акселерации, или стадия прогрессирования. В этот период нарастает количество опухолевых гранулоцитарных клеток, появляются различные симптомы, например, слабость или боли в костях. Объективно отмечается увеличение количества бластов в крови или костном мозге до 15-29%, увеличивается количество базофилов (более 20%), обнаруживается тромбоцитопения или
тромбоцитоз (более 1000×10 9 ).
Бластный криз — это фаза, во время которой происходит резкое увеличение количества бластных клеток (больше 30%) и болезнь по своему течению напоминает агрессивный острый лейкоз.
Пациент при этом находится в тяжелом состоянии. Отмечается повышение температуры, упорные инфекции, кровотечения, лейкозные поражения кожи. На этой стадии лейкоз с трудом поддается терапии.
Фазу хронического миелолейкоза обязательно оценивают при постановке диагноза и далее перепроверяют при прогрессировании патологии и необходимости смены лечения.
Симптомы и признаки хронического миелолейкоза
Симптоматика хронического миелолейкоза характеризуется многообразием клинических проявлений и зависит от агрессивности течения и стадии заболевания. В целом может иметься несколько синдромов:
- Синдром опухолевой интоксикации. Проявляется неадекватной текущему состоянию слабостью, потерей веса, снижением аппетита. Может быть повышение температуры, повышенная потливость, зуд кожи, боли в костях.
- Синдром опухолевой пролиферации. Развивается при активном увеличении количества злокачественных клеток, инфильтрирующих печень и селезенку. При этом пациенты отмечают боль и тяжесть в левом боку.
- Анемический синдром — развивается при снижении количества эритроцитов и уровня гемоглобина. Проявляется слабостью, одышкой, повышенной утомляемостью при рутинных физических нагрузках. Может наблюдаться снижение давления, бледность кожи и слизистых, головокружение, тахикардия.
- Нарушения со стороны кровесвертывающей системы — тромбозы и геморрагии (кровотечения). Причиной тромбозов чаще всего оказывается тромбоцитоз (повышение уровня тромбоцитов выше 1000×10 9 /л). При этом могут возникать тромбофлебиты, инфаркты, инсульты. Геморрагические проявления характеризуются увеличением времени кровотечения после травмы, а также образованием петехиальной геморрагической сыпи. Развиваются они на фоне критического снижения уровня тромбоцитов.
Диагностика хронического миелолейкоза
В большинстве случаев хронический миелолейкоз является случайной находкой, которая обнаруживается при обследовании по другому поводу. Заподозрить его можно по общему анализу крови, в частности по увеличению количества лейкоцитов и преобладанию в формуле гранулоцитарного ростка кроветворения. При этом может увеличиваться не только количество нейтрофилов, но и базофилов с эозинофилами. Может быть умеренная анемия или отклонения в количестве тромбоцитов.
Если врач подозревает хронический миелолейкоз, пациента направляют на дальнейшее обследование — пункцию и биопсию костного мозга. Для подтверждения диагноза необходимо проводить стандартное цитогенетическое исследование костного мозга на предмет наличия филадельфийской хромосомы. Исследуется не менее 20 метафаз. При невозможности проведения цитогенетики, прибегают к флюоресцентной in situ гибридизации, с помощью которой выявляют химерный ген. Также определяется экспрессия химерного гена в клетках периферической крови посредством ПЦР. Если типичный транскрипт не обнаруживается, а при этом есть клинико-гематологические признаки хронического миелолейкоза, показано определение более редких мутаций — BCR-ABLp190, р230.
В фазе бластного криза проводят иммунофенотипирование бластных клеток, цитологическое и биохимическое исследование спинномозговой жидкости. При обнаружении хронического миелолейкоза в фазе активации или бластного криза, поиск филадельфийской хромосомы может осуществляться посредством секвенирования генетического материала клеток крови.
Лечение хронического миелолейкоза
На начальном этапе, до получения цитогенетического подтверждения диагноза (как мы уже знаем, хронический миелолейкоз выставляется при наличии филадельфийской хромосомы), назначается симптоматическая терапия гидроксимочевиной. Ее целью является снижение общего уровня лейкоцитов и тромбоцитов. При непереносимости препарата или недостаточном снижении уровня тромбоцитов может применяться анагрелид. Если имеются признаки лейкостаза (энцефалопатия, зрительные нарушения, нарушения работы почек), проводится лейкаферез.
После цитогенетического подтверждения диагноза, назначается специфическая противоопухолевая терапия. Главными препаратами являются ингибиторы тирозинкиназ (ИТК). Дозировка подбирается в зависимости от уровня лейкоцитов. На начальном этапе для профилактики синдрома лизиса опухоли необходима усиленная гидратация (дополнительное введение жидкости в объеме 2-2,5 л/м 2 , если нет противопоказаний со стороны сердечно-сосудистой системы) и назначение аллопуринола.
Целью специфического лечения хронического миелолейкоза является подавление опухолевого клона клеток, снижение риска прогрессирования патологии и продление жизни пациента до значений, сопоставимых с общепопуляционными показателями. С внедрением в практику ИТК эти задачи стали вполне выполнимы и не только позволили повысить общую выживаемость таких больных в несколько раз, но и оказаться от пожизненного приема препаратов и перехода под динамическое наблюдение у пациентов с хорошим молекулярным ответом опухоли.
В настоящее время согласно принятым протоколам лечения, ИТК должны назначаться всем больным с впервые выявленным хроническим миелолейкозом. В основе механизма их действия лежит блокада АТФ-связывающего кармана патологической молекулы BCR-ABL, что лишает этот белок тирозинкиназной активности, которая стимулирует избыточное деление опухолевых клеток. При постоянном приеме ИТК, опухолевый клон подвергается редукции, что дает возможность восстановлению нормального кроветворения.
В России для терапии первой линии зарегистрированы следующие препараты из группы ИТК:
- Иматиниб.
- Нилотиниб.
- Дазатиниб.
Иматиниб
Иматиниб обладает избирательной активностью в отношении BCR-ABL тирозинкиназы и некоторых других тирозинкиназ. Назначается длительными курсами и должен приниматься ежедневно. Первоначальная дозировка составляет 400 мг в сутки при хронической фазе миелолейкоза, и 600 мг/сут при фазе акселерации или бластном кризе. Дозировка не зависит от роста, пола и массы тела пациента. Препарат выпускается в таблетированной форме или капсулах. Может применяться в амбулаторных условиях. При неудовлетворительном результате терапии, дозировка может быть увеличена, при развитии токсических осложнений — снижена.
Нилотиниб
Нилотиниб — высокоселективный ингибитор BCR-ABL тирозинкиназы. Был разработан на основе молекулы иматиниба и модифицирван для увеличения сродства к BCR-ABL тирозинкиназой. Выпускается в капсулах. Дозировка при терапии хронической фазы составляет 600 мг/сут, при терапии фазы акселерации — 800 мг/сут. Препарат принимают 2 раза в сутки с интервалом в 12 часов строго натощак, поскольку еда увеличивает биодоступность препарата, что повышает его концентрацию в плазме и может спровоцировать развитие токсических осложнений. При недостаточном терапевтическом эффекте в лечении хронической фазы, возможно увеличение дозировки до 800 мг/сутки. При развитии осложнений, дозу снижают.
Дазатиниб
Дазатиниб обладает активностью ко многим тирозинкиназам, в том числе и к мутантной BCR-ABL. Проникает через гематоэнцефалический барьер. Выпускается в формах для перорального применения. Рекомендуемая дозировка составляет 100 мг/сутки для хронической фазы и 140 мг/сут для фазы акселерации и бластного криза. При недостаточной эффективности терапии хронической фазы возможно увеличение дозировки до 140 мг/сут. При развитии токсических осложнений ее снижают до 80 мг/сутки.
Босутиниб
Босутиниб — относительно новый препарат, в России зарегистрирован в 2014 году и применяется для терапии второй и последующих линий при непереносимости или неэффективности вышеперечисленных препаратов. Стандартная суточная доза составляет 500 мг, при необходимости может быть увеличена до 600 мг.
Выбор препарата первой линии проводится индивидуально для каждого пациента. При этом учитывается фаза лейкоза, чувствительность опухолевого клона с отдельными мутациями, профиль токсичности каждого препарата и наличие у пациента сопутствующих заболеваний.
Определение спектра мутаций проводится при манифестации патологии с фазу акселерации или бластного криза, либо при неэффективности терапии выбранным препаратом и необходимости смены препарата, поскольку здесь есть вероятность возникновения резистентных клонов. Например, мутации F317L/V, T315A, V299L обуславливают низкую чувствительность к дазатинибу, поэтому его меняют на нилотиниб. Мутации Y253H, E255K/V, F359V/C, наоборот, делают опухолевые клетки резистентными к нилотинибу, поэтому таким пациентам показан дазатиниб.
Мутации E255K/V, G250E, V299L обуславливают устойчивость к босутинибу. Наличие мутации Т3151 определяет устойчивость ко всем видам ИТК, поэтому таким пациентам рекомендуется аллогенная трансплантация гемопоэтических стволовых клеток. Также возможен вариант терапии понатинибом, но он пока не зарегистрирован в России.
Эффект терапии первой линии может быть отнесен к одной из трех групп:
- Оптимальный ответ. Это хороший результат, который позволяет надеяться на длительный период безрецидивной выживаемости (7-8 и более лет). Критерием достижения оптимального ответа является полный гематологический ответ в течение 3 месяцев, полный цитогенетический ответ в течение 6 месяцев и большой молекулярный ответ в течение 12-18 месяцев.
- Предупреждение. При наличии предупредительных факторов требуется тщательный мониторинг состояния больного и готовность к смене режима лечения. Факторами предупреждения является группа высокого риска хронического миелолейкоза, увеличение более, чем в 10 раз уровня транскрипции мутантного гена, наличие дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой.
- Неудача терапии. Сюда относят прогрессирование заболевания, возникновение новыхмутаций, появление дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой. Требуется смена терапии.
Другие методы лечения хронического миелолейкоза
Трансплантация донорских стволовых клеток показана пациентам с неэффективностью терапии второй линии и пациентам с мутацией T315I. Пациентам с непереносимостью ИТК и невозможностью проведения трансплантации возможно лечение с помощью гидроксимочевины, интерферонов и цитостатиков.
Прогноз и профилактика хронического миелолейкоза
Специфических методов профилактики не существует, поскольку неизвестны причины, из-за которых образуются мутации, вызывающие хронический миелолейкоз. Что касается прогноза, то здесь все зависит от возраста больного, ответа на лечение и возможности проведения аллогенной трансплантации. В целом ситуация довольно благоприятная и позволяет надеяться на продолжительность жизни, сопоставимую с общепопуляционными показателями. У некоторых больных возможно достижение стойкой ремиссии и отказ от пожизненного приема ИТК с регулярным динамическим наблюдением.
В Европейской клинике лечение миелолейкоза соответствует всем современным лечебным протоколам. В сложных случаях, решение принимает консилиум специалистов, а при достижении ремиссии, мы особое внимание уделяем регулярному наблюдению пациента, что также позволяет улучшать результаты лечения.
Запись на консультацию круглосуточно
Миелолейкоз
Миелолейкоз – это злокачественное заболевание крови и костного мозга, при котором образуется избыточное количество гранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников. Гранулоциты являются разновидностью лейкоцитов и отвечают за защиту организма от инфекций. При миелолейкозе они перестают выполнять свои функции и вытесняют из крови и костного мозга нормальные клетки крови, проникают в другие органы, нарушая их работу.
Существует множество разновидностей миелолейкоза, различаемых в зависимости от скорости развития патологического процесса, зрелости лейкозных клеток, изменений в хромосомах. Чаще всего выделяют два основных типа заболевания: острый миелобластный лейкоз и хронический миелоидный лейкоз.
При любом типе миелолейкоза применяется комплексное и достаточно длительное лечение. С каждым годом появляются все более эффективные методы терапии этого вида рака крови. Прогноз заболевания зависит от типа миелолейкоза, стадии болезни, на которой начато лечение, возраста пациента. В целом прогноз при остром миелолейозе благоприятный, особенно у детей. При хроническом миелолейкозе прогноз хуже, однако при своевременном начале лечения современные методы терапии позволяют надолго приостановить прогрессирование патологического процесса.
Синонимы русские
Лейкемия миелоидная, Ph-положительный хронический миелолейкоз, лейкоз гранулоцитарный, миелоидный лейкоз, миелолейкоз, миелоз, миеломная болезнь, острый миелобластный лейкоз, острый нелимфобластный лейкоз, острый нелимфобластный лейкоз у взрослых.
Синонимы английские
Childhoodacutemyeloidleukemia, adultacutemyeloidleukemia, acutemyeloidleukemia, acutemyeloblasticleukemia, acutegranulocyticleukemia, acutenonlymphocyticleukemia, chronicmyeloidleukemia, chronicgranulocyticleukemia.
Симптомы
Острый миелолейкоз обычно развивается стремительно – в течение нескольких недель. Его основными симптомами являются:
- слабость;
- раздражительность;
- головокружение;
- одышка;
- частые инфекционные заболевания;
- лихорадка;
- частые, длительные кровотечения, возможны сильные носовые кровотечения, кровоточивость десен;
- кровоизлияния в кожу и слизистые;
- болезненность, воспаление десен;
- тяжесть в животе;
- увеличение лимфатических узлов;
- головные боли, тошнота, рвота, судороги.
Хронический миелолейкоз развивается постепенно и проходит 3 стадии:
1) хроническая – симптомы обычно отсутствуют;
2) прогрессирующая – появляются слабость, боли в животе;
3) бластный криз – на этом этапе заболевание протекает со всеми симптомами острого миелолейкоза.
Общая информация о заболевании
Все клетки крови развиваются из единой стволовой клетки, которая затем дает начало миелоидным и лимфоидным стволовым клеткам. Из лимфоидных формируются лимфоциты, миелоидные дают начало предшественникам эритроцитов, тромбоцитов и миелобластам. Именно из миелобластов в результате цепочки последовательных делений формируются гранулоциты и моноциты.
Гранулоциты представляют собой разновидность лейкоцитов и называются так из-за своего вида – под микроскопом в них видны характерные темные гранулы, а также ядро, состоящее из нескольких сегментов. Существует несколько видов гранулоцитов – эозинофилы, базофилы и нейтрофилы. Моноциты также имеют сегментированное ядро, но их гранулы светлые. Основная задача гранулоцитов и моноцитов – борьба с вредными для организма чужеродными агентами (вирусами, бактериями).
При миелолейкозе костный мозг вырабатывает избыточное количество патологических гранулоцитов. Постепенно они вытесняют из крови и костного мозга нормальные клетки крови, что приводит к появлению характерных симптомов. При подавлении деления и роста эритроцитов возникают симптомы анемии – бледность, головокружение, слабость, – при подавлении роста тромбоцитов – нарушения свертываемости крови, частые кровотечения. Лейкозные клетки могут проникать в другие органы – печень, селезенку, лимфатические узлы, головной и спинной мозг, – вызывая нарушение их функций и характерные проявления. Патологические миелоидные клетки также могут образовывать скопления в надкостнице, средостении, органах желудочно-кишечного тракта (хлоромы).
Злокачественные нарушения кроветворения происходят из-за повреждения ДНК миелоидных клеток. ДНК клетки содержит информацию о ее росте, делении и гибели и представлена в клетке в виде хромосом. Факторы, повреждающие ДНК миелоидных клеток, до конца не изучены. Доказано вредное воздействие ионизирующей радиации, предшествующей химиотерапии, токсических веществ, например бензола. Выявлены также характерные изменения структуры и количества хромосом при определенных видах миелолейкоза.
При остром миелолейкозе часто наблюдаются повреждения 8-й, 15-й, 16-й, 17-й и 21-й хромосом. Характерным признаком хронического миелолейкоза считается наличие филадельфийской хромосомы. Она встречается в 95 % всех случаев хронического миелолейкоза и образована в результате присоединения к 22-й хромосоме участка 9-й хромосомы. Филадельфийская хромосома активирует синтез специальных белков тирозинкиназ, которые нарушают деление миелоцитов. В результате в крови появляются как зрелые гранулоциты, так и бластные клетки.
Острый миелолейкоз встречается как у взрослых, так и у детей. При нем в крови и костном мозге находят большое количество миелобластов. При хроническом миелолейкозе миелоидные клетки более зрелые и «специализированные». Средний возраст пациентов с хроническим миелолейкозом – 55-60 лет.
Кто в группе риска?
- Мужчины.
- Люди старше 60 лет.
- Курящие.
- Подвергавшиеся радиоактивному облучению.
- Подвергавшиеся химиотерапии или лучевой терапии в связи с другой формой рака.
- Люди с синдромом Дауна и другими генетическими нарушениями.
- Страдающие миелодиспластическими заболеваниями (это группа хронических заболеваний, при которых костный мозг не вырабатывает достаточное количество полноценных клеток крови).
Диагностика
Лабораторные методы обследования
- Общий анализ крови (без лейкоцитарной формулы и СОЭ) с лейкоцитарной формулой. Это исследование дает врачу информацию о количестве, соотношении и степени зрелости элементов крови.
- Лейкоциты. При миелолейкозе лейкоциты могут быть повышены, в норме или понижены. Лейкоцитарную формулу (соотношение отдельных видов лейкоцитов) определяют по мазку крови. Для этого на предметное стекло наносится тонкий мазок крови, окрашивается специальными красителями, а затем исследуется под микроскопом. Таким образом врач может не только определить соотношение лейкоцитов, но и выявить патологические, незрелые клетки, которые внешне отличаются от нормальных. Для острого лейкоза характерно наличие в лейкоцитах специфических включений – азурофильных гранул и палочек Ауэра. Это характерный признак миелобластов. При хроническом миелолейкозе в крови обнаруживают более зрелые лейкоциты.
- Тромбоциты, эритроциты и гемоглобин могут быть снижены.
- Определение уровня щелочной фосфатазы нейтрофилов. Это специальное бактерицидное вещество, которое определяется только в зрелых лейкоцитах. При миелолейкозе она снижена, тогда как при других заболеваниях, например инфекциях, бывает значительно повышена.
- Проточная цитометрия или иммунофенотипирование. При сложных вариантах миелолейкоза эти методики позволяют точно определить тип злокачественных клеток. При проточной цитометрии измеряют параметры клетки с помощью лазерного луча. Иммунофенотипирование заключается в обнаружении специфических для разных типов клеток белков на поверхности мембраны лейкоцита.
- Цитогенетические исследования. Для исследования обычно берут венозную кровь. Клетки крови фиксируют и окрашивают, после чего специалист под микроскопом исследует их кариотип – полный набор хромосом, который идентичен во всех клетках организма человека. Используется для выявления хромосомных нарушений, характерных для миелолейкоза.
Другие методы обследования
- Спинномозговая пункция. Проводится для определения в спинномозговой жидкости, омывающей спинной и головной мозг, лейкозных клеток. Образец спинномозговой жидкости берется с помощью тонкой иглы, которая вводится между 3-м и 4-м поясничными позвонками после местного обезболивания.
- Рентгенография грудной клетки – может показать увеличение лимфатических узлов.
- Ультразвуковое исследование органов брюшной полости. Помогает выявить увеличение печени и селезенки.
Лечение
- Химиотерапия – это использование специальных препаратов, которые разрушают лейкозные клетки или препятствуют их делению.
- Таргетированная терапия – применение препаратов, имеющих направленное действие на некоторые виды злокачественных клеток. Они взаимодействуют с определенными белками на поверхности лейкозных клеток и вызывают их разрушение.
- Иммунотерапия – использование средств, усиливающих ответ иммунной системы организма на злокачественные клетки. При терапии лейкозов чаще всего используют альфа-интерферон – специфический белок, обладающий противовирусной активностью.
- Пересадка костного мозга – пациенту пересаживают нормальные клетки костного мозга от подходящего донора. Предварительно проводят курс химио- или лучевой терапии в высоких дозах, чтобы уничтожить все патологические клетки в организме.
- Лучевая терапия – разрушение лейкозных клеток с помощью ионизирующего излучения. Может быть использована при остром миелолейкозе для полного разрушения лейкозных клеток перед пересадкой костного мозга.
Профилактика
Специфической профилактики миелолейкоза нет. Для своевременной диагностики необходимо регулярно проходить профилактические осмотры, а при возникновении тревожных симптомов сразу обращаться к врачу.
Рекомендуемые анализы
Хронический миелоидный лейкоз (ХМЛ, хронический миелолейкоз) — форма лейкоза, которая характеризуется ускоренной и нерегулируемой пролиферацией преимущественно миелоидных клеток в костном мозге с их накоплением в крови. ХМЛ — гемопоэтическое клональное заболевание, основным проявлением которого является пролиферация зрелых гранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников. Это миелопролиферативное заболевание ассоциировано с характерной хромосомной транслокацией (филадельфийской хромосомой). В настоящее время основным способом лечения хронического миелолейкоза является таргетная (целевая) терапия ингибиторами тирозинкиназ, такими как иматиниб, нилотиниб, дазатиниб и другие, значительно улучшившая показатели выживаемости.
Патогенез
На примере ХМЛ впервые была показана связь злокачественного заболевания с конкретной генетической аномалией. В случае ХМЛ такой характерной аномалией является хромосомная транслокация, которая проявляется присутствием в кариотипе так называемой филадельфийской хромосомы. Эта мутантная хромосома получила своё название по месту работы её первооткрывателей, Питера Ноуелла (Пенсильванский университет) и Дэвида Хангерфорда (Онкологический центр Фокса Чейза), которые впервые описали её в 1960 году в Филадельфии (штат Пенсильвания, США)[1].
При этой транслокации, участки 9-й и 22-й хромосом меняются местами. В результате, фрагмент гена BCR из хромосомы 22 и ген ABL из хромосомы 9 образуют единую рамку считывания. Продуктами этого аномального слитого гена могут быть белки с молекулярной массой 210 (p210) или, реже, 185 кДа (p185). Так как в норме белок ABL содержит тирозинкиназный домен, продукт мутантного гена также является тирозинкиназой[2][3].
Белок BCR-ABL взаимодействует с одной из субъединиц клеточного рецептора к интерлейкину 3. Транскрипция гена BCR-ABL происходит непрерывно и не нуждается в активации другими белками. BCR-ABL активирует сигнальный каскад, контролирующий клеточный цикл, ускоряя деление клеток. Более того, белок BCR-ABL подавляет репарацию ДНК, вызывая неустойчивость генома и делая клетку более восприимчивой к дальнейшим генетическим аномалиям. Активность BCR-ABL — патофизиологическая причина хронического миелолейкоза. По мере изучения природы белка BCR-ABL и его тирозинкиназной активности, была разработана таргетная (целевая) терапия, позволяющая специфически ингибировать эту активность. Ингибиторы тирозинкиназ могут способствовать полной ремиссии ХМЛ, что ещё раз подтверждает ведущую роль BCR-ABL в развитии заболевания[3].
Клиническая картина
Заболевание часто протекает бессимптомно, выявляясь при рутинном клиническом анализе крови. В этом случае ХМЛ следует дифференцировать от лейкемоидной реакции, при которой мазок крови может иметь схожую картину. ХМЛ может проявляться недомоганием, субфебрильной лихорадкой, подагрой, повышенной восприимчивостью к инфекциям, анемией, тромбоцитопенией с кровоточивостью (хотя также может наблюдаться повышенное содержание тромбоцитов). Также отмечается спленомегалия.[2][4]
Стадии ХМЛ
В течении ХМЛ выделяют три фазы на основании клинических характеристик и лабораторных данных. В отсутствие лечения ХМЛ обычно начинается с хронической фазы, в течение нескольких лет прогрессирует в фазу акселерации и, в конечном счёте, завершается бластным кризом. Бластный криз — терминальная фаза ХМЛ, клинически подобная острому лейкозу. Вовремя начатое медикаментозное лечение, как правило, может остановить прогрессирование болезни по этому пути. Одним из факторов прогрессии от хронической фазы к бластному кризу является приобретение новых хромосомных аномалий (в дополнение к филадельфийской хромосоме)[2]. Некоторые пациенты к моменту постановки диагноза могут находиться уже в фазе акселерации или бластного криза[4].
Хроническая фаза
Около 85 % пациентов с ХМЛ к моменту постановки диагноза находятся в хронической фазе. В течение этой фазы клинические проявления обычно отсутствуют или имеются «лёгкие» симптомы, такие как недомогание или чувство переполнения живота. Продолжительность хронической фазы различна и зависит от того, насколько рано было диагностировано заболевание, а также от проведённого лечения. В конечном счёте, при отсутствии эффективного лечения, заболевание переходит в фазу акселерации[4].
Фаза акселерации
Диагностические критерии перехода в фазу акселерации могут различаться: наиболее широко используются критерии, установленные исследователями онкологического центра Андерсона при Техасском университете[5], Сокалом с соавторами[6], а также Всемирной организацией здравоохранения[7][8]. Критерии ВОЗ, вероятно, наиболее широко распространены, и отличают фазу акселлерации по следующим признакам:
- 10—19 % миелобластов в крови или костном мозге;
- > 20 % базофилов в крови или костном мозге;
- < 100 000 тромбоцитов в микролитре крови, вне связи с терапией;
- > 1 000 000 тромбоцитов в микролитре крови, вне зависимости от терапии;
- цитогенетическая эволюция с развитием новых аномалий в дополнение к филадельфийской хромосоме;
- прогрессирование спленомегалии или увеличение числа лейкоцитов, вне зависимости от терапии.
Фаза акселерации предполагается при наличии любого из указанных критериев. Фаза акселерации указывает на прогрессию заболевания и приближение бластного криза[7]
Бластный криз
Бластный криз — финальная стадия развития ХМЛ, протекающая, подобно острому лейкозу, с быстрой прогрессией и непродолжительной выживаемостью[4]. Бластный криз диагностируется на основе одного из следующих признаков у пациента с ХМЛ[9]:
- >20 % миелобластов или лимфобластов в крови или костном мозге;
- крупные группы бластов в костном мозге при биопсии;
- развитие хлоромы (солидного фокуса лейкемии вне костного мозга).
Диагностика
Периферическая кровь (окраска Май-Грюнвальд — Гимза): лейкоцитоз со сдвигом влевоПредположение о ХМЛ часто делается на основании общего анализа крови, демонстрирующего повышение количества гранулоцитов всех типов, включая зрелые миелоидные клетки. Количество базофилов и эозинофилов повышено практически всегда, что позволяет дифференцировать ХМЛ и лейкемоидную реакцию. При диагностике ХМЛ часто проводится биопсия костного мозга, однако одной лишь морфологической оценки костного мозга недостаточно для постановки диагноза ХМЛ[3][4].
В конечном счёте, ХМЛ диагностируется посредством выявления филадельфийской хромосомы в образцах костного мозга. Эта характерная хромосомная аномалия может быть выявлена в результате цитогенетического анализа, при помощи флюоресцентной гибридизации in situ или детекции гена BCR-ABL методом ПЦР[4].
Существуют разногласия в отношении так называемого Ph-негативного ХМЛ, или случаев предполагаемого ХМЛ, при котором филадельфийская хромосома не обнаруживается. У многих таких пациентов в действительности имеют место комплексные хромосомные аномалии, маскирующие транслокацию t(9;22), либо эта транслокация обнаруживается только при флюоресцентной гибридизации или ПЦР с обратной транскрипцией, но не при рутинном кариотипировании[10]. Для небольшой подгруппы пациентов с отсутствием молекулярных свидетельств присутствия гена BCR-ABL может быть поставлен диагноз недифференцированное миелодиспластическое/миелопролиферативное расстройство, так как оно, как правило, отличается от ХМЛ по клиническому течению[7].
Примечания
- ↑ Nowell PC (2007). «Discovery of the Philadelphia chromosome: a personal perspective». Journal of Clinical Investigation. 117 (8): 2033–2035. doi:10.1172/JCI31771. PMC 1934591. PMID 17671636.
- ↑ 1 2 3 Faderl S, Talpaz M, Estrov Z, Kantarjian HM (1999). «Chronic myelogenous leukemia: biology and therapy». Annals of Internal Medicine. 131 (3): 207–219. PMID 10428738.
- ↑ 1 2 3 Hehlmann R, Hochhaus A, Baccarani M; European LeukemiaNet (2007). «Chronic myeloid leukaemia». Lancet. 370 (9584): 342–50. doi:10.1016/S0140-6736(07)61165-9. PMID 17662883.
- ↑ 1 2 3 4 5 6 Tefferi A (2006). «Classification, diagnosis and management of myeloproliferative disorders in the JAK2V617F era». Hematology Am Soc Hematol Educ Program. 2006: 240–245. doi:10.1182/asheducation-2006.1.240. PMID 17124067.
- ↑ Kantarjian H., Dixon D., Keating M., Talpaz M., Walters R., McCredie K., Freireich E. (1988). «Characteristics of accelerated disease in chronic myelogenous leukemia». Cancer. 61 (7): 1441–6. doi:10.1002/1097-0142(19880401)61:7<1441::AID-CNCR2820610727>3.0.CO;2-C. PMID 3162181.
- ↑ Sokal J., Baccarani M., Russo D., Tura S. (1988). «Staging and prognosis in chronic myelogenous leukemia». Semin Hematol. 25 (1): 49–61. PMID 3279515.
- ↑ 1 2 3 Tefferi A, Thiele J, Orazi A, Kvasnicka HM, Barbui T, Hanson CA, Barosi G, Verstovsek S, Birgegard G, Mesa R, Reilly JT, Gisslinger H, Vannucchi AM, Cervantes F, Finazzi G, Hoffman R, Gilliland DG, Bloomfield CD, Vardiman JW (2007). «Proposals and rationale for revision of the World Health Organization diagnostic criteria for polycythemia vera, essential thrombocythemia, and primary myelofibrosis: recommendations from an ad hoc international expert pane». Blood. 110 (4): 1092–1097. doi:10.1182/blood-2007-04-083501. PMID 17488875.
- ↑ Vardiman J., Harris N., Brunning R. (2002). «The World Health Organization (WHO) classification of the myeloid neoplasms». Blood. 100 (7): 2292–302. doi:10.1182/blood-2002-04-1199. PMID 12239137. Проверено 2007-09-22.
- ↑ Karbasian Esfahani M, Morris EL, Dutcher JP, Wiernik PH (2006). «Blastic phase of chronic myelogenous leukemia». Current Treatment Options in Oncology. 7 (3): 189–199. doi:10.1007/s11864-006-0012-y. PMID 16615875.
- ↑ Savage DG; Szydlo RM; Goldman JM (1997). «Clinical features at diagnosis in 430 patients with chronic myeloid leukaemia seen at a referral centre over a 16-year period». Br J Haematol. 96 (1): 111–116. doi:10.1046/j.1365-2141.1997.d01-1982.x. PMID 9012696.
