|
|
Аномалия Тауссиг-Бинга.
 Вопрос Ильину В.Н.
Вопрос Ильину В.Н.Добрый день, Владимир Николаевич! На 23-й неделе беременности моей нерожденной дочери поставили диагноз — двойной выход из правого желудочка (аномалия Тауссиг-Бинга), подклапанный стеноз легочной артирии (полное описание ЭХО малышки во вложении, так же во вложении следующие документы — заключение врачебной комиссии и кардиохирурга Горбатикова Кирилла Викторовича). Ответы по лечению получены уже из Томска (ФГУБ \»НИИ кардиологии\» СО РАМН), Москвы (НИИ им. Бакулева), получены комментарии Любомудрова Вадима Германовича. Если Вы не против, я хотела бы уточнить у Вас ряд вопросов. 1. Возможно ли, что операция не понадобится сразу же после рождения ребенка? Любомудров Вадим Германович, с которым мы связались по интернету, дает такой ответ: «Судя по описанию, порок не вполне можно называть аномалией Тауссиг-Бинга, поскольку есть стеноз легочной артерии. Радикальная операция будет заключаться в создании туннеля из ДМЖП в аорту, а также протезирования легочной артерии клапан-содержащим кондуитом.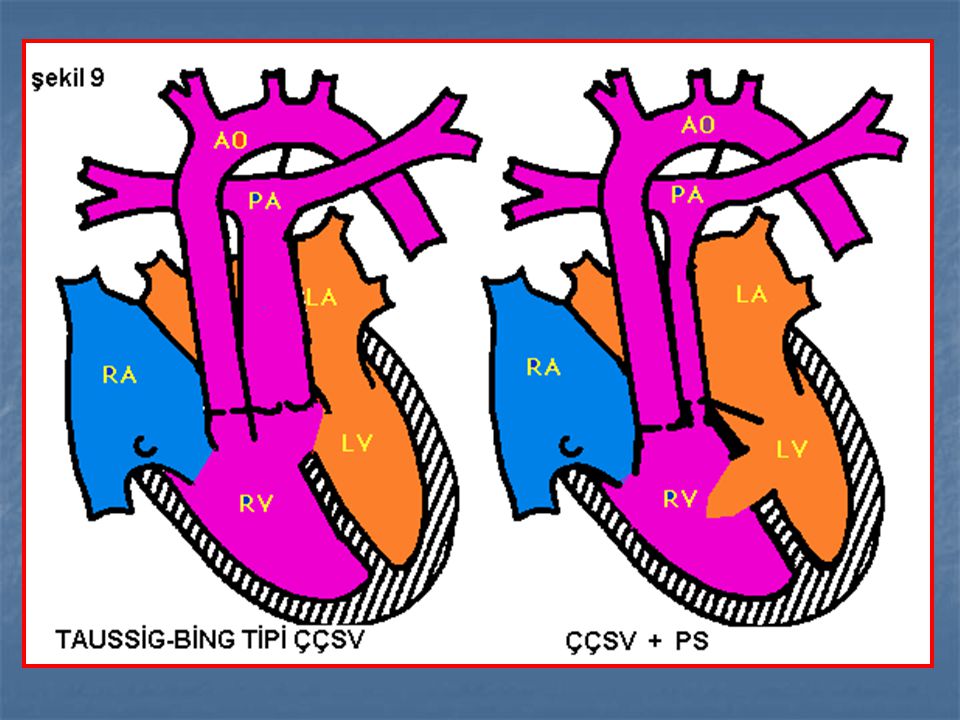
 Диагноз — ВПС: двойной выход из правого желудочка (аномалия Туссиг Бинга), подклапанный стеноз легочной артерии. Немного о себе, если это понадобится: мне 29 лет, роды будут вторые. Первый ребенок полностью здоров. данная беременность осложненная угрозами прерывания беременности, тка же наложены швы на шейку матки по Мак-Дональду. Заранее благодарю за Ваш ответ!
Диагноз — ВПС: двойной выход из правого желудочка (аномалия Туссиг Бинга), подклапанный стеноз легочной артерии. Немного о себе, если это понадобится: мне 29 лет, роды будут вторые. Первый ребенок полностью здоров. данная беременность осложненная угрозами прерывания беременности, тка же наложены швы на шейку матки по Мак-Дональду. Заранее благодарю за Ваш ответ!Случай успешной коррекции аномалии Тауссиг
5. Стрюк Р.И. Диагностика и лечение сердечно-со- ция «Заболевания сердечно-сосудистой системы у бе-
судистых заболеваний при беременности: националь- ременных»). — М., 2013. — 40 с.
ные рекомендации (разработаны Комитетом экспертов 6. Шехтман М.М. Руководство по экстрагенитальной
Всероссийского научного общества кардиологов, сек- патологии у беременных. — М.: Триада-Х, 2013. — 896 с.
Literature
1. Apresyan S.V. Pregnancy and childbirth in extragenital diseases. — M.: GEOTAR Media, 2009. -464 p.
Apresyan S.V. Pregnancy and childbirth in extragenital diseases. — M.: GEOTAR Media, 2009. -464 p.
2. Kushakovskiy M.S., Grishkin Yu.N. Cardiac arrhythmias. 4th Edition. — SPb.: OOO Publishing House «Foliant », 2014. — 720 p.
3. Mravyan S.R., Petrukhin VA. Cardiac arrhythmias and conduction disturbance in pregnant women. — M.: Miklyush, 2011. — 128 p.
4. Stryuk R.I. Diseases of the cardiovascular system and pregnancy. — M.: GEOTAR- Media, 2010. — 280 p.
5. Stryuk R.I. Diagnosis and treatment of cardiovascular disease in pregnancy: National Guidelines (worked out by the Expert Committee of the All-Russia Scientific Society of Cardiologists, Section «Diseases of the cardiovascular system in pregnant women») — M., 2013. — 40 p.
6. Shekhtman M.M. Guide on extragenital pathology in pregnant women. — M.: TriadaKh, 2013. — 896 p.
Shekhtman M.M. Guide on extragenital pathology in pregnant women. — M.: TriadaKh, 2013. — 896 p.
Координаты для связи с авторами: Припачкина Екатерина Александровна — аспирант кафедры факультетской терапии ЧГМА, тел.: +7-964-473-10-90, 8-(3022)-35-43-24, e-mail: [email protected]; Филёв Андрей Петрович — д-р мед. наук, профессор кафедры факультетской терапии ЧГМА, тел. 8-(3022)-35-43-24, e-mail: [email protected]; Говорин Анатолий Васильевич — д-р мед. наук, профессор, зав. кафедрой факультетской терапии, ректор ЧГМА, тел. 8-(3022)-35-43-24, e-mail: [email protected]; Муха Наталья Вячеславовна — канд. мед. наук, доцент кафедры факультетской терапии ЧГМА, тел. 8-(3022)-35-43-24, e-mail: [email protected]; Василенко Павел Владимирович — ассистент кафедры факультетской терапии ЧГМА, тел. 8-(3022)-35-43-24, e-mail: [email protected]; Соколова Наталья Анатольевна — д-р мед. наук, профессор кафедры факультетской терапии ЧГМА,
тел. 8-(3022)-35-43-24, e-mail: [email protected].
8-(3022)-35-43-24, e-mail: [email protected].
□□□
УДК 616.12-007.1:616.132-007-089]-053.31 Д.С. Штампов, К.А. Налимов, М.В. Ким
СЛУЧАЙ УСПЕШНОЙ КОРРЕКЦИИ АНОМАЛИИ ТАУССИГ — БИНГА В СОЧЕТАНИИ С КРИТИЧЕСКОЙ КОАРКТАЦИЕЙ АОРТЫ
Федеральный центр сердечно-сосудистой хирургии, 680009, ул. Краснодарская, 2в, тел. 8-(4212)-78-06-01, г. Хабаровск
Резюме
Представлен случай успешной радикальной коррекции редкого врожденного порока сердца: аномалии Таус-сиг — Бинга в сочетании с критической коарктацией аорты у новорожденного пациента с удовлетворительным результатом.
Ключевые слова: аномалия Тауссиг-Бинга, коарктация аорты.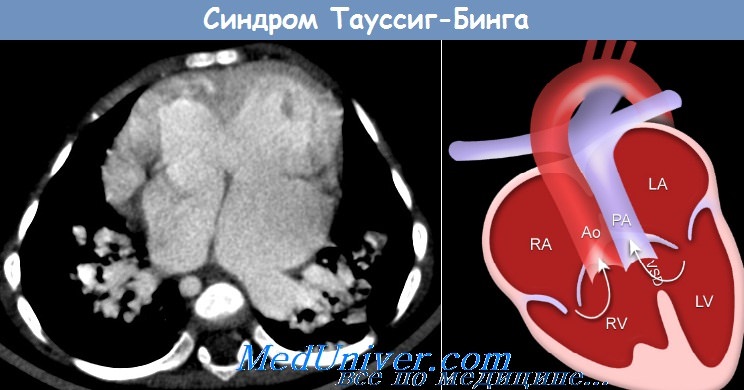
D.S. Shigantsov, K.A. Nalimov, M.V. Kim
THE CASE OF SUCCESSFUL CORRECTION OF THE TAUSSIG — BING ANOMALY IN COMBINATION WITH CRITICAL COARCTATION OF THE AORTA
Federal Centre of Cardiovascular Surgery, Khabarovsk Summary
The article presents a case of successful radical correction of congenital heart disease: Taussig Bing anomaly with critical coarctation of the aorta in the newborn.
Key words: anomaly of Taussig — Bing, coarctation of the aorta.
Аномалия Тауссиг — Бинга относится к группе врож- от ПЖ) и подлегочным дефектом межжелудочковой денных пороков сердца (ВПС) с двойным отхождением перегородки (ДМЖП). Частота встречаемости отхожде-магистральных сосудов от правого желудочка (ДОМС ния аорты и легочной артерии (ЛА) от ПЖ составляет
менее 1 % среди всех ВПС [1]. По данным КкМт с соавторами аномалия Тауссиг — Бинга составляет до 30 % случаев от всех больных с ДОМС от ПЖ [2].
По данным КкМт с соавторами аномалия Тауссиг — Бинга составляет до 30 % случаев от всех больных с ДОМС от ПЖ [2].
В настоящее время операцией выбора является артериальное переключение с закрытием ДМЖП. Поскольку сама аномалия Тауссиг — Бинга встречается достаточно редко, то в сочетании с другими ВПС еще реже. Поэтому каждый такой клинический случай является предметом отдельной дискуссии. Мы представляем случай коррекции аномалии Тауссиг — Бинга с коарктацией и гипоплазией дуги аорты с дуктус-за-висимым системным кровотоком.
Больной Ф., мальчик, родился с весом 4 260 г в КГБУЗ «Перинатальный центр», г. Хабаровск (ПЦ). Пренатально по данным ультразвукового исследования (УЗИ) плода был установлен диагноз: ВПС, ДОМС от ПЖ. Через 4 часа после родов отмечалось ухудшение состояния за счет нарастания дыхательной недостаточности на фоне гемодинамических нарушений, начата инфузия вазапростана 0,05 мкг/кг/мин. , переведен на искусственную вентиляцию легких (ИВЛ). При обследовании установлен диагноз: ВПС. Аномалия Тауссиг — Бинга. Критическая коарктация аорты (КоАо).
, переведен на искусственную вентиляцию легких (ИВЛ). При обследовании установлен диагноз: ВПС. Аномалия Тауссиг — Бинга. Критическая коарктация аорты (КоАо).
Пациент переведен для оперативного лечения в центр сердечно-сосудистой хирургии (г. Хабаровск). На момент поступления возраст ребенка 5 дней. При осмотре общее состояние ребенка очень тяжелое, обусловлено гемодинамикой порока, гипоксемией, сопутствующей патологией (недоношенность (37 недель), диабетическая фетопатия, симптом угнетения центральной нервной системы, незрелость). Кожные покровы чистые, иктеричные. Продолжается ИВЛ, SрO2 на руках 80 %, на ногах 90 %. Гемодинамика не стабильная, что потребовало подключение инотроп-ной поддержки допамином 5 мкг/кг/мин. Артериальное давление (АД) на руках 80/40 мм рт. ст., на ногах 70/30 мм рт. ст., число сердечных сокращений (ЧСС) 168 уд/мин.
По УЗИ аорта располагается кпереди и слева от ЛА, субпульмональный дефект межжелудочковой перегородки (ДМЖП) диаметром 9 мм. Отмечается инфантильная КоАо в типичном месте, восходящая аорта 8 мм, проксимальная и дистальная дуга аорты 5 и 4 мм, в области КоАо — 1 мм. Открытый артериальный проток (ОАП) — 4 мм. Полулунные и митральный клапаны интактны, на трикуспидальном имеется недостаточность 1-2-й степени.
Отмечается инфантильная КоАо в типичном месте, восходящая аорта 8 мм, проксимальная и дистальная дуга аорты 5 и 4 мм, в области КоАо — 1 мм. Открытый артериальный проток (ОАП) — 4 мм. Полулунные и митральный клапаны интактны, на трикуспидальном имеется недостаточность 1-2-й степени.
Проведено оперативное лечение в объеме радикальной коррекции аномалии. Хирургический доступ срединная стернотомия. При ревизии отмечается транспозиционное положение магистральных сосудов, аорта расположена кпереди и слева от ствола ЛА, также имеется ОАП внешним диаметром 5 мм. Выделены магистральные сосуды: аорта с дугой и брахиоцефаль-ными артериями, область КоАо (внешний диаметр 2 мм), ОАП, ствол и ветви ЛА (рис. 1а). Подключение аппарата искусственного кровообращения (ИК) по схеме «аорта-полые вены», причем восходящая и нисходящая аорта канюлированы раздельно. Начато ИК и охлаждение больного до 18 °С. По достижению целевой температуры охлаждения выполнена гипотермиче-ская остановка ИК, антеградная кардиоплегия в корень
аорты раствором «Кустодиол». Поперечно пересечены аорта и ЛА в области синутобулярных соединений. Пересечен ОАП, дефект в стволе ЛА ушит непрерывным швом. Область КоАо с дуктальной тканью иссечены. Дуга аорты рассечена на всем протяжении. Выполнен полуанастомоз нисходящей аорты с дугой по типу «конец в конец» с одновременной пластикой дуги аорты аутоперикардиальной заплатой. В восходящую аорту установлена канюля. Начато согревание больного. Далее сформирован туннель из левого желудочка с одновременным закрытием ДМЖП заплатой из ксе-ноперикарда. Выделены устья коронарных артерий на «площадках». Коронарная анатомия 1LCx2R. Выполнен маневр Lecompte: ЛА транслоцирована кпереди от аорты. Коронарные артерии реимплантированы к соответствующим синусам ЛА: устье ЛКА с использованием техники «люка», затем устье ПКА «площадкой». Сформирован анастомоз неоарты с восходящей аортой. Снят зажим с аорты. Самостоятельное восстановление сердечной деятельности — синусовый ритм с ЧСС 160 уд./мин. В условиях параллельного ИК выполнена пластика неолегочной артерии в области дефектов 1 и 2 синусов ксеноперикардиальной заплатой в форме «штанов».
Поперечно пересечены аорта и ЛА в области синутобулярных соединений. Пересечен ОАП, дефект в стволе ЛА ушит непрерывным швом. Область КоАо с дуктальной тканью иссечены. Дуга аорты рассечена на всем протяжении. Выполнен полуанастомоз нисходящей аорты с дугой по типу «конец в конец» с одновременной пластикой дуги аорты аутоперикардиальной заплатой. В восходящую аорту установлена канюля. Начато согревание больного. Далее сформирован туннель из левого желудочка с одновременным закрытием ДМЖП заплатой из ксе-ноперикарда. Выделены устья коронарных артерий на «площадках». Коронарная анатомия 1LCx2R. Выполнен маневр Lecompte: ЛА транслоцирована кпереди от аорты. Коронарные артерии реимплантированы к соответствующим синусам ЛА: устье ЛКА с использованием техники «люка», затем устье ПКА «площадкой». Сформирован анастомоз неоарты с восходящей аортой. Снят зажим с аорты. Самостоятельное восстановление сердечной деятельности — синусовый ритм с ЧСС 160 уд./мин. В условиях параллельного ИК выполнена пластика неолегочной артерии в области дефектов 1 и 2 синусов ксеноперикардиальной заплатой в форме «штанов». Сформирован анастомоз неолегочной артерии со стволом ЛА (рис. 1б). Общее время ИК составило 182 мин., ишемии миокарда — 90 мин., циркуляторного ареста — 38 мин. Стернотомная рана не ушивалась, рана закрыта перчаточной резиной, затем барьерной пленкой, после чего пациент переведен в палату реанимации. На момент перевода в реанимацию гемодинамика поддерживалась адреналином в дозе 0,15 мкг/кг/мин., допамином — 15 мкг/кг/мин., при этом АД держалось в цифрах 74/45-62/41 мм рт. ст. Насыщение артериальной крови кислородом составляло 99-100 %.
Сформирован анастомоз неолегочной артерии со стволом ЛА (рис. 1б). Общее время ИК составило 182 мин., ишемии миокарда — 90 мин., циркуляторного ареста — 38 мин. Стернотомная рана не ушивалась, рана закрыта перчаточной резиной, затем барьерной пленкой, после чего пациент переведен в палату реанимации. На момент перевода в реанимацию гемодинамика поддерживалась адреналином в дозе 0,15 мкг/кг/мин., допамином — 15 мкг/кг/мин., при этом АД держалось в цифрах 74/45-62/41 мм рт. ст. Насыщение артериальной крови кислородом составляло 99-100 %.
В течение 5 суток кардиотоническая поддержка снижена до минимальных цифр, на 6-е сутки выполнено отсроченное ушивание грудины. На 10-е сутки экстубация и перевод пациента на самостоятельное дыхание. Ребенок на 17-е сутки после операции был переведен для долечивания в ПЦ г. Хабаровска.
На момент перевода состояние больного средней степени тяжести. Ребенок в сознании.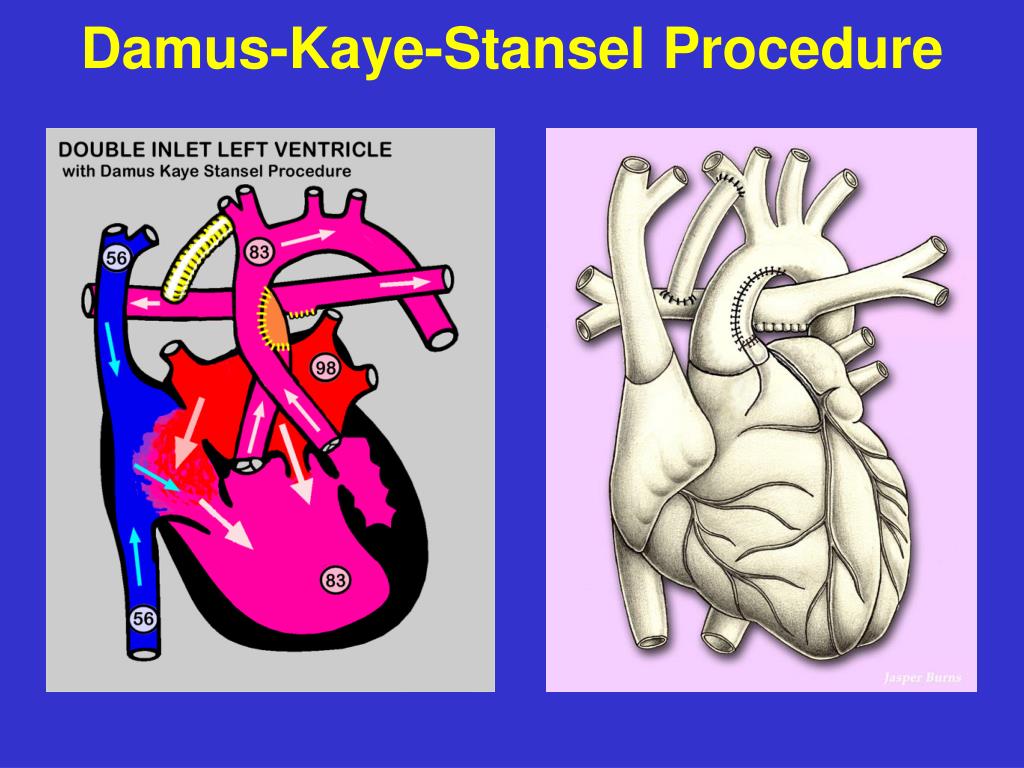 АД на руках и ногах равное, 85/40 мм рт. ст., ЧСС 148 ударов в минуту. Кормление ребенка осуществляется с интервалом в 2 часа в объёме 60 мл. Диурез достаточный. По УЗИ: фракция выброса левого желудочка 75 %, неоаортальный клапан интактный, на неопульмональном клапане пиковый градиент давления (ГрД) 16 мм рт. ст., ДМЖП закрыт герметично, субаортальной обструкции, ГрД в области реконструкции дуги аорты нет.
АД на руках и ногах равное, 85/40 мм рт. ст., ЧСС 148 ударов в минуту. Кормление ребенка осуществляется с интервалом в 2 часа в объёме 60 мл. Диурез достаточный. По УЗИ: фракция выброса левого желудочка 75 %, неоаортальный клапан интактный, на неопульмональном клапане пиковый градиент давления (ГрД) 16 мм рт. ст., ДМЖП закрыт герметично, субаортальной обструкции, ГрД в области реконструкции дуги аорты нет.
Ребенок обследован через 5 мес. после оперативного лечения. При осмотре состояние удовлетворительное, масса тела 5,2 кг. Общее состояние удовлетворительное. Периферических отеков нет. Частота дыхания 40 в мин. Перкуторно границы сердца не увеличены. Средней интенсивности систолический шум над клапаном ЛА. ЧСС 148 уд/мин. Дизурических явлений нет. На УЗИ: Аортальный клапан без особенностей, на клапане ЛА ГрД пиковый 25 мм рт. ст., средний 12 мм рт. ст. Сократительная способность сердца удовлетворительная.
В мировой практике при хирургической коррекции аномалии Тауссиг — Бинга, кроме артериального переключения, используются различные методики создания интравентрикулярного туннеля с клапансо-держащим кондуитом [3]. Используемый нами метод
Используемый нами метод
оперативного вмешательства в сочетании с устранением КоАо с применением расширения дуги аорты ау-топеркиардиальной заплатой, демонстрирует хороший результат
Литература
1. Бураковский В.И., Бокерия JLA. Сердечно-со- let right ventricle. Derivation from an 18 year experience-судистая хирургия. — 1996. — 230 с. 1986. — С. 913-930.
2. Kirklin J.W., Pacifico A.D., Blackstone E.H., et al. 3. Mavroudis C. Pediatric Cardiac Surgery. — 2013. -Current risks and protocols for operations for double-out- C. 470.
Literature
4. Burakovsky V.I., Bokeriya L.A. Cardiovascular right ventricle. Derivation from an 18-year experience -Surgery. — 1996.-230 p. 1986. — P.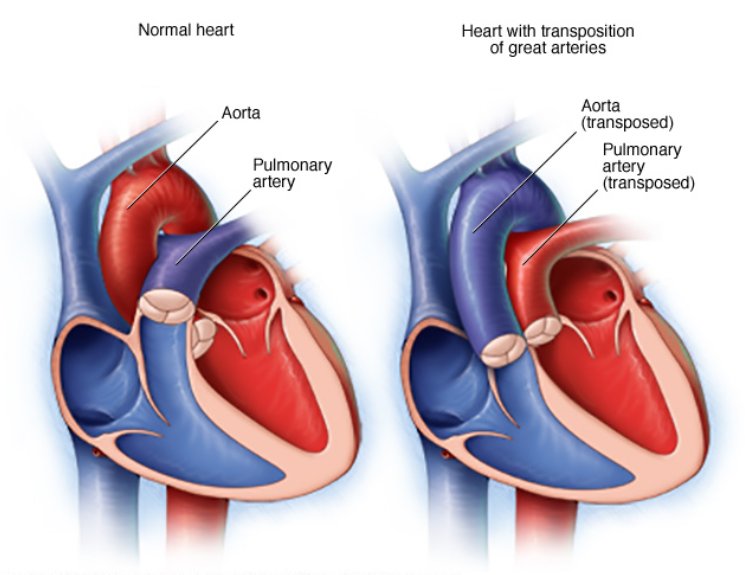 913-930.
913-930.
5. Kirklin J.W., Pacifico A.D., Blackstone E.H., et al. 6. Mavroudis C. Pediatric Cardiac Surgery. — 2013. -Current risks and protocols for operations for double-outlet P. 470.
Координаты для связи с авторами: Шиганцов Данил Сергеевич — врач сердечно-сосудистый хирург ФГБУ «Федеральный центр сердечно-сосудистой хирургии», тел. +7-924-215-50-11, e-mail: [email protected]; Налимов Константин Александрович — врач сердечно-сосудистый хирург ФГБУ «Федеральный центр сердечно-сосудистой хирургии»; Ким Марина Владимировна — врач сердечно-сосудистый хирург ФГБУ «Федеральный центр сердечно-сосудистой хирургии».
□□□
УДК 616.832.9-002:616-002.5:615.33]-053.2 В.П. Молочный1, Н.В. Чернышева1, Н.Ю. Миропольская1, А.А. Овчинников2
СЛУЧАЙ МНИМОЙ САНАЦИИ ЛИКВОРА ПРИ ЛЕЧЕНИИ ЦЕФАЛОСПОРИНАМИ ТУБЕРКУЛЕЗНОГО МЕНИНГИТА У РЕБЕНКА
ГРУДНОГО ВОЗРАСТА
1 Дальневосточный государственный медицинский университет, 680000, ул. Муравьева-Амурского, 35, тел. 8-(4212)-30-53-Н, e-mail: [email protected]; 2Краевая клиническая больница № 2, 680030, ул. Павловича, 1б, тел. 8-(4212)-45-26-36, г. Хабаровск
Муравьева-Амурского, 35, тел. 8-(4212)-30-53-Н, e-mail: [email protected]; 2Краевая клиническая больница № 2, 680030, ул. Павловича, 1б, тел. 8-(4212)-45-26-36, г. Хабаровск
Резюме
В статье рассмотрен случай течения генерализованной туберкулезной инфекции у ребенка первого года жизни, находящегося в контакте с ВИЧ-инфицированным отцом, который закончился летальным исходом. Маленькие дети и люди, живущие с ВИЧ, по-прежнему подвергаются наибольшему риску туберкулезного менингита. Ранняя
Двойное отхождение сосудов от правого желудочка
Определение
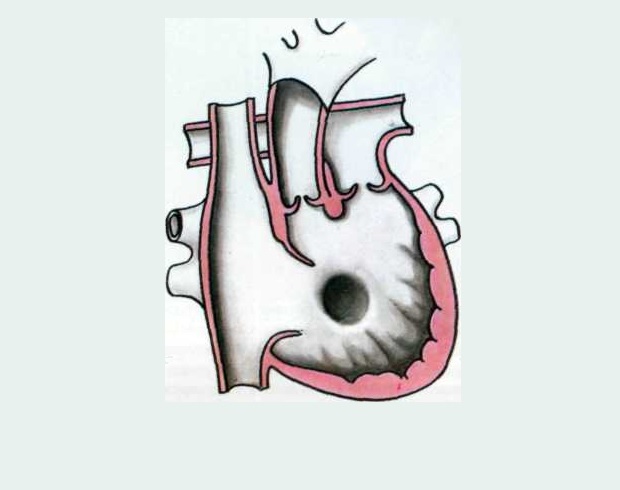
Двойное отхождение сосудов от правого желудочка, далее ДОСПЖ (частичная транспозиция, двойной выход из правого желудочка, аномалия Тауссиг — Бинга), — группа врожденных пороков сердца, чаще генетически обусловленных (мутации генов GDF1 (19p13. 11) и CFC1 (2q21.2) кардиальных клеток-предшественников), характеризующаяся аномальным типом вентрикуло-артериальной связи, при которой аорта и легочный ствол полностью или преимущественно происходят от правого желудочка, возникающей вследствие нарушения ротации конуса и его вклинения между атриовентрикулярными клапанами и сопровождающейся нарушением формирования выхода из левого желудочка.
11) и CFC1 (2q21.2) кардиальных клеток-предшественников), характеризующаяся аномальным типом вентрикуло-артериальной связи, при которой аорта и легочный ствол полностью или преимущественно происходят от правого желудочка, возникающей вследствие нарушения ротации конуса и его вклинения между атриовентрикулярными клапанами и сопровождающейся нарушением формирования выхода из левого желудочка.
Код по МКБ-10 Q20.1 — Удвоение выходного отверстия правого желудочка.
Код по МКБ-11 LA85.2 — Double outlet right ventricle.
Эпидемиология
Клинически частота встречаемости данного порока составляет 0,7 %, что довольно редко, а вот по патологоанатомическим — 2,7 %, что говорит о низкой частоте выявления и ранней смертности лиц с данным заболеванием. Если взять все врожденные пороки сердца в Российской Федерации, то лишь у 1,5 % больных проводится оперативная коррекция данного порока, при средней летальности, составляющей почти 10 %.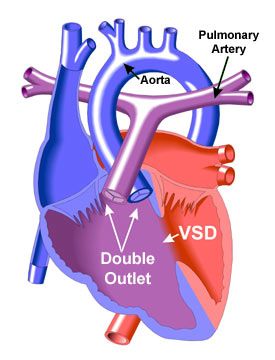 Прогноз течения порока во многом зависит от его типа и, соответственно, варианта гемодинамики.
Прогноз течения порока во многом зависит от его типа и, соответственно, варианта гемодинамики.
Продолжительность жизни выше у больных с гемодинамически более благоприятным течением, а именно с обструкцией выхода из правого желудочка. В целом, время, в течении которого умирают 50 % пациентов с данной аномалией, не превышает и 5 лет, и лишь 17 % больных со всеми типами порока доживают до 15 лет.
Классификация
– ДОСПЖ типа тетрады Фалло ДМЖП в данном случае расположен подаортально или подартериально, сочетаясь с обструкцией выхода из правого желудочка;
– ДОСПЖ типа ДМЖП характеризуется тем же, но при условии отсутствия обструкции выхода из правого желудочка;
– ДОСПЖ типа транспозиции магистральных сосудов характеризуется отсутствием обструкции выхода из правого желудочка, а ДМЖП располагается подлегочно;
– ДОСПЖ с некоммитированным ДМЖП проявляется наличием ДМЖП в синусном или трабекулярном отделе перегородки, может сочетаться с обструкцией выхода из правого желудочка.
Рис. 1
Гемодинамика при анатомически нормальном строении сердца (слева), и при ДОСПЖ (справа).
Диагностика
Диагностика данного заболевания складывается из характерных симптомов сердечной недостаточности, которые проявляются с рождения. Золотым стандартом выявления данного порока является ЭхоКГ, которая позволяет оценить анатомическую структуру сердца и его гемодинамику. Пренатальная диагностика возможна, однако ее выполнение очень затруднительно.
Клинический случай
В отделение кардиологии БСМП поступил больной И., 18 лет, с жалобами на одышку смешанного характера, возникающей при подъеме на второй этаж, при прохождении около 100 метров, на периодический сухой приступообразный кашель, на повышенную утомляемость.
Из анамнеза: с детства отмечались низкая скорость роста, низкая прибавка в весе и толерантность к физической нагрузке. В возрасте двух лет установлен диагноз: ВПС, ДОСПЖ. От предложенного оперативного лечения родители отказались, боясь того, что ребенок не перенесет операцию.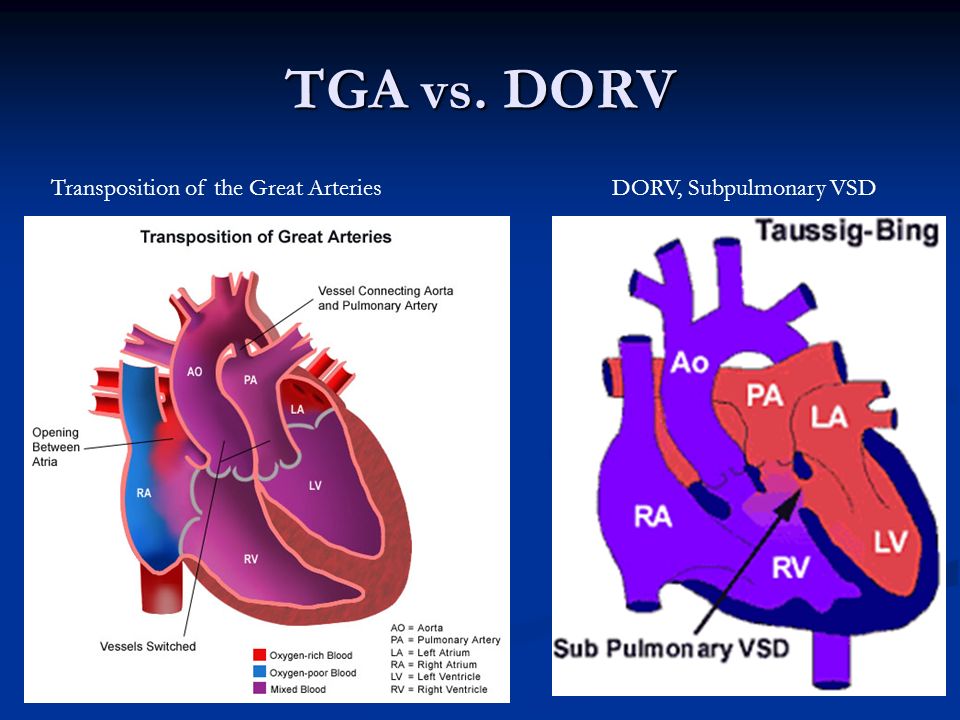 В возрасте 17 лет стал отмечать нарастание одышки, снижение толерантности к физической нагрузке. Обратился к кардиологу, назначена терапия ХСН.
В возрасте 17 лет стал отмечать нарастание одышки, снижение толерантности к физической нагрузке. Обратился к кардиологу, назначена терапия ХСН.
Заочно консультирован кардиохирургом Научного центра сердечно-сосудистой хирургии, где по предоставленным данным «у больного сложный врожденный порок сердца, который в отсутствии коррекции в детском возрасте привел к высокой легочной гипертензии со значительной дилатацией легочной артерии, недостаточности клапана легочной артерии III ст. Выполнить оперативное лечение не представляется возможным. Рекомендована консервативная терапия».
При осмотре обращает на себя внимание астеничность телосложения, цианоз носогубного треугольника. В легких дыхание с жестким оттенком, единичные застойные хрипы в нижних отделах. При аускультации сердца выслушивается акцент II тона над легочной артерией, систолический шум над всеми точками аускультации, ЧСС 80 ударов в минуту. Артериальное давление симметричное на обеих руках, с тенденцией к гипертензии, 135 и 85 мм. рт.ст.
рт.ст.
Из лабораторных данных обращает на себя внимание общий анализ крови, где отмечается компенсаторная полицитемия за счет роста числа эритроцитов 7,8×1012/л повышение уровня гемоглобина до 173 г/л и гематокрита.
При инструментальном обследовании:
Рис. 2
Электрокардиограмма пациента при поступлении. На фоне синусового ритма с ЧСС 85 ударов в минуту отмечаются признаки гипертрофии левого желудочка и неполной блокады правой ножки пучка Гиса.
При проведении ЭхоКГ: Большой высокий дефект межжелудочковой перегородки. Фиброзные изменения створок аортального клапана, умеренный стеноз устья аорты, аортальная недостаточность II-III ст. Фиброз створок клапана легочной артерии. Недостаточность клапана легочной артерии II-III ст. Концетрическая значительная гипертрофия миокарда правого желудочка. Умеренная дилатация правого предсердия. Относительная трикуспидальная недостаточность II степени. Значительная дилатация ствола и ветвей легочной артерии. Значительная легочная гипертензия.
Значительная легочная гипертензия.
По рентгенографии органов грудной клетки отмечается расширение тени сердца влево. Признаки гиперволемии по малому кругу кровообращения.
Пациенту была скорректирована терапия ХСН с учетом выраженной легочной гипертензии с последующей титрацией дозы препаратов на амбулаторном этапе.
Лечение
Больным с ДОСПЖ при явлениях сердечной недостаточности на этапе предоперационной подготовки рекомендуются диуретики, иАПФ, сердечные гликозиды, β-адреноблокаторы, катехоламины.
Больным с ДОСПЖ типа тетрады Фалло рекомендуются β-адреноблокаторы и бензодиазепины при приступе гипоксии.
Больным с ДОСПЖ для лечения легочной гипертензии рекомендуются антагонисты кальция, блокаторы эндотелиновых рецепторов (например, Бозентан, Амбризентан), ингибиторы фосфодиэстеразы типа 5 (например, Силденафил, Варденафил), аналоги простагландинов (например, Илопрост).
Вид оперативной коррекции определяется размерами левого желудочка и, соответственно, локализацией дефекта межжелудочковой перегородки. Многие пациенты перед выполнением реконструктивной коррекции данного порока подвергаются паллиативным операциям, особенно если левый желудочек гипоплазирован или имеет пограничный размер.
Многие пациенты перед выполнением реконструктивной коррекции данного порока подвергаются паллиативным операциям, особенно если левый желудочек гипоплазирован или имеет пограничный размер.
Паллиативные операции строятся из шунта Блелока-Тауссинга (анастомоз между подключичной и легочной артерий) и бандинга легочной артерии (сужения легочной артерии), а иногда вначале выполняется резекция коарктации аорты либо первая стадия процедуры Норвуда (коррекция гемодинамики, путем уменьшения нагрузки на легочную артерию, вызванную повышенным кровотоком).
Учитывая то, что обструктивное поражение сосудов легких развивается столь же быстро, как и при ДМЖП, пациентов с ДОГПЖ следует оперировать рано в младенческом возрасте (до 6 месяцев). В настоящее время ранний возраст не следует рассматривать как фактор госпитальной летальности. Предпочительным методом операции является создание внутрижелудочкового туннеля с помощью заплаты из дакрона либо ткани Гортекс, соединяющего ЛЖ с аортой. Некоторым детям предварительно производится бандинг легочной артерии, однако не следует считать это правилом — гораздо важнее ранняя коррекция порока.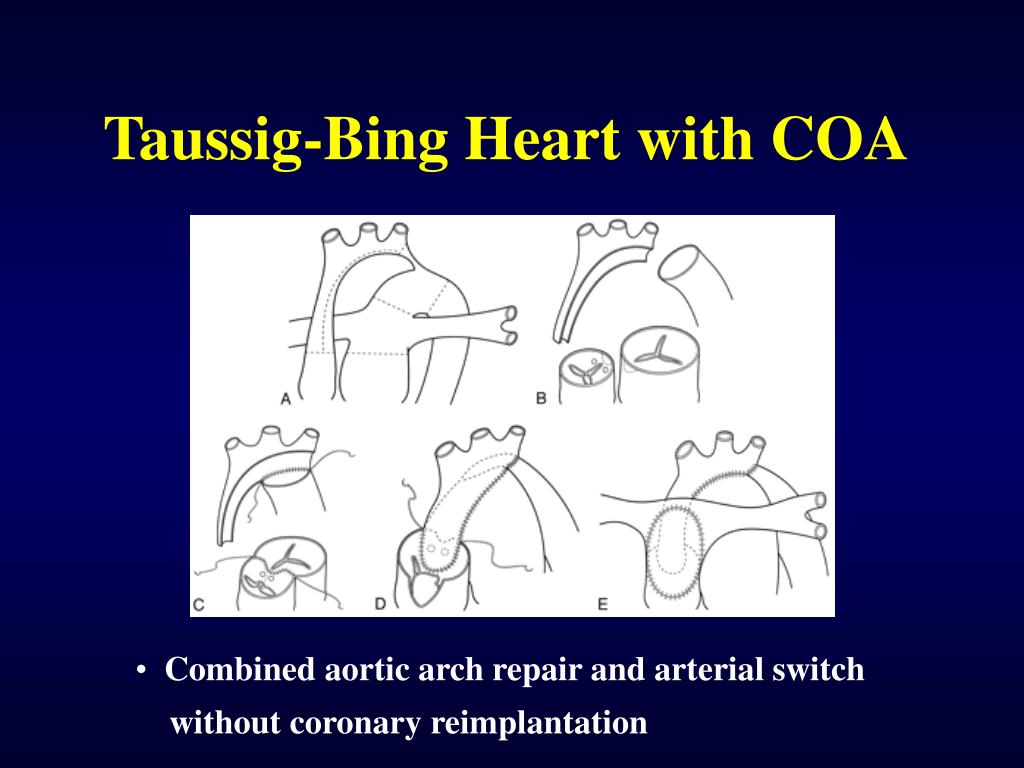
При рестриктивном дефекте межжелудочковой перегородки (когда размер менее диаметра аортального клапана), его расширяют при помощи антеросептального разреза либо иссечением в этой области межжелудочкового гребня. Создающие обструкцию в выводном тракте мышечные пучки иссекают с целью формирования прямого туннеля между аортой и ДМЖП.
Заключение
По частоте встречаемости данный порок весьма редок. По данным некоторых авторов данная аномалия встречается у 2-3 % детей, родившихся с врожденными пороками сердца. Однако редкость возникновения данного порока не исключает вероятности встречи с ним. Следует помнить, что данная патология требует оперативного лечения в раннем возрасте (до 6-ти месяцев), а медикаментозная терапия является поддерживающей и лишь отдаляет исход неизбежно нарастающей ХСН.
Источники:
- Клинические рекомендации ассоцииации сердечно-сосудистых хирургов России, «Двойное отхождение сосудов от правого желудочка» 2016 г.
- Бокерия Л.
 А., Лекции по сердечно-сосудистой хирургии. В 2-х томах. Москва, 2001, Т. 1, стр 482-490.
А., Лекции по сердечно-сосудистой хирургии. В 2-х томах. Москва, 2001, Т. 1, стр 482-490. - Смирнов Н.Н. Двойное отхождение сосудов от правого желудочка: особенности пренатальной диагностики. Пренатальная диагностика, 2009.-N 1.-С.37-40
- The portal for rare diseases and orphan drugs. Double outlet right ventricle.
Аномалия Тауссиг-Бинг: диагностика, особенности, лечение, последствия
Термин «аномалия Taussig-Bing» применяют в двух разных значениях, которые нельзя смешивать. Если его применяют в физиологическом смысле, имеют в виду широкое обозначение любой формы ДВПЖ, которая гемодинамически соответствует транспозиции, а именно когда насыщение в легочной артерии выше, чем в аорте, из-за преимущественного поступления крови из левого желудочка в легочную артерию. Если в это название вкладывают анатомический смысл, то имеют в виду конкретный порок, описанный Taussig и Bing в 1949 г. Van Praagh уточнил анатомическое определение этого порока в 1968 г.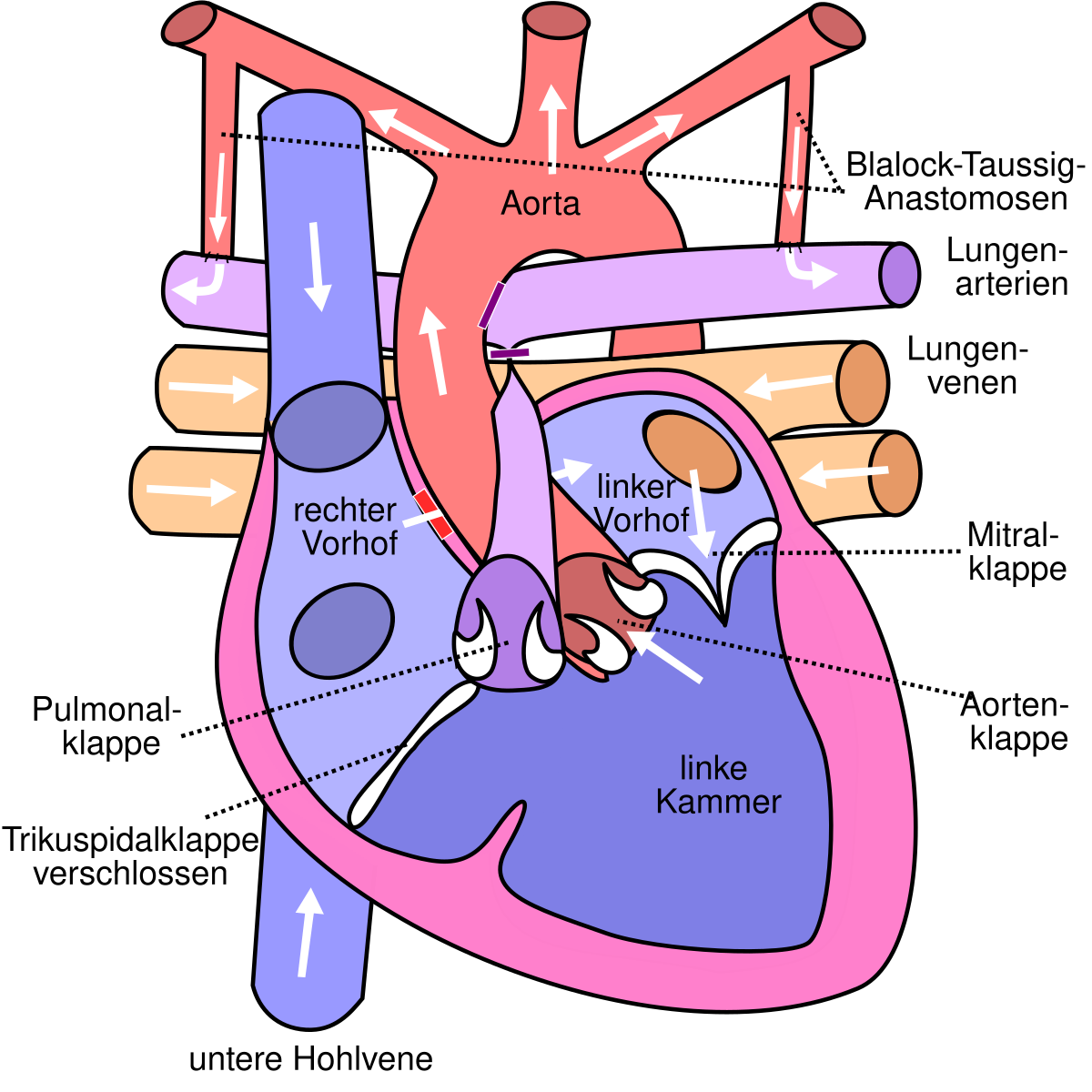 Подаортальный и подлегочный конусы отделяют аортальный и легочный клапаны от AV-клапанов. Полулунные клапаны лежат «бок о бок» на одном уровне. Имеется большой подлегочный ДВПЖ, расположенный выше септальной ножки и мышечной межжелудочковой перегородки. Дефект межжелудочковой перегородки, будучи подлегочным, не сливается с легочным клапаном и отделен от него свободной стенкой подлегочного конуса. Это истинный ДВПЖ, при котором аорта отходит полностью от правого желудочка, в то время как легочный клапан нависает над межжелудочковой перегородкой, но не над полостью левого желудочка. При этом пороке выводной тракт из правого желудочка в аорту часто сужен. Порок нередко сопровождается коарктацией аорты, митральным клапаном-наездником. Встречается расщепление митрального клапана, но не как часть АВСД. Возможна недостаточность клапана. Он может стать причиной обструкции выводного тракта и компрометировать ДМЖП. Бивентрикулярная коррекция в этих анатомических условиях опасна.
Подаортальный и подлегочный конусы отделяют аортальный и легочный клапаны от AV-клапанов. Полулунные клапаны лежат «бок о бок» на одном уровне. Имеется большой подлегочный ДВПЖ, расположенный выше септальной ножки и мышечной межжелудочковой перегородки. Дефект межжелудочковой перегородки, будучи подлегочным, не сливается с легочным клапаном и отделен от него свободной стенкой подлегочного конуса. Это истинный ДВПЖ, при котором аорта отходит полностью от правого желудочка, в то время как легочный клапан нависает над межжелудочковой перегородкой, но не над полостью левого желудочка. При этом пороке выводной тракт из правого желудочка в аорту часто сужен. Порок нередко сопровождается коарктацией аорты, митральным клапаном-наездником. Встречается расщепление митрального клапана, но не как часть АВСД. Возможна недостаточность клапана. Он может стать причиной обструкции выводного тракта и компрометировать ДМЖП. Бивентрикулярная коррекция в этих анатомических условиях опасна.
Сопутствующие аномалии
Типичными сопутствующими аномалиями являются стеноз или АЛА, которые отмечаются у половины больных при всех, включая подлегочную, локализациях ДМЖП. Достаточно часты пороки аорты — клапанный и субаортальный стеноз, коарктация и перерыв дуги. Коарктация и гипоплазия аорты и другие формы обструкции выводного тракта левого желудочка чаще встречаются при аномалии Taussig-Bing. В частности, сужение выводного тракта аорты специфично для подлегочного ДМЖП. Выводной тракт как бы вклинен между вентрикулоинфундибулярной складкой с латеральной стороны и медиально выдающейся внутрь желудочка инфундибулярной перегородкой.
Достаточно часты пороки аорты — клапанный и субаортальный стеноз, коарктация и перерыв дуги. Коарктация и гипоплазия аорты и другие формы обструкции выводного тракта левого желудочка чаще встречаются при аномалии Taussig-Bing. В частности, сужение выводного тракта аорты специфично для подлегочного ДМЖП. Выводной тракт как бы вклинен между вентрикулоинфундибулярной складкой с латеральной стороны и медиально выдающейся внутрь желудочка инфундибулярной перегородкой.
Сопутствущие пороки AV-клапанов представлены АВСД, стенозом или атрезией клапанов, расщеплением передней створки митрального клапана, клапанами-наездниками, нависающими клапанами, перекрестным AV-соединением.
Иногда встречаются варианты порока с дискордантным, одножелудочковым AV-соединением, с атрезией AV-клапана, с предсердным изомеризмом. Кроме того, отхождению магистральных сосудов от правого желудочка сопутствуют многие другие пороки сердца — ОАП, гипоплазия желудочков, аномалии системного венозного возврата, юкстапозиция предсердных ушек, situs inversus totalis, декстрокардия, дефект ДМПП, коронарный синус, открывающийся в левое предсердие.
В Национальном институте сердечно-сосудистой хирургии им. Н.М. Амосова АМН Украины с 1991 по 2004 гг. прооперированы 352 пациента с ДВПЖ.
Рестриктивный ДМЖП, потребовавший резекции части перегородки, встречался при всех типах ДВПЖ с разной частотой:
при тетрадном типе — 26%;
при изолированном ДМЖП — 33,3%;
при ТМА — 50%;
при удаленном ДМЖП — 79,2%.
Хордальный аппарат перегородочной створки трехстворчатого клапана, прикрепляющийся к краю ДМЖП и потребовавший его отсечения и последующей реимплантации, встретился у 5,1% больных.
Гемодинамика и клиника
Гемодинамика и клиника зависят от расположения дефекта, наличия или отсутствия легочного стеноза и сопутствующих аномалий.
При подаортальном ДМЖП без СЛА оксигенированная кровь поступает прямо из левого желудочка в аорту, а венозная — в легочную артерию, поэтому цианоз отсутствует или слабо выражен. При отсутствии ОБЛС легочный кровоток усилен, давление в легочной артерии равно системному, имеются признаки застойной сердечной недостаточности. Клиническая картина аналогична таковой при изолированном большом ДМЖП. Характерны отставание в развитии, одышка, усиленный верхушечный толчок, усиленный II тон, систолический шум, иногда на верхушке — убывающий диастолический шум.
При отсутствии ОБЛС легочный кровоток усилен, давление в легочной артерии равно системному, имеются признаки застойной сердечной недостаточности. Клиническая картина аналогична таковой при изолированном большом ДМЖП. Характерны отставание в развитии, одышка, усиленный верхушечный толчок, усиленный II тон, систолический шум, иногда на верхушке — убывающий диастолический шум.
ЭКГ-признаки часто соответствуют АВСД. Угол a QRS — от 300 до 1700, гипертрофия правого или обоих желудочков, а также левого предсердия, иногда АV-блокада I степени.
Рентгенограмма: кардиомегалия, выступает дуга легочного ствола, усилен легочный рисунок.
Несмотря на подаортальное расположение ДМЖП, при СЛА часть венозной крови поступает в аорту. Это приводит к цианозу и снижению объема легочного кровотока. Клиническая картина напоминает тетраду Фалло: задержка развития, цианоз, пальцы в виде барабанных палочек, усиленный II тон не расщеплен, систолический шум у верхнего левого края грудины.
ЭКГ: отклонение оси вправо, гипертрофия правого предсердия и правого желудочка, блокада правой ножки пучка Гиса.
Рентгенограмма: нормальные размеры сердечной тени с приподнятой верхушкой. Легочный рисунок ослаблен.
Отличительной особенностью является слабый цианоз с признаками усиленного легочного кровотока.
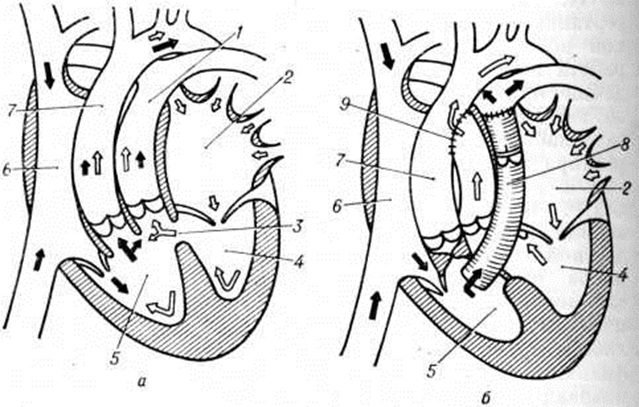
Эхокардиограмма у новорожденного и младенца почти всегда позволяет поставить диагноз с учетом всех интересующих хирурга подробностей. Она должна констатировать 3 признака отхождения магистральных сосудов от правого желудочка:
отхождение обоих магистральных сосудов от правого желудочка;
наличие единственного выхода из левого желудочка через ДМЖП;
отсутствие или наличие митрально-аортального контакта.
Одновременно выясняются все анатомические подробности, необходимые для принятия хирургических решений: взаимная ориентация, относительные размеры магистральных сосудов, диаметр и локализация дефекта, наличие СЛА, его выраженность и характер — динамический или фиксированный. Должны быть оценены расстояние между легочным и трехстворчатым клапанами, степень развития конусной перегородки, наличие прикрепления к ней хорд, анатомия коронарных артерий, наличие сопутствующих аномалий.
Должны быть оценены расстояние между легочным и трехстворчатым клапанами, степень развития конусной перегородки, наличие прикрепления к ней хорд, анатомия коронарных артерий, наличие сопутствующих аномалий.
Ангиокардиография
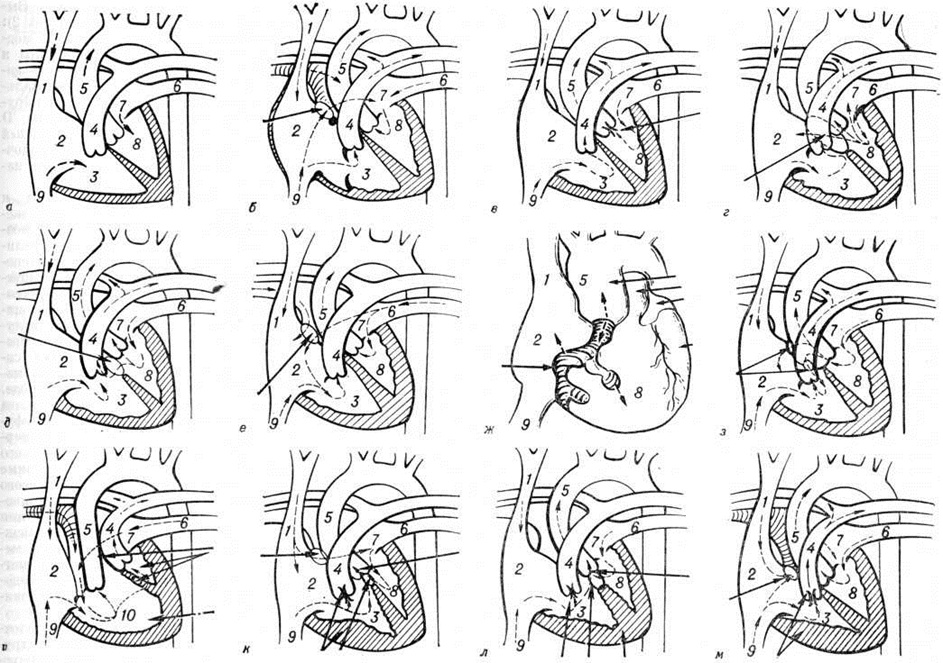
Катетеризация и ангиокардиография могут понадобиться только у более старших детей для исключения ОБЛС и у пациентов с транспозиционным типом ДВПЖ для выполнения предоперационной баллонной атриосептостомии в целях улучшения смешивания крови и, следовательно, для повышения артериальной оксигенации и стабилизации состояния ребенка. Ангиокардиография еще не утратила своего значения для диагностики самого порока и деталей его анатомии. Классификация ангиокардиографических признаков построена на основе взаимного положения магистральных артерий и расположения ДМЖП.
Сосуды расположены «бок о бок», аорта — справа от легочной артерии, полулунные клапаны — на одном горизонтальном уровне. Во фронтальной плоскости хорошо видны подаортальный и подлегочный конусы, разделенные инфундибулярной перегородкой. Оба конуса отделяют полулунные клапаны от атриовентрикулярных, что также видно в боковой проекции. В боковой проекции определяется ДМЖП ниже аортального конуса.
Оба конуса отделяют полулунные клапаны от атриовентрикулярных, что также видно в боковой проекции. В боковой проекции определяется ДМЖП ниже аортального конуса.
На ангиокардиограмме во фронтальной плоскости при введении контрастного вещества в правый желудочек видно, что сосуды расположены «бок о бок». Хорошо развиты билатеральные конусы. Внедрение в правый желудочек конусной перегородки обычно выражено меньше, чем при подаортальном дефекте. В ранней фазе правожелудочковой ангиокардиограммы обнаруживается высокий ДМЖП, непосредственно связанный с легочным клапаном. Между ДМЖП и легочным клапаном отсутствует конус.
Обоюдосвязанный ДМЖП ангиокардиографически трудно отличить от подлегочного дефекта. Классическими признаками при АВСД являются деформация выводного тракта левого желудочка, вызванная аномальным прикреплением левого АV-клапана, и дефицит межжелудочковой перегородки.
Переднезаднее расположение магистральных сосудов при ДВПЖ хорошо определяется в боковой проекции. Виден билатеральный конус. При мальпозиции магистральных артерий часто обнаруживается клапанный и подклапанный стеноз легочной артерии. В боковой проекции левожелудочковой ангиокардиограммы можно легко определить подлегочный ДМЖП.
Виден билатеральный конус. При мальпозиции магистральных артерий часто обнаруживается клапанный и подклапанный стеноз легочной артерии. В боковой проекции левожелудочковой ангиокардиограммы можно легко определить подлегочный ДМЖП.
Естественное течение
Вследствие морфологической гетерогенности течение различных подтипов ДВПЖ неодинаково. Наиболее показательные данные представили две группы исследователей. Hornberger и соавторы сообщили об исходах у 62 плодов, у которых до родов диагностирован ДВПЖ. Прерывание беременности имело место в 34 случаях, в 2 случаях наступила внутриутробная смерть, 5 детей умерли в неонатальном периоде и 4 — до года жизни. Семнадцать выживших детей составляют 27,4% полной эмбриональной когорты. Samanek и Voriskova сообщили о судьбе 69 детей, родившихся с ДВПЖ. Более 13% из них умерли в течение недели после рождения. В течение первого месяца жизни кривая выживаемости стабилизировалась на 78,6%. Снижение выживаемости продолжалось до 3-летнего возраста, и в среднем она составила 47,8%. Между 3-м и 5-м годами жизни кривая снизилась только на 2,9% и между 5-м и 10-м годами — на 1,5%. Выживаемость осталась на уровне 43,4%.
Между 3-м и 5-м годами жизни кривая снизилась только на 2,9% и между 5-м и 10-м годами — на 1,5%. Выживаемость осталась на уровне 43,4%.
Большой неожиданностью для кардиологов стала находка у женщины в возрасте 65 лет ДВПЖ с незащищенным сосудистым ложем.
Естественное течение у больных без легочного стеноза может сопровождаться застойной сердечной недостаточностью с развивающейся впоследствии ОБЛС. У больных с аномалией Taussig-Bing тяжелая ОБЛС развивается в раннем возрасте. Сопутствующие аномалии ухудшают прогноз. В казуистических случаях происходит фетальное спонтанное закрытие ДМЖП.
При наличии СЛА отмечаются осложнения, характерные для всех цианотических ВПС.
Лечение
Медикаментозное
При застойной сердечной недостаточности дополнительно назначают дигоксин и диуретики, по показаниям проводят профилактику бактериального эндокардита.
Хирургическое
В передовых западных кардиохирургических центрах сложилось твердое убеждение в том, что полную коррекцию порока целесообразно выполнять в неонатальном периоде, даже в случаях, когда необходимо применить кондуит, требующий замены уже в ближайшие после операции годы.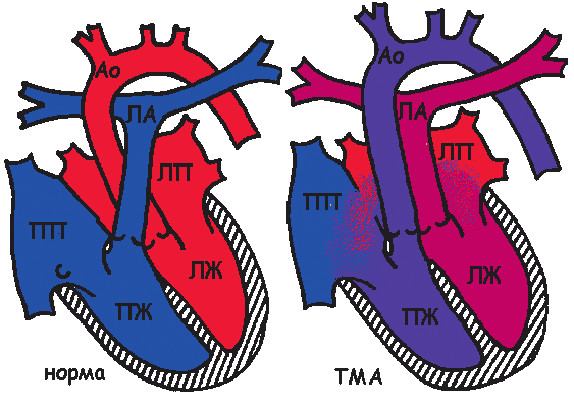 Несмотря на то, что системно-легочный анастомоз является разумной альтернативой, он не уменьшает количества вмешательств, которые предстоит перенести пациенту, и удлиняет период патологической физиологии, который может повлиять на качество окончательного результата.
Несмотря на то, что системно-легочный анастомоз является разумной альтернативой, он не уменьшает количества вмешательств, которые предстоит перенести пациенту, и удлиняет период патологической физиологии, который может повлиять на качество окончательного результата.
Паллиативные операции
В настоящее время суживание легочной артерии у больных с застойной сердечной недостаточностью выполняется редко и главным образом при наличии удаленного от сосудов ДМЖП. Эта процедура является единственным паллиативным вмешательством при ДВПЖ с подаортальным дефектом без СЛА. Показания к ней должны быть обоснованными, прежде всего из-за высокой летальности, которая достигает 16%, и необходимости второй, радикальной коррекции порока. Надо отметить, что при ДВПЖ типа ТМА суживание легочной артерии является фактором риска при последующей операции артериального переключения. Более того, эта операция не гарантирует значительного улучшения состояния пациента и может осложниться развитием инфундибулярного и легочного стенозов, субаортального стеноза и миграцией тесьмы к бифуркации легочной артерии.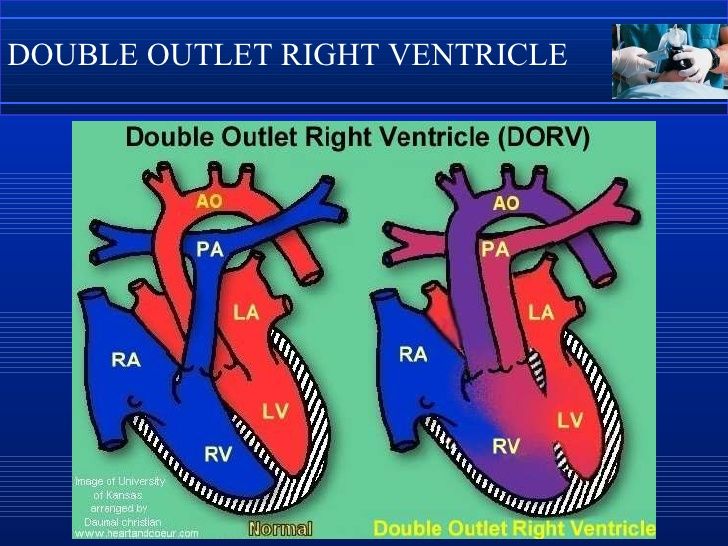 Однако при хронической сердечной недостаточности на фоне высокой легочной гипертензии или таких сопутствующих пороков, как множественные ДМЖП, АV-клапаны-наездники и коарктация аорты, может быть выбрано этапное лечение.
Однако при хронической сердечной недостаточности на фоне высокой легочной гипертензии или таких сопутствующих пороков, как множественные ДМЖП, АV-клапаны-наездники и коарктация аорты, может быть выбрано этапное лечение.
Суживание легочной артерии выполняют через левую переднебоковую торакотомию или через трансстернальный доступ. После вскрытия перикарда выделяют ствол легочной артерии. Тесьму предварительно размечают согласно формуле Trusler: длина ее равна 20 мм + количество миллиметров, численно равное массе тела, при неосложненных вариантах, и 24 + количество миллиметров, численно равное массе тела — при осложненных. Тесьма должна иметь ширину 3-4 мм, ее проводят вокруг средней части ствола легочной артерии и сшивают по предварительно нанесенным меткам. Давление периферийнее тесьмы должно составлять менее 50% системного давления, а насыщение крови кислородом по показаниям пульсоксиметра не должно быть ниже 80-85%. Если эти параметры не достигнуты, тесьму ослабляют или суживают до получения необходимых показателей.
Для больных с подаортальными и обоюдосвязанными ДМЖП лучшим выбором считается первичная полная коррекция порока.
При аномалии Taussig-Bing паллиативная помощь пациентам заключается в суживании легочной артерии и расширении межпредсердного сообщения для улучшения смешивания венозной и артериальной крови и для декомпрессии левых отделов сердца. Во время последующей радикальной операции межпредсердное сообщение позволяет использовать одну венозную канюлю в правом предсердии, через которую дренируются левые отделы сердца. Благодаря этому обеспечивается сухое операционное поле, если вмешательство выполняется в условиях постоянной гипотермической перфузии с низким объемом кровотока. В зависимости от ситуации производят баллонную или ножевую септостомию или операцию Hanlon-Blalock.
Больные с выраженным цианозом, обусловленном СЛА, нуждаются в системно-легочном анастомозе.
Полная коррекция
В связи с выраженным полиморфизмом данного порока применяются различные виды хирургических вмешательств. Залогом их успеха является точная дооперационная оценка анатомического варианта и расчетливый выбор типа операции. При принятии тактических решений целесообразно воспользоваться хирургической классификацией порока, отражающей сложность хирургической задачи. Полная коррекция показана:
Залогом их успеха является точная дооперационная оценка анатомического варианта и расчетливый выбор типа операции. При принятии тактических решений целесообразно воспользоваться хирургической классификацией порока, отражающей сложность хирургической задачи. Полная коррекция показана:
пациентам с неосложненными пороками — атриовентрикулярной конкордантностью, единственным ДМЖП, сбалансированными желудочками, без наличия AV-клапана-наездника, без аномалий легочного ствола и центральных ветвей;
больным с подлегочным стенозом;
пациентам, имеющим сложные дополнительные аномалии — клапан-наездник, АВСБ, гипоплазию клапана или желудочка, предсердный изомеризм, множественные ДМЖП, АЛА, петлю легочной артерии, несливающиеся легочные артерии, аномальный дренаж системных или легочных вен.
В настоящее время применяются 4 типа хирургических вмешательств:
1. Формирование внутрижелудочкового туннеля, соединяющего левый желудочек с аортой.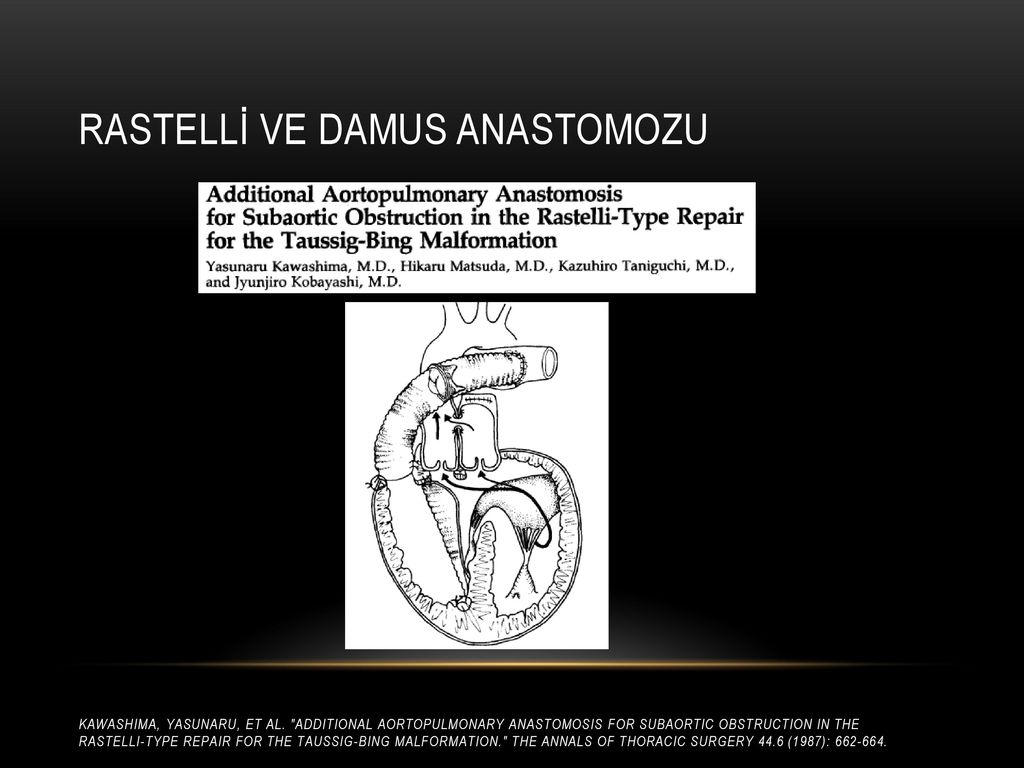 При рестриктивном ДМЖП или с целью улучшения геометрии туннеля выполняют частичную резекцию конусной перегородки. Внутрижелудочковый туннель является своеобразным ресивером или демпфирующей камерой, которая может создавать эффект, аналогичный аневризме левого желудочка. Поэтому при ДВПЖ, на наш взгляд, объем левого желудочка должен приближаться к требованию, высказанному Kirklin, т. е. он должен быть равным или больше 30 мл/м2. В противоположность ДВПЖ, успешная коррекция тетрады Фалло у детей первого года жизни может быть выполнена при объеме левого желудочка 18—20 мл/м2.
При рестриктивном ДМЖП или с целью улучшения геометрии туннеля выполняют частичную резекцию конусной перегородки. Внутрижелудочковый туннель является своеобразным ресивером или демпфирующей камерой, которая может создавать эффект, аналогичный аневризме левого желудочка. Поэтому при ДВПЖ, на наш взгляд, объем левого желудочка должен приближаться к требованию, высказанному Kirklin, т. е. он должен быть равным или больше 30 мл/м2. В противоположность ДВПЖ, успешная коррекция тетрады Фалло у детей первого года жизни может быть выполнена при объеме левого желудочка 18—20 мл/м2.
2. Использование клапанных или бесклапанных кондуитов или альтернативной кондуитам операции Lecompte.
3. Операция артериального переключения с отведением с помощью заплаты легочного ствола в левый желудочек.
4. Один из вариантов операции Fontan. Дополнительным вмешательством является операция Damus-Kaye-Stansel, которая применяется при гипоплазии корня аорты, субаортальном стенозе и аномальном прохождении коронарных артерий.
Коррекция при этом типе ДВПЖ впервые опубликована Kirklin и соавторами в 1957 г. Сейчас первичную полную коррекцию порока выполняют в раннем возрасте, в пределах 6 мес. жизни. Она состоит в создании внутрижелудочкового туннеля между ДМЖП и субаортальным выводным трактом с помощью дакроновой или перикардиальной заплаты, обработанной глютаральдегидом.
При субаортальном ДМЖП летальность составляет около 5%, при обоюдосвязанном ДМЖП она выше.
Впервые коррекция этого порока была выполнена в 1962 г.. Хирургическое лечение следует проводить в ранние сроки из-за быстрого развития необратимых изменений в легочных сосудах. Гемодинамические нарушения соответствуют таковым при ТМА, поэтому принципы коррекции схожи. В основе их лежит переключение потоков артериальной и венозной крови на артериальном или предсердном уровнях.
Гемодинамическая коррекция на предсердном уровне стала возможной с 1963 г., когда была внедрена операция Mustard, предусматривающая предсердную инверсию и отведение легочной артерии через ДМЖП в левый желудочек с помощью заплаты.
В настоящее время эта операция не применяется из-за высокой госпитальной летальности и осложнений в отдаленном периоде: серьезных нарушений ритма, недостаточности трехстворчатого клапана, обструкции системного или легочного венозного возврата, функциональной недостаточность системного желудочка со снижением переносимости физических нагрузок.
Операция Damus-Kaye-Stansel, туннель между ДМЖП и устьем легочной артерии, кондуит между правым желудочком и легочной артерией.
Отведение легочной артерии в левый желудочек через ДМЖП, соединение пересеченной легочной артерии с аортой и имплантация клапанного экстракардиального кондуита между правым желудочком и дистальной легочной артерией, предложены для коррекции сложной формы ТМА, впервые применены для коррекции ДВПЖ с подлегочным ДМЖП в 1982 г..
Эта операция создает вентрикулоартериальную конкордантность без необходимости перемещения коронарних артерий и в прошлом рассматривалась, как возможность избежать последствий сопутствующего субаортального стеноза. Причиной обструкции системного выводного тракта является смещение инфундибулярной перегородки вправо и кверху. Недостаток этой операции заключается в имплантации кондуита, вероятности тромбоза корня аорты и возникновении недостаточности аортального клапана. В настоящее время эта операция не применяется при лечении аномалии Taussig-Bing и вытеснена операциями артериального переключения или внутрижелудочковой инверсией. Несмотря на то, что артериальное переключение стало операцией выбора при коррекции аномалии Taussig-Bing, операция Damus-Kaye-Stancel используется как резервный вариант в случаях, когда отсутствует возможность трансплантации коронарных артерий при таких анатомических факторах, как отхождение огибающей артерии от правой коронарной артерии, или при раннем ветвлении левой главной коронарной артерии, которое ограничивает мобильность левого коронарного устья.
Причиной обструкции системного выводного тракта является смещение инфундибулярной перегородки вправо и кверху. Недостаток этой операции заключается в имплантации кондуита, вероятности тромбоза корня аорты и возникновении недостаточности аортального клапана. В настоящее время эта операция не применяется при лечении аномалии Taussig-Bing и вытеснена операциями артериального переключения или внутрижелудочковой инверсией. Несмотря на то, что артериальное переключение стало операцией выбора при коррекции аномалии Taussig-Bing, операция Damus-Kaye-Stancel используется как резервный вариант в случаях, когда отсутствует возможность трансплантации коронарных артерий при таких анатомических факторах, как отхождение огибающей артерии от правой коронарной артерии, или при раннем ветвлении левой главной коронарной артерии, которое ограничивает мобильность левого коронарного устья.
Наиболее привлекательным методом лечения ДВПЖ с подлегочным дефектом является полная внутрижелудочковая коррекция без артериального переключения и использования экстракардиального кондуита. Известно 4 типа таких операций:
Известно 4 типа таких операций:
1. Задний тубулярный кондуит по Abe.
2. Передний тубулярный кондуит по Doty.
3. Передний спиралевидный туннель по Patrick и McGoon.
4. Задний прямой туннель по Kawashima.
Обе методики предусматривают создание внутрижелудочкового целиком или частично тубулярного кондуита, соединяющего ДМЖП с аортой. Abe предлагал помещать его позади легочной артерии, когда магистральные сосуды располагаются «бок о бок». Для переднезадней ориентации крупных сосудов Doty предложил конструкцию пути из желудочка прямо кпереди вдоль перегородки к свободной стенке правого желудочка. Затем тубулярный кондуит поворачивают резко вправо и кпереди от легочной артерии и пришивают к субаортальному конусу. Линия шва проходит в передней стенке правого желудочка и служит заплатой в выводном тракте правого желудочка. Таким образом, бесклапанный внутрижелудочковый кондуит функционирует с нативным аортальным клапаном. Обеим операциям присущи одинаковые недостатки: отсутствие роста, формирование псевдоинтимы и, следовательно, развитие субаортального стеноза. По этой причине данные операции не применяются.
По этой причине данные операции не применяются.
Для коррекции ДВПЖ с подлегочным стенозом предложены два метода конструирования внутрижелудочкового туннеля между ДМЖП и аортой: операция Patrick-McGoon и операция Kawashima. Создание туннеля между ДМЖП и аортой представляется хорошей альтернативой операции переключения, однако зачастую является технически невыполнимой.
Операция Kawashima производится при расположении магистральных сосудов «бок о бок», когда расстояние между трехстворчатым и легочным клапанами достаточно для формирования свободного внутрижелудочкового туннеля. Операцию выполняют доступом через трехстворчатый клапан или поперечную вентрикулотомию. Туннель, соединяющий левый желудочек с аортой, проходит позади легочной артерии между легочным и трехстворчатым клапанами. Конусная перегородка должна быть резецирована для обеспечения свободного выводного тракта.
ДМЖП расширяют, только если он небольшой. Для больных с косой или переднезадней ориентацией магистральных сосудов операция Kawashima непригодна из-за близости легочного и трехстворчатого клапанов.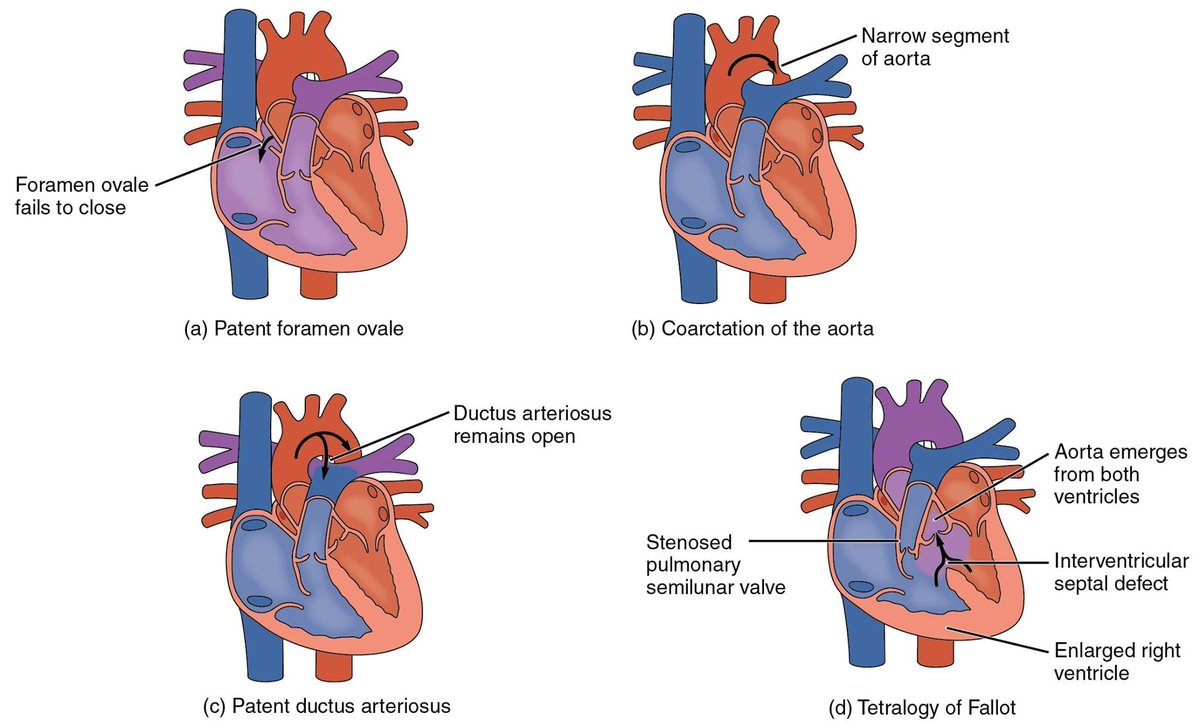 В этих случаях показана операция Patrick-McGoon или артериальное переключение.
В этих случаях показана операция Patrick-McGoon или артериальное переключение.
При аномальном прикреплении хордального аппарата трехстворчатого клапана к конусной перегородке и при наличии нависающего или «верхом сидящего» митрального клапана выполнение этого типа операции невозможно. Операцию рекомендуют выполнять в раннем младенческом возрасте как первичное вмешательство.
Если трехстворчатый и легочный клапаны расположены слишком близко, заплата должна быть размещена вокруг передневерхнего края легочного клапана.
Техника Patrick-McGoon была разработана для коррекции порока с косой или переднезадней ориентацией магистральных сосудов. Она предусматривает формирование длинного и геометрически сложного внутрижелудочкового туннеля, который проходит слева и спереди клапана легочной артерии, соединяя ДМЖП с аортой. Поскольку туннель проходит впереди легочной артерии, формирование его не зависит от расстояния между легочным и трехстворчатым клапанами. При этой методике часто требуется расширение ДМЖП, даже когда он нерестриктивный.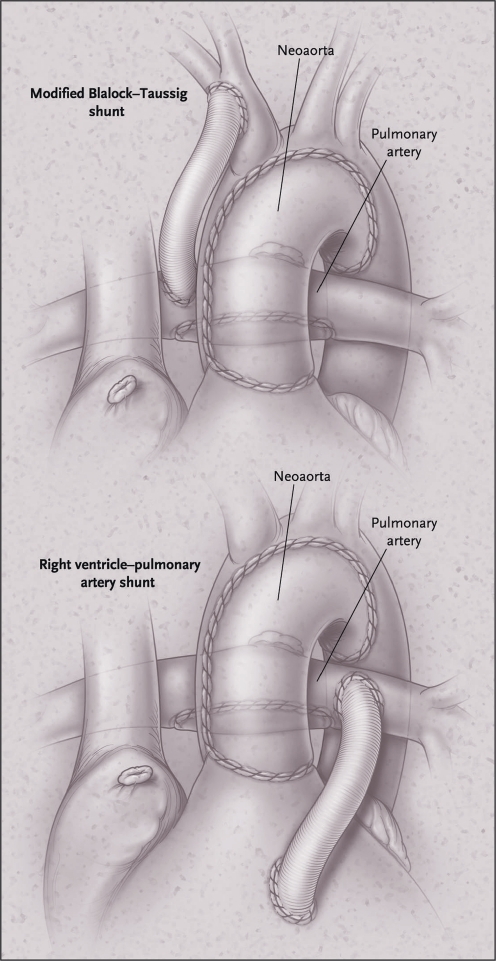 Хирургическая летальность — около 15%.
Хирургическая летальность — около 15%.
Операция Patrick-McGoon впоследствии была заменена на артериальное переключение.
Артериальное переключение с одновременным созданием внутрижелудочкового туннеля между ДМЖП и легочной артерией является предпочтительной операцией. Ее выбирают в случаях, когда отсутствует обструкция выходного тракта правого желудочка и когда левый желудочек технически проще соединить с легочной артерий, чем с аортой. Операция должна быть выполнена в течение первого месяца жизни. Эталонный уровень летальности ниже 10%.
При удаленном ДМЖП у большинства больных технически возможно внутрижелудочковое туннелирование, за исключением случаев предсердного изомеризма, сочетающегося с выраженным в разной степени желудочковым дисбалансом. В этих ситуациях показана операция Fontan. Анатомическую коррекцию этого варианта порока впервые выполнил Kirklin в 1977 г. Несмотря на удобное для туннелирования расположение дефекта, летальность в недалеком прошлом достигала 50%. Сравнительно большую группу — 23 пациента — представили Belli и соавторы, которыми была произведена двухжелудочковая коррекция:
Сравнительно большую группу — 23 пациента — представили Belli и соавторы, которыми была произведена двухжелудочковая коррекция:
у 21 пациента выполнено туннелирование;
у 2 — операция артериального переключения с отведением легочной артерии в левый желудочек.
В половине случаев понадобилось расширение дефекта кпереди. У 2 пациентов с рестриктивным приточным ДМЖП и аномальным прикреплением хорд трехстворчатого клапана, препятствующим формированию субаортального тракта, пришлось отказаться от двухжелудочковой коррекции. Двое больных умерли на госпитальном этапе. Восемь пациентов подвергнуты 9 повторным операциям, 6 из них — по поводу субаортального стеноза. Примерно такие же результаты с применением артериального переключения и внутрижелудочковым туннелированием у 10 пациентов с одним летальным исходом представили Lacour-Gayet и соавторы. Barbero-Marcial и соавторы предложили использование нескольких заплат для коррекции ДВПЖ с удаленным ДМЖП. Эта техника облегчает операцию, делая ее реальной, когда коррекция с помощью одной заплаты представляется невозможной.
Эта техника облегчает операцию, делая ее реальной, когда коррекция с помощью одной заплаты представляется невозможной.
Одним из наиболее сложных вариантов удаленного дефекта является полная форма AВСД. Некоторым больным из этой подгруппы может быть выполнена двухжелудочковая коррекция, другим — одножелудочковая паллиативная гемодинамическая операция по Fontan. Wilkinson в 2002 г. представил результаты хирургических вмешательств у 23 пациентов, перенесших различные радикальные и паллиативные операции, с одним летальным исходом. Tchervenkov считает условием, облегчающим создание тракта оттока левого желудочка, резекцию перегородки и увеличение дефекта кпереди, назвав его «транслокацией дефекта межжелудочковой перегородки». При сопутствующем сужении легочного выводного пути использовался кондуит.
Сопутствующий клапан-наездник, крисс-кросс сердце и гипоплазия одного из желудочков практически исключают возможность выполнения двухжелудочковой коррекции. Для лечения сложных анатомических комплексов применяется гемодинамическая коррекция по Fontan. В последние годы непосредственные и среднесрочные результаты этого типа операций значительно улучшились благодаря внедрению этапного лечения и фенестрации внутрипредсердного туннеля.
В последние годы непосредственные и среднесрочные результаты этого типа операций значительно улучшились благодаря внедрению этапного лечения и фенестрации внутрипредсердного туннеля.
В Петербурге прооперировали сердце 5-дневного малыша с помощью 3-D моделирования
Кардиохирурги Петербургского педиатрического университета осваивают новую методику операций у детей с тяжелыми пороками сердца — с помощью 3-D моделирования. Как говорят петербургские врачи, в мире эту технологию в области кардиохирургии только начинают применять. В СПбГПМУ с ее помощью лечили 5-дневного малыша.
Новая технология дает многообещающий эффект и повышает качество операций у наиболее тяжелых пациентов, говорят петербургские врачи. Суть технологии в том, что перед серьезным хирургическим вмешательством врачи создают 3-D модель сердца конкретного ребенка.
— Внимательно изучив сердце ребенка с помощью компьютерной томографии, врачи, по результатам исследований, воссоздают точную копию сердца пациента, — рассказывают в СПбГПМУ. — Создав 3-D модель сердца ребенка, врачи изучают и планируют этапы операции на уже напечатанной модели, а затем проводят операцию на сердце пациента. Операция с предварительным 3-D-моделированием — безальтернативный вариант в случаях с наиболее тяжелыми пороками сердца. Эта методика позволяет уточнить структуру потока крови внутри сердца, а также дает возможность получить полную детализацию органа, необходимую для планирования тактики хирургического лечения.
— Создав 3-D модель сердца ребенка, врачи изучают и планируют этапы операции на уже напечатанной модели, а затем проводят операцию на сердце пациента. Операция с предварительным 3-D-моделированием — безальтернативный вариант в случаях с наиболее тяжелыми пороками сердца. Эта методика позволяет уточнить структуру потока крови внутри сердца, а также дает возможность получить полную детализацию органа, необходимую для планирования тактики хирургического лечения.
Читайте также: Лео Бокерия прооперировал ребенка с пороком сердца в Педиатрическом университете
По новой технологии кардиохирурги Педиатрического университета уже провели первую операцию крошечному пациенту из Воркуты, который поступил в клинику на 5-е сутки жизни. У малыша был диагностирован сложный тип врожденного порока сердца — аномалия Таусиг-Бинг. Как правило, детям с таким диагнозом в 20-30% случаев требуется повторная операция. По словам врачей, новая технология 3-D моделирования позволит полностью исключить такую необходимость у детей с тяжелыми пороками сердца.
Читайте также: Петербургские врачи будут спасать детей с пороками сердца без «лишней» операции
Также в числе преимуществ 3-D технологии кардиохирурги называют возможность наглядно рассказать родителям ребенка об имеющейся проблеме в его здоровье и плане операции, а также использовать 3D модели пороков сердца для повышения квалификации молодых врачей.
Справка
Аномалия Тауссиг–Бинга – редкий врожденный порок сердца (ВПС), относящийся к группе пороков с отхождением аорты и легочной артерии от правого желудочка (а не от двух желудочков) с дефектом межжелудочковой перегородки (ДМЖП).
© Доктор Питер
Детская кардиохирургия. Лечение сложных пороков сердца у детей. Горбатиков К. В.
Детская кардиохирургия. Лечение сложных пороков сердца у детей. Горбатиков К. В.
 19.09.2020
19.09.2020Врожденные пороки сердца остаются основной причиной детской смертности, поэтому требуют незамедлительного лечения. Отделение детской кардиохирургии «Medical City» имеет все возможности для оказания срочной медицинской помощи детям с диагностированными пороками сердца. Своими достижениями, в частности проведением жизнеспасающих операций с первых дней жизни ребенка, отделение известно не только в России, но и за рубежом.
Какие проблемы решает детская кардиохирургия
К врожденным порокам сердца относят внутриутробные аномалии развития сердечно-сосудистой системы, например, следующие:
- открытый артериальный проток;
- дефекты межпредсердной и межжелудочковой перегородок;
- коарктация аорты;
- стеноз легочного ствола;
- тетрада и пентада Фалло;
- аномалия Эбштейна;
- гипоплазия правого желудочка.

- транспозиция аорты и легочного ствола;
- синдром Тауссиг — Бинга;
- трехкамерное сердце с единым желудочком и другие.
- и другие
Для диагностики врожденных пороков сердца в «Medical City» доступны наиболее эффективные и современные методики: ЭХО-кардиография, допплеровское сканирование, ангиография. Также для диагностики может быть использована сцинтиграфия. Это исследование по-своему уникально: для получения объективных результатов нужно сохранять неподвижность, а поскольку дети не могут быть статичными, используется анестезиологическое пособие, что могут предложить не во всех клиниках.
Анестезиология и реанимация
В работе с детьми, особенно новорожденными, особое внимание со стороны медицинских работников уделено анестезиологическим и реанимационным мероприятиям: именно анестезиологи проводят подготовку к операции и помогают выходить ребенка после сложнейших операций.
В «Medical City» работают специалисты с международной практикой, которые отвечают за следующие этапы лечения:
- Предоперационная подготовка.
- Подведение искусственного кровообращения.
- Послеоперационное лечение в реанимационной палате.
- Проведение реанимационных мероприятий при возникновении критической ситуации.
- Использование эфферентных методов детоксикации.
Для обеспечения безопасности детей во время лечения легочной гипертензии в отделении установлено оборудование для дозирования оксида азота, системы согревания, станции дозированного введения лекарственных средств. Для новорожденных оборудованы открытые реанимационные системы для быстрого оказания необходимой помощи. Состояние ребенка контролируется по показаниям кардиомониторов, церебральных оксиметров.
Если у ребенка наблюдается сопутствующая пороку сердца патология, собирается врачебная комиссия, которая и определяет оптимальный курс лечения. При этом поступающим в срочном порядке пациентам не нужно ждать: все необходимые подготовительные мероприятия будут проведены в день поступления.
При этом поступающим в срочном порядке пациентам не нужно ждать: все необходимые подготовительные мероприятия будут проведены в день поступления.
Лечение врожденных пороков сердца в «Medical City»
Для лечения сложных пороков сердца используют эндоваскулярные методики, поскольку открытые операции ребенок в малом возрасте может просто не перенести.
Эндоваскулярные технологии подразумевают отсутствие открытого вмешательства и надрезов, что особенно важно для новорожденных, поскольку операция:
- Не требует подведения искусственного кровообращения.
- Проходит легче для ребенка, и его можно переводить в палату к родителям спустя несколько часов.
- Не оставляет шрамов, которые могли бы способствовать развитию комплексов.
Эндоваскулярные технологии подразумевают введение в артериальный просвет сосудистых устройств через прокол. Таким устройством может быть окклюдер, который продвигают по артерии до патологического очага и проводят операцию. Использование таких технологий позволило лечить жизнеугрожающие патологии детей с первого дня жизни, даже при малом весе и в критическом состоянии.
Использование таких технологий позволило лечить жизнеугрожающие патологии детей с первого дня жизни, даже при малом весе и в критическом состоянии.
В зависимости от диагноза могут быть использованы авторские методики, которыми владеют единицы хирургов: операции Hi-класса Росса, Никайдо и Норвуд. Для лечения комбинированных и сложных пороков оборудована гибридная операционная с современным ангиографом, которая впервые в России появилась именно в «Medical City». Нашим пациентам доступны сложные операции, например, стентирование выводного отдела правого желудочка, которое является относительно новой методикой для России.
Детская кардиохирургия — всё ради спасения жизни ваших детей
Заведующий отделением детской кардиохирургии — Горбатиков Кирилл Викторович. Сердечно-сосудистый хирург высшей категории, врач с мировым именем — к нему едут родители, дети которых находятся в критической ситуации, отправляют маленьких пациентов врачи из Москвы и других столиц. Почему они выбирают именно «Medical City»? По следующим причинам:
Почему они выбирают именно «Medical City»? По следующим причинам:
- Поддержка на всех этапах. Мы поможем организовать трансфер ребенка, встретим вас в аэропорту и доставим в отделение для оказания срочной помощи.
- Современная диагностика. Для вас доступны все мощности современной диагностической аппаратуры: сцинтиграфия, ангиография и другие методики.
- Лучшее лечение. Опыт Кирилла Викторовича, уникальные методики, возможности гибридной операционной — всё это позволяет эффективно лечить даже сложные врожденные пороки, например, тетрада фалло.
- Профессиональный подход. В «Medical City» врачи выбирают курс лечения не по желанию пациента, а по возможной эффективности тех или иных манипуляций. Ещё до приезда, при необходимости, врач-консультант может обратиться к заведующему отделением, для уточнения возможной тактики хирургического вмешательства.
- Поддержка после операции. Для поддержания жизни маленького пациента оборудовано реанимационное отделение с необходимой аппаратурой.

При всей современности и эффективности лечения «Medical City» отличается доступной стоимостью лечения. Так, маммарно-коронарное шунтирование в Европе стоит 14-30 тыс. €, а в Тюмени — 6,8 тыс. € при том же уровне.
Если вашему ребенку нужна помощь, не медлите. Звоните нам по телефону: +7 (3452) 560-550.
Краткосрочные и среднесрочные результаты тотальной коррекции аномалии Тауссига – Бинга
Было проведено ретроспективное исследование всех случаев аномалии ТБ, диагностированной в период с июня 2001 г. по апрель 2009 г. В исследование были включены пациенты, перенесшие хирургическое вмешательство. Диагноз был поставлен после того, как данные эхокардиографии пациента были проанализированы как минимум двумя педиатрическими кардиологами. Все случаи лечил один хирург. Выбор хирургической техники (ASO + восстановление VSD против Rastelli) был основан на анатомических элементах, в основном на положении VSD по отношению к аорте, а также степени легочной обструкции.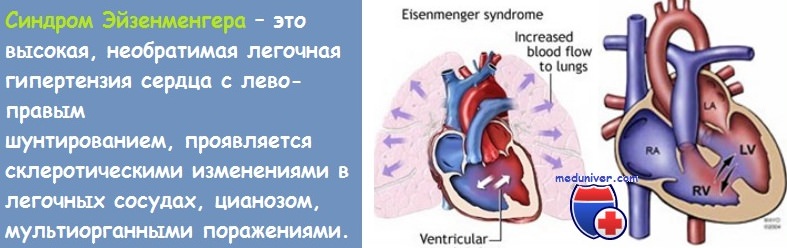 Данные оперативного и послеоперационного наблюдения были собраны путем анализа нашей базы данных и анализа карт из медицинских записей. Было получено одобрение институционального исследовательского комитета.
Данные оперативного и послеоперационного наблюдения были собраны путем анализа нашей базы данных и анализа карт из медицинских записей. Было получено одобрение институционального исследовательского комитета.
Эхокардиография
Трансторакальная эхокардиография (эхо) проводилась для каждого пациента перед операцией с использованием аппаратов HP Sonos 5500 и Philips IE 33 (Hewlett Packard, Хьюстон, Техас). Подробные диагнозы были основаны на сочетании эхокардиографии и хирургического обследования. В нашей текущей серии определение DORV включало всех пациентов, у которых обе великие артерии исходили из правого желудочка в соответствии с правилом 50%: одна большая артерия (аортальная) полностью выходит из правого желудочка, а вторая артерия (легочная) выходит на> 50%. от правого желудочка с неправильно расположенными магистральными артериями.Наблюдение за пациентом обычно проводилось с интервалом в 1, 3 и 6 месяцев после операции, а затем не реже одного раза в год после этого. В случаях, когда у пациента было отмечено развитие обструкции желудочкового тракта оттока (VOT) при последующем наблюдении после восстановления, градиент оттока оценивался, определялся и оценивался с точки зрения необходимости повторного вмешательства. Необходимость повторного вмешательства рассматривалась, если пиковый эхо-допплеровский градиент через правую VOT (RVOT) составлял> 50 мм рт. Ст., А через левую VOT (LVOT) был> 60 мм рт.
В случаях, когда у пациента было отмечено развитие обструкции желудочкового тракта оттока (VOT) при последующем наблюдении после восстановления, градиент оттока оценивался, определялся и оценивался с точки зрения необходимости повторного вмешательства. Необходимость повторного вмешательства рассматривалась, если пиковый эхо-допплеровский градиент через правую VOT (RVOT) составлял> 50 мм рт. Ст., А через левую VOT (LVOT) был> 60 мм рт.
Хирургическая техника
Все процедуры выполнялись через срединную стернотомию. Искусственное кровообращение (CPB) было установлено путем стандартной аортальной и двухкавальной венозной канюляции. ЛЖ был декомпрессирован путем вентиляции через правую верхнюю легочную вену. Для защиты миокарда использовали антеградную холоднокровную кардиоплегию. У пациентов, перенесших первичную АСО, после наложения поперечного зажима аорты, ДМЖП обычно обнажали через правое предсердие и легочную артерию и закрывали с помощью политетрафторэтиленового пластыря Gortex 0. Толщина 4 мм. После пережатия аорты пересекали восходящую аорту и главную легочную артерию. Устье левой и правой коронарных артерий визуализировали и вырезали из корня аорты с прилегающей стенкой аорты в виде «кнопок». Затем дистальная легочная артерия и ее ветви были выдвинуты вперед (маневр LeCompte), а дистальный отдел аорты — кзади. Дистальный отдел аорты был анастомозирован с (новым) корнем аорты, как описано Эдвардом и Бове. Затем пуговицы коронарной артерии были сдвинуты кзади и имплантированы в обращенные наружу синусы корня главной легочной артерии.Затем была проведена реконструкция легочной артерии с использованием пластыря из аутологичного свежего перикарда. Закрытие дефекта межпредсердной перегородки завершило ASO. В случае расположенных рядом магистральных артерий либо легочная артерия оставалась позади аорты, либо, в случае процедуры LeCompte, было выполнено перемещение главной легочной артерии в правую легочную артерию, чтобы избежать компрессии. Реконструкция дуги проводилась у пациента при глубокой гипотермической остановке кровообращения при 18 ° C, но в большинстве случаев использовалась селективная церебральная перфузия в сочетании с умеренной гипотермической остановкой кровообращения с охлаждением тела до 25–28 ° C.
Толщина 4 мм. После пережатия аорты пересекали восходящую аорту и главную легочную артерию. Устье левой и правой коронарных артерий визуализировали и вырезали из корня аорты с прилегающей стенкой аорты в виде «кнопок». Затем дистальная легочная артерия и ее ветви были выдвинуты вперед (маневр LeCompte), а дистальный отдел аорты — кзади. Дистальный отдел аорты был анастомозирован с (новым) корнем аорты, как описано Эдвардом и Бове. Затем пуговицы коронарной артерии были сдвинуты кзади и имплантированы в обращенные наружу синусы корня главной легочной артерии.Затем была проведена реконструкция легочной артерии с использованием пластыря из аутологичного свежего перикарда. Закрытие дефекта межпредсердной перегородки завершило ASO. В случае расположенных рядом магистральных артерий либо легочная артерия оставалась позади аорты, либо, в случае процедуры LeCompte, было выполнено перемещение главной легочной артерии в правую легочную артерию, чтобы избежать компрессии. Реконструкция дуги проводилась у пациента при глубокой гипотермической остановке кровообращения при 18 ° C, но в большинстве случаев использовалась селективная церебральная перфузия в сочетании с умеренной гипотермической остановкой кровообращения с охлаждением тела до 25–28 ° C. Простая коарктация аорты была исправлена расширенным анастомозом конец в конец, но у пациентов с гипоплазией или прерыванием дуги аорты чаще всего выполнялась реконструкция дуги аорты с помощью бляшки перикарда крупного рогатого скота для достижения соответствия размеров неоаорты и восходящей аорты. После реконструкции дуги сосудистый зажим был перемещен, и петли вокруг сосудов дуги были освобождены, так что дуга аорты и нисходящая аорта были реперфузированы. У пациентов, которым требовалась процедура Растелли, после CPB и пережатия аорты дефект межжелудочковой перегородки был визуализирован с помощью правой вентрикулотомии.На место была зашита большая внутрижелудочковая перегородка, закрывающая дефект межжелудочковой перегородки и перенаправляющая отток левого желудочка к аортальному клапану, расположенному ближе к переднему краю. У некоторых пациентов для достижения непрерывности от правого желудочка к легочной артерии использовался клапанный канал гомотрансплантата.
Простая коарктация аорты была исправлена расширенным анастомозом конец в конец, но у пациентов с гипоплазией или прерыванием дуги аорты чаще всего выполнялась реконструкция дуги аорты с помощью бляшки перикарда крупного рогатого скота для достижения соответствия размеров неоаорты и восходящей аорты. После реконструкции дуги сосудистый зажим был перемещен, и петли вокруг сосудов дуги были освобождены, так что дуга аорты и нисходящая аорта были реперфузированы. У пациентов, которым требовалась процедура Растелли, после CPB и пережатия аорты дефект межжелудочковой перегородки был визуализирован с помощью правой вентрикулотомии.На место была зашита большая внутрижелудочковая перегородка, закрывающая дефект межжелудочковой перегородки и перенаправляющая отток левого желудочка к аортальному клапану, расположенному ближе к переднему краю. У некоторых пациентов для достижения непрерывности от правого желудочка к легочной артерии использовался клапанный канал гомотрансплантата.
Послеоперационное ведение критических состояний
Послеоперационное лечение было сосредоточено на обеспечении адекватного снижения постнагрузки и умеренной инотропной поддержки, что позволило восстановить миокард после CPB. Пациенты получали адекватную седацию и вентиляцию легких в течение первых 24–48 часов после операции для предотвращения внезапного легочного гипертонического криза, особенно в группе с неограниченным легочным кровотоком до операции. Пациенты получали вазопрессоры и вазодилататоры по мере необходимости для поддержания адекватной кардиореспираторной стабильности после операции. Пациентов отлучили от аппарата ИВЛ и экстубировали после обеспечения гемодинамической стабильности и хорошей респираторной функции.
Пациенты получали адекватную седацию и вентиляцию легких в течение первых 24–48 часов после операции для предотвращения внезапного легочного гипертонического криза, особенно в группе с неограниченным легочным кровотоком до операции. Пациенты получали вазопрессоры и вазодилататоры по мере необходимости для поддержания адекватной кардиореспираторной стабильности после операции. Пациентов отлучили от аппарата ИВЛ и экстубировали после обеспечения гемодинамической стабильности и хорошей респираторной функции.
Статистический анализ
Непрерывные переменные выражаются как средние значения ± стандартное отклонение или медианы (диапазон).Переменные, включая демографические характеристики, предыдущие паллиативные процедуры, морфологию, паттерн коронарных артерий и переменные, связанные с оперативными процедурами, сравнивались и оценивались с использованием теста Стьюдента t для непрерывных переменных и критерия хи-квадрат для категориальных переменных.
Правый желудочек с двойным выходом: ремонт, симптомы и типы
Обзор
Что такое двойной выход правого желудочка?
Двойной выход правого желудочка (DORV) — врожденный порок сердца.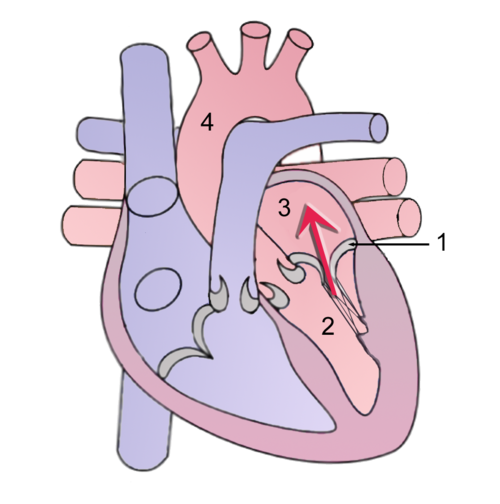 В утробе матери происходит порок развития сердца плода, ведущего к правому желудочку, который имеет две основные артерии, а именно аорту и легочную артерию.
В утробе матери происходит порок развития сердца плода, ведущего к правому желудочку, который имеет две основные артерии, а именно аорту и легочную артерию.
Чем отличаются сердца с ДОРВ?
Нормальное сердце имеет четыре камеры: два предсердия вверху и два желудочка внизу. Два основных кровеносных сосуда или «большие» артерии обычно соединяются с желудочками.
- Аорта выходит из левого желудочка и переносит кровь к остальному телу.
- Легочная артерия выходит из правого желудочка и забирает кровь в легкие. Кровь забирает кислород для тела.
При DORV обе магистральные артерии соединяются с правым желудочком — полностью или частично. В левом желудочке есть только часть одной из великих артерий или нет артерии вообще.
В зависимости от связей с правым желудочком, организм может получать кровь, ненасыщенную кислородом, или легкие могут получать чрезмерный кровоток.Сердцу приходится усерднее работать, чтобы восполнить недостаток. DORV также может вызвать попадание слишком большого количества крови в легкие. Этот дополнительный поток может повредить как сердце, так и легкие.
DORV также может вызвать попадание слишком большого количества крови в легкие. Этот дополнительный поток может повредить как сердце, так и легкие.
Насколько распространен DORV?
DORV встречается редко. Это случается только один раз на каждые 6000–10 000 новорожденных.
Существуют ли разные виды ДОРВ?
У детей с DORV всегда есть дефект межжелудочковой перегородки (VSD). ВСД — это отверстие в перегородке, стенке между двумя желудочками. Кровь течет через отверстие и между желудочками.Другая возможная сопутствующая аномалия — стеноз клапана легочной артерии.
Поставщики медицинских услуг классифицируют DORV по расположению отверстия:
- DORV с субаортальным VSD: VSD находится прямо под аортой.
- DORV с сублегочной ДМЖП (также называемой Тауссиг-Бингом): ДМЖП находится непосредственно под легочной артерией.
- DORV с двояковыпуклой VSD: Есть VSD под каждой из магистральных артерий.

- DORV с незавершенным (или удаленным) VSD: VSD не находится рядом с аортой или легочной артерией.
Симптомы и причины
Что вызывает ДОРВ?
Ученые не до конца понимают, что вызывает DORV. В некоторых случаях это случается с младенцами, у которых проблемы с хромосомами, клеточными структурами, в которых хранится их ДНК.
Каковы симптомы ДОРВ?
Симптомы DORV обычно появляются в первые дни или недели после рождения.Они похожи на симптомы других врожденных проблем с сердцем и включают:
- Цианоз (синюшная или пурпурная кожа, губы или ногти).
- Затрудненное дыхание, такое как тахипноэ (действительно учащенное дыхание) или одышка.
- Проблемы с приемом пищи или набора веса.
- Шум в сердце (дополнительный звук при сердцебиении, который медицинский работник может услышать с помощью стетоскопа).

- Сильное потоотделение, например, во время еды.
- Тахикардия (пульс быстрее 100 ударов в минуту).
- Необычная сонливость или кажущееся «неумение».
Какие еще проблемы могут быть у ребенка с DORV?
Младенцы с ДОРВ часто имеют другие врожденные проблемы:
- Цилиарная дисфункция: Проблемы возникают из-за крошечных волосоподобных структур, выстилающих дыхательные пути.
- Гетеротаксия: Органы в груди и животе не на привычных местах.
- Мальротация кишечника: При мальротации кишечника кишечник ребенка скручивается, что является ненормальным.
- Легочный стеноз: При легочном стенозе легочный клапан (между правым желудочком и легочной артерией) слишком маленький или жесткий.
- Гипоплазия желудочков: Один или оба желудочка меньше нормы.
Диагностика и тесты
Когда ставится диагноз ДОРВ?
Иногда медицинские работники могут обнаружить порок сердца еще до рождения ребенка. Они могут сделать это во время обычного ультразвукового обследования, которое называется эхокардиограммой плода.
Они могут сделать это во время обычного ультразвукового обследования, которое называется эхокардиограммой плода.
В противном случае DORV обычно диагностируется через несколько дней или недель после рождения, поскольку у ребенка есть симптомы.
Какие тесты понадобятся ребенку для подтверждения DORV?
Иногда поставщик медицинских услуг обнаруживает DORV еще до рождения ребенка. В других случаях первые признаки проблемы с сердцем обнаруживаются еще с рождения. В любом случае ребенку нужно обследование:
- Врач будет искать признаки цианоза.
- С помощью стетоскопа врач послушает сердце.
- Врач будет использовать пульсоксиметрию (пульсоксиметрию) для измерения количества кислорода в крови. Тест прост и безболезненен.
Затем поставщик медицинских услуг может заказать один или несколько тестов:
- Первичные визуализационные тесты : КТ, МРТ и рентген — распространенные способы делать снимки внутри тела.

- Электрокардиограмма (ЭКГ или ЭКГ): Электрокардиограмма — это безболезненный тест, который измеряет электрическую активность сердца.
- Эхокардиограмма (эхо): Эхокардиограмма также безболезненна и измеряет звуковые волны от грудной клетки для создания изображений сердца .
- Катетеризация сердца (катетеризация сердца): Катетеризация сердца также называется ангиограммой. Тонкая трубка проходит через вену в сердце, чтобы получить подробную информацию о работе сердца.
Ведение и лечение
Как лечится ДОРВ?
Почти все дети с DORV нуждаются в операции на открытом сердце в течение первого года жизни.Ваш лечащий врач поможет вам принять решение об операции, учитывая:
- Другие проблемы с сердцем или другими органами ребенка.

- Общее состояние здоровья.
- Тип ДОРВ.
Хирург может воспользоваться одним из следующих подходов:
- Бивентрикулярная пластика (также называемая артериальным переключением): Если оба желудочка в хорошей форме и DORV не сложен, хирург может порекомендовать бивентрикулярную пластику. При таком подходе аорта перемещается в левый желудочек.
- Внутрижелудочковая пластика: Хирург создает через ДМЖП туннель для соединения аорты с левым желудочком. Туннель называется перегородкой.
- Оджелудочковая пластика (операция по Фонтану): В более сложных случаях DORV хирург может порекомендовать эту процедуру. Он перенаправляет кровоток из нижней части тела в легкие.
Профилактика
Могу ли я предотвратить ДОРВ?
Невозможно предотвратить ДОРВ. Ученые все еще пытаются понять его причину.
Ученые все еще пытаются понять его причину.
Перспективы / Прогноз
Каковы перспективы для ребенка с DORV?
Без операции ребенок с DORV в конечном итоге разовьется:
При бивентрикулярном восстановлении люди часто живут нормальной жизнью, по крайней мере, со средней продолжительностью жизни.Люди, которым потребовались другие процедуры, могут иметь более короткую продолжительность жизни, и им может потребоваться дополнительная операция в более позднем возрасте. Каждому, кто перенес операцию по поводу DORV, требуется пожизненная помощь кардиолога.
Каковы риски хирургического вмешательства?
У большинства младенцев операции по поводу DORV имеют хорошие результаты. Но любая операция на сердце имеет риски, такие как:
- Кровотечение.

- Сгустки крови, которые могут вызвать инсульт или сердечный приступ.
- Инфекция.
- Проблемы при выходе из наркоза.
- Дыхательная недостаточность.
- Необычный сердечный ритм и блокада сердца, требующий кардиостимулятора.
Жить с
О чем я должен спросить у врача, обслуживающего моего ребенка?
- Какой DORV есть у моего ребенка?
- Какая операция необходима?
- Когда моему ребенку следует делать операцию?
- Каковы риски хирургического вмешательства?
- Каковы риски отказа от операции?
- Нужно ли моему ребенку обратиться к специалисту?
- Сможет ли операция исправить дефект, или моему ребенку потребуются дополнительные операции?
- Нужно ли моему ребенку принимать лекарства?
Записка из клиники Кливленда
Правый желудочек с двойным выходом — это серьезное заболевание, которое возникает, когда сердце не развивается должным образом в утробе матери. Хотя это может привести к серьезным проблемам с сердцем и легкими, своевременное лечение может обезопасить вашего ребенка. Хирургия и регулярные осмотры могут помочь людям, рожденным с DORV, жить более здоровой и долгой жизнью.
Хотя это может привести к серьезным проблемам с сердцем и легкими, своевременное лечение может обезопасить вашего ребенка. Хирургия и регулярные осмотры могут помочь людям, рожденным с DORV, жить более здоровой и долгой жизнью.
Операция первичного артериального переключателя как стратегия полной коррекции аномалии Тауссиг-Бинга: 21-летний опыт
Учебных вопросов:
Каковы отдаленные результаты после операции переключения артерий (ASO) при аномалии Тауссига-Бинга?
Методы:
Ретроспективный обзор проводился в едином центре.Измерения результатов включали госпитальную смертность, позднюю смертность, функциональный класс и необходимость повторного вмешательства.
Результатов:
В период с 1990 по 2011 год у 43 пациентов с аномалией Тауссига-Бинга произошел артериальный переход. Обструкция дуги аорты присутствовала у 70%. Госпитальная летальность составила 7% (n = 3), а поздняя смертность — 2% (n = 1). Все пациенты имели функциональный класс I Нью-Йоркской кардиологической ассоциации.Свобода от повторного вмешательства (как хирургического, так и транскатетерного) составила 73% через 1 год, 64% через 5 лет и 60% через 10 лет. По данным многофакторного анализа, предоперационная оценка кольца аортального клапана Z ≤-2,5 была связана с повторным вмешательством (отношение рисков 7,66; 95% доверительный интервал 1,29-45,6; p = 0,03).
Обструкция дуги аорты присутствовала у 70%. Госпитальная летальность составила 7% (n = 3), а поздняя смертность — 2% (n = 1). Все пациенты имели функциональный класс I Нью-Йоркской кардиологической ассоциации.Свобода от повторного вмешательства (как хирургического, так и транскатетерного) составила 73% через 1 год, 64% через 5 лет и 60% через 10 лет. По данным многофакторного анализа, предоперационная оценка кольца аортального клапана Z ≤-2,5 была связана с повторным вмешательством (отношение рисков 7,66; 95% доверительный интервал 1,29-45,6; p = 0,03).
Выводы:
Авторы пришли к выводу, что первичная коррекция аномалии Тауссига-Бинга с помощью ASO может быть достигнута с низкой смертностью и хорошими долгосрочными результатами, хотя и с высокой частотой повторного вмешательства.
Перспектива:
Аномалия Тауссига-Бинга — это редкий и сложный врожденный порок сердца с двойным выходом правого желудочка с дефектом сублегочной межжелудочковой перегородки и часто ассоциированными поражениями выходного тракта правого желудочка и обструкции дуги аорты. Больничная летальность, указанная в этом исследовании, согласуется с данными о выживаемости при других сложных процедурах переключения артерий.Недавнее исследование из базы данных по врожденной кардиохирургии Общества торакальных хирургов показало, что смертность при выписке составляет 2,2% для ASO при d-транспозиции магистральных артерий, 5,5% для ASO с закрытием дефекта межжелудочковой перегородки и 7% для ASO с закрытием дефекта межжелудочковой перегородки. и ремонт арок. Хотя аномалия Тауссига-Бинга представляет собой сложное поражение с относительно высокой заболеваемостью и необходимостью повторного вмешательства, долгосрочные результаты кажутся хорошими.
Больничная летальность, указанная в этом исследовании, согласуется с данными о выживаемости при других сложных процедурах переключения артерий.Недавнее исследование из базы данных по врожденной кардиохирургии Общества торакальных хирургов показало, что смертность при выписке составляет 2,2% для ASO при d-транспозиции магистральных артерий, 5,5% для ASO с закрытием дефекта межжелудочковой перегородки и 7% для ASO с закрытием дефекта межжелудочковой перегородки. и ремонт арок. Хотя аномалия Тауссига-Бинга представляет собой сложное поражение с относительно высокой заболеваемостью и необходимостью повторного вмешательства, долгосрочные результаты кажутся хорошими.
Клинические темы: Кардиохирургия, Врожденные пороки сердца и детская кардиология, Инвазивная сердечно-сосудистая ангиография и вмешательство, Кардиохирургия и ИБС и педиатрия, Врожденные пороки сердца, ИБС, педиатрия и вмешательства, ИБС, педиатрия и улучшение качества, вмешательства и структуры сердца Болезнь
Ключевые слова: Многомерный анализ, Больничная смертность, Заболеваемость, Транспозиция магистральных сосудов, Доверительные интервалы, Двойной выход правого желудочка, Кардиохирургические процедуры, Нью-Йорк, Желудочки сердца, Дефекты перегородки сердца
<Вернуться к списку
Правый желудочек с двойным выходом | Техасский институт сердца
Двойной выход правого желудочка (DORV) — редкая форма врожденного порока сердца.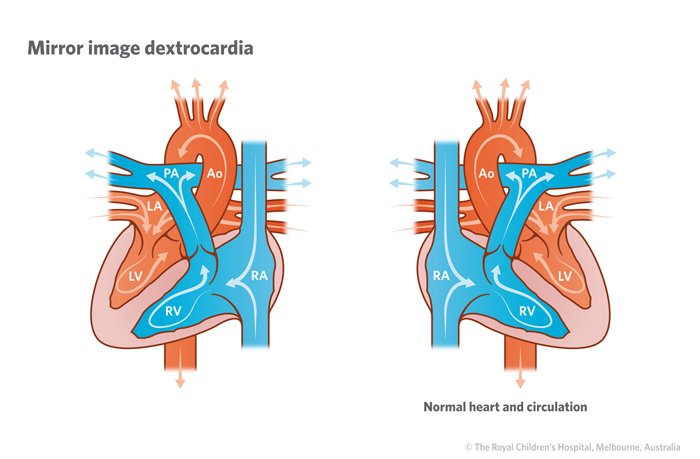
Двойной выход правого желудочка (DORV) — редкая форма врожденного порока сердца. В нормальном сердце легочная артерия отправляет бедную кислородом кровь из правого желудочка в легкие, а аорта отправляет богатую кислородом кровь из левого желудочка в остальную часть тела. Вместе легочная артерия и аорта известны как великие артерии.Но с DORV оба больших сосуда соединяются с правым желудочком.
Младенцы, рожденные с DORV, обычно имеют дефект межжелудочковой перегородки (VSD). ДМЖП — это отверстие в стенке, которое разделяет нижние камеры сердца, позволяя части крови выталкиваться в правый желудочек вместо того, чтобы нормально течь к остальной части тела.
Сначала этот ДМЖП очень помогает детям с ДОРВ, потому что это единственный путь, по которому богатая кислородом кровь может попасть в аорту и в организм. Тем не менее, количество богатой кислородом крови, которая достигает тела, недостаточно. Желудочки могут переутомиться. Пытаясь снабдить организм достаточным количеством крови, левый желудочек может качать кровь сильнее и быстрее, чем обычно. Эта дополнительная работа может привести к увеличению сердца.
Тем не менее, количество богатой кислородом крови, которая достигает тела, недостаточно. Желудочки могут переутомиться. Пытаясь снабдить организм достаточным количеством крови, левый желудочек может качать кровь сильнее и быстрее, чем обычно. Эта дополнительная работа может привести к увеличению сердца.
Какие бывают типы DORV?
Существует 4 типа DORV. Тип DORV зависит от того, где находится VSD по отношению к магистральным артериям.
- ДОРВ с субаортальным ДМЖП. Это означает, что ДМЖП расположен чуть ниже аорты. При этом типе DORV кровь течет из левого желудочка через VSD в аорту. Кровь из правого желудочка в основном поступает в легочную артерию.
- ДОРВ с сублегочной ВСД. Это означает, что ДМЖП расположен ниже легочной артерии. Этот тип DORV еще называют аномалией Тауссига-Бинга. При этом типе DORV богатая кислородом кровь течет из левого желудочка через ДМЖП в легочную артерию.Бедная кислородом кровь из правого желудочка поступает в основном в аорту.

- DORV с двунаправленным VSD. Это означает, что есть 2 ДМЖП — один под аортой и один под легочной артерией.
- DORV с необязательным (или удаленным) VSD. Это означает, что ДМЖП не расположен рядом с аортой или легочной артерией.
Каковы симптомы DORV?
Где находится VSD, можно определить признаки и симптомы DORV.Наиболее частые признаки и симптомы DORV могут не проявляться в течение нескольких дней или недель после рождения.
Одышка
Шумы в сердце
потеет
Сильная усталость
Учащенное или затрудненное дыхание
Голубоватый цвет кожи (цианоз)
Нет интереса к кормлению
Потеря веса или отсутствие прибавки в весе
Как лечится ДОРВ?
Лечение DORV зависит от типа DORV у ребенка, возраста ребенка и степени серьезности DORV. В большинстве случаев DORV предпочтительнее хирургическое вмешательство. Основные цели хирургического вмешательства — соединить аорту с левым желудочком, а легочную артерию — с правым желудочком.
В большинстве случаев DORV предпочтительнее хирургическое вмешательство. Основные цели хирургического вмешательства — соединить аорту с левым желудочком, а легочную артерию — с правым желудочком.
Один из видов хирургического вмешательства, который используется для коррекции DORV, называется внутрижелудочковой пластикой. При внутрижелудочковой пластике хирурги создают туннель (называемый перегородкой). Перегородка создается через ДМЖП и соединяет аорту с левым желудочком.
Другой тип хирургии называется артериальным переключением, чтобы изменить положение артерий, так что легочная артерия соединяется с правым желудочком, а аорта соединяется с левым желудочком.Любые ДМЖП также закрываются во время этой операции.
2019-A-1475-AATS-279
279. Анатомические факторы, связанные с повторным вмешательством после операции артериального переключателя у пациентов с аномалией Тауссиг-Бинга
Анатомические факторы, связанные с повторным вмешательством после операции артериального переключателя у пациентов с аномалией Тауссиг-Бинга
Ясуюки Кобаяши, Ясухиро Котани, Йосуке Куроко, Синго Касахара
Госпиталь университета Окаямы, Окаяма
Цель: Уникальная анатомия аномалии Тауссига-Бинга затрудняет достижение оптимального хирургического лечения, включая операцию переключения артерий (ASO) и реконструкцию дуги аорты.Мы стремились оценить отдаленный клинический результат и определить факторы, связанные с повторным вмешательством, особенно при стенозе легочной артерии (PS) после операции артериального переключения.
Методы: Ретроспективный обзор был проведен у 38 пациентов с аномалией Тауссига-Бинга в период с 1993 по 2018 год. 34 пациентам было выполнено хирургическое лечение с использованием ASO. Пациенты, перенесшие операцию Кавасима (n = 1), процедуру Дамуса-Ки-Станселя с операцией Растелли (n = 1) и операцию Фонтана (n = 2), были исключены.
Результаты: Средний возраст и масса тела в ASO составляли 43 (16-102) дня и 3,6 (2,8-3,8) кг соответственно. Обструкция дуги аорты (КоА) присутствовала у 22 пациентов (64%). У 14 (41%) пациентов были коронарные аномалии, включая единственную коронарную артерию. Госпитальная летальность составила 11% (n = 4), у 3 из 4 пациентов был септический шок и у 1 пациента была фибрилляция желудочков, связанная с коронарной ишемией. Средний срок наблюдения составил 17,1 (9,6-21,0) года. Поздняя летальность составила 2,9% (n = 1). Общая выживаемость при последующем наблюдении составила 85%.12 (36%) пациентов перенесли 26 повторных вмешательств. Причиной повторного вмешательства был PS у 13 пациентов, повторный КоА у 8 пациентов и обструкция выводного тракта правого желудочка у 4 пациентов. Отношение размера нативного кольца легочной артерии к размеру кольца аорты у пациентов с повторным вмешательством, связанным с PS, было значительно больше, чем у пациентов без повторного вмешательства (1,69 против 1,41, p = 0,02). Сопутствующая реконструкция дуги аорты с помощью ASO была связана с более высокой частотой повторного вмешательства, связанного с PS (90% vs.59%, р <0,001).
Сопутствующая реконструкция дуги аорты с помощью ASO была связана с более высокой частотой повторного вмешательства, связанного с PS (90% vs.59%, р <0,001).
Выводы: Независимо от сложной анатомии коронарных артерий и связанных аномалий ранняя и поздняя выживаемость была удовлетворительной. Часто требовались повторные вмешательства, особенно в легочных артериях. Послеоперационный PS был тесно связан с пациентами, имеющими КоА и более крупный нативный легочный клапан, что позволяет предположить, что во время ASO требуется оптимальная хирургическая реконструкция для достижения соответствующих аорто-легочных анатомических отношений с реконструкцией дуги.
Правый желудочек с двойным выходом (DORV)
Правый желудочек с двойным выходом (DORV) — это врожденный порок сердца, то есть он присутствует при рождении. Это происходит, когда сердце не формируется должным образом во время развития плода. В большинстве случаев причина неизвестна.
DORV — это сложная аномалия, которая имеет множество вариаций и обычно включает также другие пороки сердца.
Что происходит в DORV?
Есть две основные артерии, по которым кровь выходит из сердца: аорта и легочная артерия, также известные как «магистральные сосуды».”
В нормальном сердце:
- Аорта , соединена с левым желудочком , , камерой сердца, которая перекачивает красную, богатую кислородом кровь в тело
- Легочная артерия , соединена с правым желудочком , , камерой сердца, которая перекачивает голубую, бедную кислородом кровь в легкие
У детей с DORV и аорта, и легочная артерия соединены с правым желудочком.
A.D.A.M Interactive Anatomy®
Кроме того, почти все дети с DORV также имеют дефект межжелудочковой перегородки (VSD), аномальное отверстие в стенке между левым и правым желудочками, через которое течет кровь с каждой стороны сердца — богатая кислородом и бедная кислородом кровь — смешать вместе.
Для младенцев с DORV это отверстие полезно, так как это единственный путь, по которому насыщенная кислородом кровь достигает правого желудочка, где соединяется аорта, и выкачивается в организм.
Однако, поскольку кровь смешанная, в ней не так много кислорода, как следовало бы.
Риски для ребенка
У младенцев с DORV сердце должно работать больше, чем обычно, чтобы перекачивать достаточно насыщенной кислородом крови в организм, что может вызвать увеличение сердца. Слишком много крови также может попасть в легкие ребенка.
Без лечения риски включают высокое кровяное давление и сердечную недостаточность.
Типы дефектов межжелудочковой перегородки (ДМЖП)
Существует четыре типа дефектов межжелудочковой перегородки, которые возникают при DORV, в зависимости от того, где находится отверстие:
- Субаортальный VSD расположен ниже аорты, позволяя богатой кислородом крови течь из левого желудочка через VSD в аорту.Кровь из правого желудочка в основном поступает в легочную артерию.
- Подлегочный VSD расположен ниже легочной артерии, состояние, известное как аномалия Тауссига-Бинга.
 Богатая кислородом кровь течет из левого желудочка через ДМЖП в легочную артерию. Бедная кислородом кровь из правого желудочка поступает в основном в аорту.
Богатая кислородом кровь течет из левого желудочка через ДМЖП в легочную артерию. Бедная кислородом кровь из правого желудочка поступает в основном в аорту. - Двойной ДМЖП означает наличие двух ДМЖП, один ниже аорты и один ниже легочной артерии.
- Удаленный (не фиксированный) VSD означает, что отверстие не находится рядом с аортой или легочной артерией.
Типы ДОРВ
DORV различается для каждого ребенка в зависимости от расположения ДМЖП, расположения аорты и легочной артерии (которые обычно расположены бок о бок) и других сердечных дефектов. Влияние этих переменных на нормальный кровоток через сердце определит прогноз ребенка и необходимое вмешательство.
Существует три основных типа DORV:
- Тетралогия Фалло (TOF) — состояние, включающее четыре аномалии, встречающиеся вместе, включая сужение легочного клапана или артерии (легочный стеноз), уменьшение легочного кровотока
- Транспозиция магистральных артерий (TGA) — когда положение аорты и легочного артерии переключается или «перемещается»
- VSD DORV — наиболее распространенный тип DORV с избыточным кровообращением в легких (усиление притока крови к легким) и отсутствием обструкции оттока
Факторы риска
DORV встречается примерно у 6–15 младенцев на 100 000 живорождений.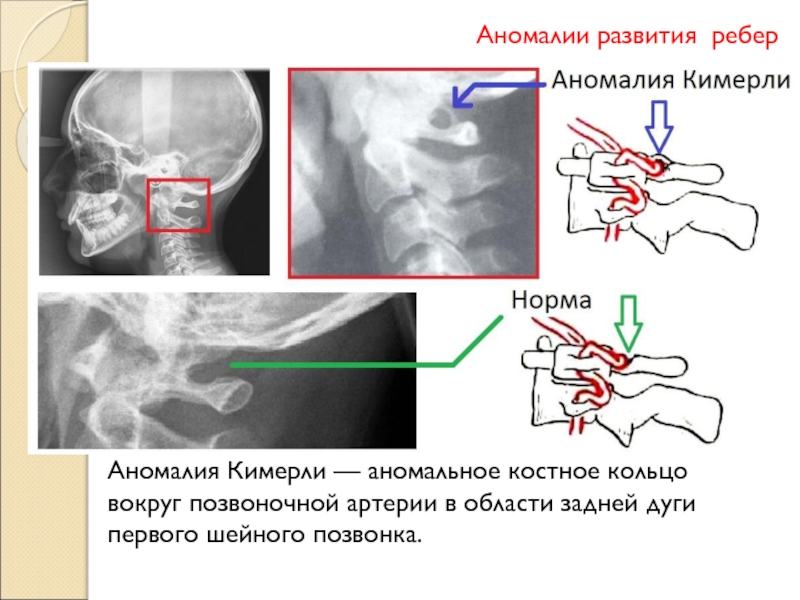 Это чаще встречается у мужчин.
Это чаще встречается у мужчин.
Младенцы с определенными генетическими аномалиями подвержены повышенному риску двойного выхода правого желудочка, включая трисомию 13 и трисомию 18.
Генетическое консультирование и тестирование рекомендуется всем женщинам, беременным с DORV.
Симптомы
Новорожденные с DORV обычно проявляют признаки заболевания в течение нескольких дней после рождения.
Хотя признаки и симптомы могут различаться для каждого ребенка, в целом они могут включать:
- Учащенное или затрудненное дыхание
- Шумы в сердце
- Учащенное сердцебиение
- Потливость
- Сильная усталость
- Синий оттенок кожи, губ или ногтей (цианоз) из-за недостатка кислорода в крови
- Нет интереса к кормлению
- Похудание или плохой набор веса
Диагноз
Во время беременности
Двойной выход правого желудочка может быть обнаружен до рождения во время обычного пренатального УЗИ. Ваш акушер-гинеколог направит вас к детскому кардиологу, который выполнит эхокардиограмму плода (УЗИ сердца), чтобы лучше рассмотреть и оценить структуру сердца и кровоток вашего ребенка.
Ваш акушер-гинеколог направит вас к детскому кардиологу, который выполнит эхокардиограмму плода (УЗИ сердца), чтобы лучше рассмотреть и оценить структуру сердца и кровоток вашего ребенка.
Вы и ваш ребенок будете находиться под пристальным наблюдением на протяжении всей беременности. В вашу команду по уходу будут входить специалисты по медицине матери и плода, детские кардиохирурги, детские кардиологи и неонатологи для хорошо спланированного и скоординированного подхода к дородовой помощи, родам и лечению после родов.
После рождения
В других случаях DORV не может быть обнаружен до тех пор, пока ребенок не родится и не покажет такие признаки и симптомы, как проблемы с дыханием, синий оттенок кожи или шум в сердце, звук крови, ненормально движущейся в сердце.
Тесты для подтверждения диагноза могут включать:
- Пульсоксиметрия для измерения уровня кислорода в кровотоке ребенка
- Рентген грудной клетки
- Электрокардиограмма (ЭКГ или ЭКГ) для измерения электрической активности сердца
- Эхокардиограмма для просмотра структуры сердца и кровотока
- МРТ или КТ сердца для более детальной визуализации сердца
- Катетеризация сердца для дальнейшего обследования сердца и дефекта
Лечение
Операция необходима для исправления двойного выхода правого желудочка, что позволяет крови нормально оттекать от сердца к телу и легким.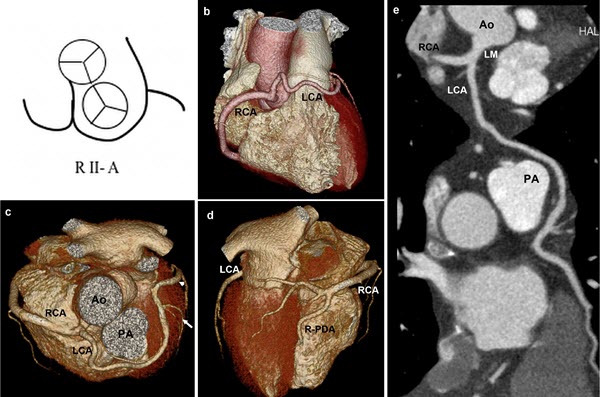
Время и тип операции зависят от дефекта каждого ребенка, других сердечных аномалий и общего состояния здоровья. Если симптомы тяжелые, операция может быть проведена в первые несколько дней после рождения. В сложных случаях может потребоваться серия операций.
Последующее наблюдение
Младенцы, рожденные с DORV, должны будут продолжать посещать кардиолога на протяжении всей жизни, а в зрелом возрасте перейти к кардиологу, который специализируется на лечении взрослых с врожденными пороками сердца.
Детская школа Техаса — № 1 в стране по детской кардиологии и кардиохирургии
Детский павильон для женщин Техаса и Детский фетальный центр Техаса — это признанные на национальном уровне центры по уходу за плодами и младенцами с врожденными пороками сердца, где в одном месте предоставляются экспертные услуги по уходу за матерями и младенцами.
Мы предлагаем комплексную кардиологическую помощь плода в рамках нашей программы кардиологии плода, включая диагностику, консультирование, планирование родов и беспрепятственный переход на лечение в Техасском детском кардиологическом центре® после рождения. Детский кардиологический центр Техаса занимает первое место в стране по детской кардиологии и кардиохирургии по версии U.S. News and World Report.
Детский кардиологический центр Техаса занимает первое место в стране по детской кардиологии и кардиохирургии по версии U.S. News and World Report.
Объемы и результаты
Дополнительные ресурсы
Аномальная правая коронарная артерия из легочной артерии при аномалии Тауссига-Бинга — Отпечаток пальца — Профили экспертов UTMB Health Research
Аномальная правая коронарная артерия из легочной артерии при аномалии Тауссига-Бинга — отпечаток пальца — Профили экспертов UTMB по исследованиям в области здравоохранения- Сортировать по
- Масса
- По алфавиту
Медицина и науки о жизни
- Двойной выход правого желудочка
- Легочная артерия
- Коронарные сосуды
- Вынужденная остановка сердца
- Дефекты межжелудочковой перегородки сердца
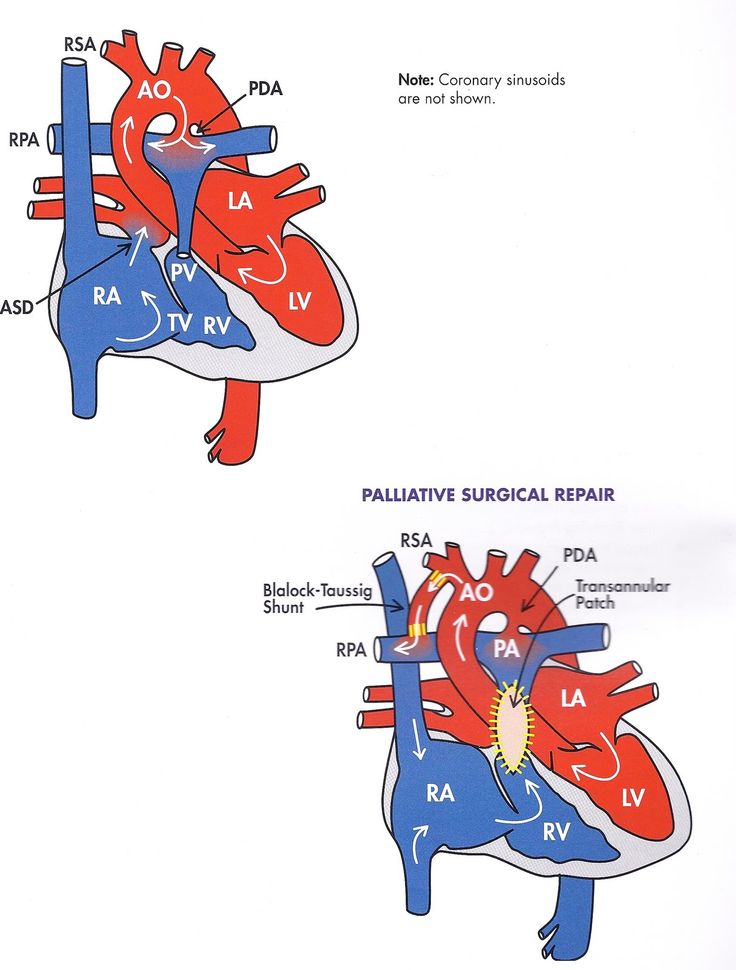

 А.Н. Бакулева
А.Н. Бакулева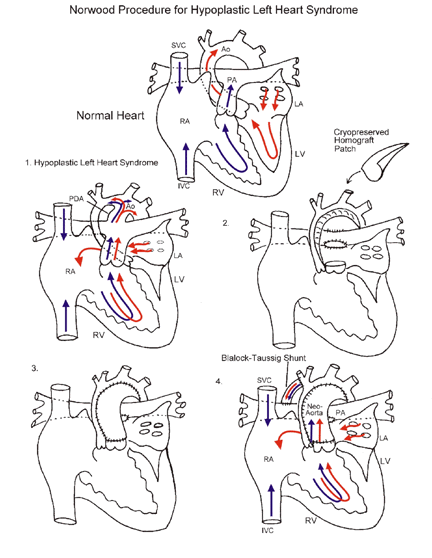 А., Лекции по сердечно-сосудистой хирургии. В 2-х томах. Москва, 2001, Т. 1, стр 482-490.
А., Лекции по сердечно-сосудистой хирургии. В 2-х томах. Москва, 2001, Т. 1, стр 482-490.
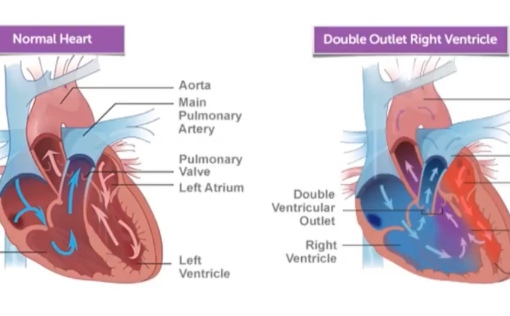

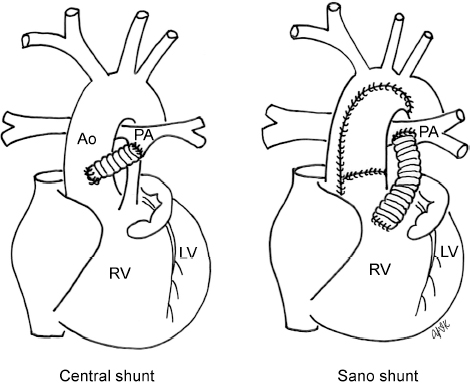



 Богатая кислородом кровь течет из левого желудочка через ДМЖП в легочную артерию. Бедная кислородом кровь из правого желудочка поступает в основном в аорту.
Богатая кислородом кровь течет из левого желудочка через ДМЖП в легочную артерию. Бедная кислородом кровь из правого желудочка поступает в основном в аорту.