17β-эстрадиол
СТАЙЛАБ предлагает тест-системы для определения 17β-эстрадиола в мясе и в плазме коровьей крови.
| Иммуноферментный метод анализа (ИФА), стрипованный планшет | R2301 RIDASCREEN ® 17β-Ostradiol |
| Биосистемы для определения эстрогенов и ксеноэстрогенов | ER CALUX® |
| Стандартные растворы |
R2399 RIDA® 17β — Őstradiol Spiking Solution |
LCS-5070 cтандарт 17-бета-эстрадиола SPEX |
17-бета-эстрадиол, который часто называют эстрадиолом – это основной и наиболее активный женский половой гормон. Он относится к группе эстрогенов – женских стероидных гормонов. 17β-эстрадиол вырабатывается яичниками (у женских организмов), плацентой (при беременности), корой надпочечников (у обоих полов) и, в небольших количествах, семенниками (у мужских организмов), а также в периферических тканях. Как и другие эстрогены, эстрадиол разрушается в печени. Одним из предшественников этого гормона является тестостерон.
Эстрадиол совместно с другими эстрогенами и прогестероном
 При беременности содержание 17-бета-эстрадиола в крови достигает высоких концентраций с максимумом за несколько дней до родов. Анализ содержания этого гормона и его соотношения с прогестероном позволяет более точно выявлять сроки овуляции и беременных особей, а также определять сроки отела за 12-24 часа до него.
При беременности содержание 17-бета-эстрадиола в крови достигает высоких концентраций с максимумом за несколько дней до родов. Анализ содержания этого гормона и его соотношения с прогестероном позволяет более точно выявлять сроки овуляции и беременных особей, а также определять сроки отела за 12-24 часа до него.17β-эстрадиол входит в состав некоторых оральных контрацептивов, средств для лечения бесплодия и гормональных препаратов. Его используют для лечения рака простаты. В тех концентрациях, в которых эстрадиол обычно присутствует в организме, он предотвращает многие сердечно-сосудистые заболевания, в том числе, атеросклероз.
Как и другие эстрогены, эстрадиол, участвует в формировании половой системы и молочных желез, а также способствует росту костей в ходе полового созревания. Иногда это его свойство используют для улучшения роста сельскохозяйственных животных. Определить, что животные получали 17-бета-эстрадиол, можно по значительному повышению его концентрации в крови. С территорий ферм это вещество может попадать в окружающую среду и воздействовать на других животных, в том числе, на рыбу, приводя к смещению соотношения полов в сторону женского.
Согласно «Единым санитарно-эпидемиологическим и гигиеническим требованиям к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)», содержание гормонов в пищевых продуктах животного происхождения должно контролироваться.
Для определения 17-бета-эстрадиола в настоящее время используют иммунохимические методы, в том числе, иммуноферментный анализ (ИФА). Он позволяет проводить одновременное исследование большого количества проб, не требует сложного оборудования и обладает высокой чувствительностью.
Литература
- Физиология человека. Под ред. Р. Шмидта и Г. Тевса. 3-е издание. Москва «МИР» 2005.
- Березов Т. Т., Коровкин Б. Ф. Биологическая химия: Учебник.– 3-е изд., перераб. и доп.– М.: Медицина, 1998.
- Eric R. Prossnitz and Matthias Barton.
 Estrogen Biology: New Insights into GPER Function and Clinical Opportunities Mol Cell Endocrinol. 2014 May 25; 389(0): 71–83.
Estrogen Biology: New Insights into GPER Function and Clinical Opportunities Mol Cell Endocrinol. 2014 May 25; 389(0): 71–83. - Saint-Dizier M, Chastant-Maillard S. Methods and on-farm devices to predict calving time in cattle. Vet J. 2015 Sep;205(3):349-56.
- Blackwell BR, Wooten KJ, Buser MD, Johnson BJ, Cobb GP, Smith PN. Occurrence and Characterization of Steroid Growth Promoters Associated with Particulate Matter Originating from Beef Cattle Feedyards. Environ Sci Technol. 2015 Jul 21;49(14):8796-803.
инструкция по применению, аналоги, статьи » Справочник ЛС
Эстрогенный препарат — 17-бета-эстрадиол идентичен эндогенному эстрадиолу (образующемуся в организме женщин, начиная с первой менструации вплоть до менопаузы), вырабатываемому яичниками. В клетках органов, на которые направлено действие гормонов, эстрогены образуют комплекс со специфическими рецепторами (обнаружены в различных органах — в матке, влагалище, мочеиспускательном канале, молочной железе, печени, гипоталамусе, гипофизе), комплекс рецептор-лиганд взаимодействует с эстроген-эффекторными элементами генома и специфическими внутриклеточными протеинами, индуцирующими синтез и-РНК, протеинов и высвобождение цитокинов и факторов роста. Оказывает феминизирующее влияние на организм. Стимулирует развитие матки, маточных труб, влагалища, стромы и протоков молочных желез, пигментацию в области сосков и половых органов, формирование вторичных половых признаков по женскому типу, рост и закрытие эпифизов длинных трубчатых костей. Способствует своевременному отторжению эндометрия и регулярным кровотечениям, в больших концентрациях вызывает гиперплазию эндометрия, подавляет лактацию, угнетает резорбцию костной ткани, стимулирует синтез ряда транспортных белков (тироксинсвязывающий глобулин, транскортин, трансферрин, протеин, связывающий половые гормоны), фибриногена. Оказывает прокоагулянтное действие, увеличивает синтез в печени витамин К-зависимых факторов свертывания крови (II, VII, IX, X), снижает концентрацию антитромбина III.
Фармакокинетика
После приема внутрь быстро и полностью всасывается (биодоступность около 100%), большее количество эстрадиола, прежде чем попасть в кровоток, метаболизируется в просвете (микрофлорой) и стенке кишечника, а также в печени (что приводит к нефизиологически высоким концентрациям эстрона в плазме, а при длительной терапии — к кумуляции эстрона и эстрона сульфата).

Клинические исследование Генетическое расстройство: 17-бета эстрадиол, 17-бета эстрадиол — Реестр клинических исследований
| Вмешательство | Тип вмешательства: Препарат, средство, медикамент Название вмешательства: 17-бета эстрадиол Описание: 5-15 мкг / кг ежедневно в течение 2 лет. Дозу корректируют каждые 3 месяца. Принимается устно Этикетка Arm Group: Индивидуальная доза Тип вмешательства: Препарат, средство, медикамент Название вмешательства: 17-бета эстрадиол Описание: 0,2 мкг в день в течение 12 месяцев, дозу увеличивают до 0,5 мкг в день в течение 12 месяцев. Принимается устно Этикетка Arm Group: Фиксированная доза | Расположение |
|
|---|
Сдать анализ на Эстрадиол (Е2) в лаборатории KDL
Эстрадиол (Е2) — основной и наиболее активный из эстрогенов в организме. У женщин он регулирует репродуктивную функцию и наряду с прогестероном обеспечивает сохранение беременности. Большая часть эстрадиола у женщин синтезируется в яичниках, небольшое количество синтезируется корой надпочечников. Во время беременности плацента к синтезу эстрогенов присоединяется плацента. У мужчин эстрогены синтезируются в яичках и надпочечниках.
У женщин он регулирует репродуктивную функцию и наряду с прогестероном обеспечивает сохранение беременности. Большая часть эстрадиола у женщин синтезируется в яичниках, небольшое количество синтезируется корой надпочечников. Во время беременности плацента к синтезу эстрогенов присоединяется плацента. У мужчин эстрогены синтезируются в яичках и надпочечниках.
В каких случаях обычно назначают анализ уровня эстрадиола в крови?
Анализ на эстрадиол (Е2) используется при обследовании по поводу бесплодия, при нарушениях менструального цикла, при мониторинге гормональной или антиэстрогенной терапии. Этот тест важен при наличии признаков остеопороза. Мониторинг уровня эстрадиола является необходимым при применении репродуктивных технологий, так как извлечение яйцеклеток проводится в определенной фазе развития фолликула, связанной с уровнем эстрадиола в крови.
Что именно определяется в процессе анализа?
Определяется концентрация эстрадиола в крови методом хемилюминесцентного иммуноанализа на микрочастицах с использованием моноклональных антител к эстрадиолу.
Что означают результаты теста?
Низкий уровень эстрадиола при повышенных значениях ФСГ и ЛГ может быть признаком первичной яичниковой недостаточности. Также низкие значения эстрадиола наблюдаются в периоде менопаузы и могут выявляться при синдроме поликистозных яичников.
Повышенные уровни эстрадиола могут быть обусловлены физиологическими причинами (беременность, предовуляторный пик эстрадиола), патологией печени или наличием новообразований, производящих эстрогены.
Прием препарата Фулвестрант (конкурентный антагонист рецепторов эстрогенов) может искажать результаты анализа на эстрадиол.
Обычно анализ на эстрадиол сдается вместе с другими гормонами (ФСГ, ЛГ, прогестерон и т.д)
Обычный срок выполнения теста.
Обычно результат эстрадиола можно получить в течение 1 дня
Нужна ли специальная подготовка к анализу?
Желательно сдавать на 3-5 день менструального цикла, если лечащий врач не назначил иначе.
Анжелик микро таб п/об пленочной 0.25мг+0.5мг 28 шт
Фармакологическая группа:
Противоклимактерическое средство комбинированное (эстроген + прогестаген).
Фармакологические свойства:
Ультранизкодозированный препарат с дроспиреноном для заместительной гормональной терапии.
Фармакодинамика:
Препарат Анжелик Микро содержит 17-бета-эстрадиол, химически и биологически идентичный эндогенному человеческому эстрадиолу, и синтетический прогестаген дроспиренон. 17-бета-эстрадиол обеспечивает замещение гормона во время и после менопаузы. Добавление дроспиренона обеспечивает контроль над кровотечениями и противодействует развитию вызванной эстрогенами гиперплазии эндометрия.
Эффекты эстрадиола:
Угасание функции яичников, сопровождаемое уменьшением продукции эстрогенов и прогестерона, приводит к развитию менопаузального синдрома, который характеризуется вазомоторными и органическими симптомами. Заместительная гормональная терапия (ЗГТ) показана для лечения этих симптомов.
Из всех натуральных эстрогенов эстрадиол является наиболее активным и обладает наибольшей аффинностью (силой связывания) по отношению к эстрогеновым рецепторам. Органы-мишени для эстрогенов включают в себя, в частности, матку, гипоталамус, гипофиз, влагалище, молочные железы, кости (остеокласты).
Прочие эффекты эстрогенов включают: снижение концентрации инсулина и глюкозы в крови, опосредованные рецепторами вазоактивные эффекты и независимое от рецепторов воздействие на гладкомышечные клетки стенок сосудов. Рецепторы эстрогенов были идентифицированы в сердце и коронарных артериях. Пероральный прием натуральных эстрогенов имеет преимущества в случаях гиперхолестеринемии благодаря более благоприятному влиянию на метаболизм липидов в печени.
Терапия препаратом Анжелик Микро в течение 2 лет приводила к увеличению минеральной плотности костной ткани приблизительно на 3–5%, в то время, как при приеме плацебо минеральная плотность костной ткани снижалась примерно на 0,5%.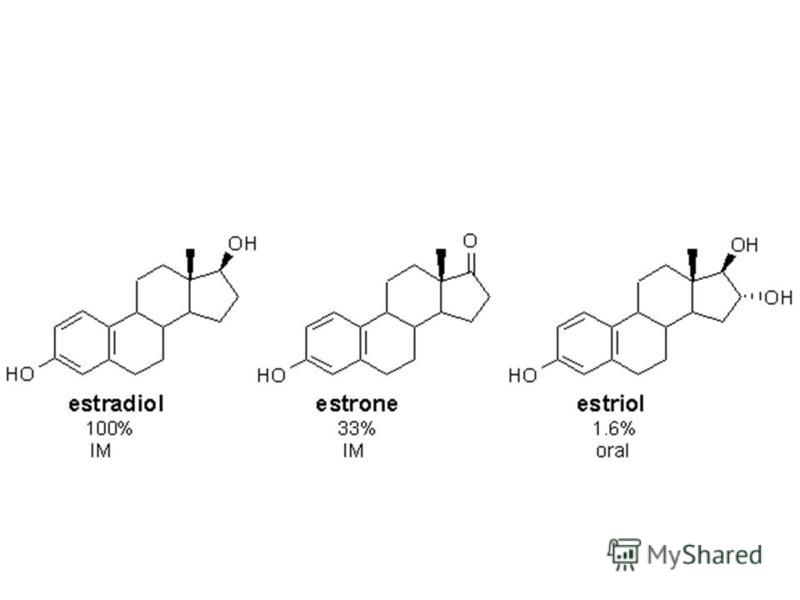 Была обнаружена значительная статистическая разница между показателями минеральной плотности костной ткани в костях таза у пациенток в группах активного лечения (с остеопенией и без остеопении), по сравнению с плацебо. Также отмечалось увеличение минеральной плотности костной ткани во всем теле и в поясничном отделе позвоночника у пациенток из группы активного лечения.
Была обнаружена значительная статистическая разница между показателями минеральной плотности костной ткани в костях таза у пациенток в группах активного лечения (с остеопенией и без остеопении), по сравнению с плацебо. Также отмечалось увеличение минеральной плотности костной ткани во всем теле и в поясничном отделе позвоночника у пациенток из группы активного лечения.
Продолжительная ЗГТ снижает риск переломов периферических костей у женщин в постменопаузе без остеопороза.
ЗГТ также положительно влияет на содержание коллагена в коже, плотность кожи, и может задержать процесс образования морщин.
Монотерапия эстрогенами обладает дозозависимым стимулирующим действием на митозы и пролиферацию эндометрия и, таким образом, повышает частоту развития гиперплазии эндометрия и, следовательно, риск развития рака эндометрия. Во избежание развития гиперплазии эндометрия, необходима комбинация с прогестагенами.
Эффекты дроспиренона:
Дроспиренон оказывает очень сходные с естественным прогестероном фармакодинамические воздействия.
Прогестагенная активность: Дроспиренон является мощным прогестагеном с центральным ингибирующим действием на «гипоталамус-гипофизарно-яичниковую ось». У женщин репродуктивного возраста дроспиренон оказывает контрацептивное действие; при введении дроспиренона в виде монопрепарата овуляция подавляется. Пороговая доза дроспиренона для подавления овуляции составляет 2 мг/сутки. Полная трансформация подвергшегося ранее воздействию эстрогенов эндометрия происходит после приема дозы 4 или 6 мг/сутки в течение 10 дней (= 40 — 60 мг на цикл).
Непрерывная заместительная гормональная терапия препаратом Анжелик® Микро позволяет избежать регулярных кровотечений «отмены», которые наблюдаются при циклической или фазовой ЗГТ. В течение первых месяцев лечения кровотечения и «мажущие» выделения достаточно часто встречаются, но с течением времени их частота снижается.
Комбинация действующих веществ препарата Анжелик® Микро эффективно препятствует развитию вызванной эстрогенами гиперплазии эндометрия. После 12 месяцев терапии препаратом Анжелик® Микро у 71–77% женщин отмечалась атрофия эндометрия.
После 12 месяцев терапии препаратом Анжелик® Микро у 71–77% женщин отмечалась атрофия эндометрия.
Антиминералокортикоидная активность:
Дроспиренон обладает способностью к конкурентному антагонизму с альдостероном. Гипотензивное действие наиболее выражено у женщин с повышенным артериальным давлением (АД) при повышении доз дроспиренона. После 8 недель терапии препаратом Анжелик® Микро у пациенток с повышенным артериальным давлением показатели систолического/диастолического АД заметно снизились (снижение на 12 и 9 мм рт. ст. по сравнению с исходными показателями, по сравнению с плацебо – на 3/4 мм рт. ст.; при оценке 24 часовых амбулаторных показателей АД по сравнению с исходными показателями отмечено снижение на 5/3 мм рт. ст., по сравнению с плацебо – на 3/2 мм рт. ст. ). Действие препарата становится заметным через 2 недели, в то время как максимальный эффект достигается в течение 6 недель после начала терапии. Не ожидается соответствующих изменений АД у женщин с нормальным АД.
Женщины, которые в рамках клинического исследования получали в добавление к эстрадиолу дроспиренон, реже отмечали периферические отеки, чем принимавшие только эстрадиол.
Антиандрогенная активность:
Подобно естественному прогестерону, дроспиренон обладает антиандрогенными свойствами.
Влияние на углеводный обмен:
Дроспиренон не обладает ни глюкокортикоидной, ни антиглюкокортикоидной активностью, и не оказывает влияния на толерантность к глюкозе и инсулинорезистентность. При применении препарата Анжелик® Микро толерантность к глюкозе не нарушается.
Прочие свойства:
Препарат Анжелик® Микро положительно влияет на состояние здоровья и качество жизни. По данным опросника по женскому здоровью, благоприятное воздействие препарата Анжелик® значительно превысило эффект по сравнению с монотерапией эстрадиолом (абосолютный показатель). Этот высокий показатель объясняется главным образом улучшением соматических симптомов, уменьшением выраженности ощущения беспокойства/страхов, а также когнитивных нарушений.
Наблюдательные исследования и исследование конъюгированных конских эстрогенов (ККЭ) вместе с медроксипрогестерона ацетатом (МПА), проведенное WHI (Women’s Health Initiative — Инициатива во имя здоровья женщин), свидетельствуют о снижении заболеваемости раком толстой кишки у женщин в постменопаузе, принимающих ЗГТ. В исследовании WHI при монотерапии эстрогенами с использованием ККЭ снижения данного риска не наблюдалось. Неизвестно, распространяются ли полученные данные также и на другие препараты для ЗГТ.
Фармакокинетика:
Эстрадиол:
Абсорбция: после приёма внутрь эстрадиол быстро и полностью абсорбируется. В ходе абсорбции и «первого прохождения» через печень эстрадиол в значительной степени подвергается метаболизации, например, в эстрон, эстриол и эстрона сульфат. После перорального приема биодоступность эстрадиола составляет около 5%. Максимальная концентрация эстрадиола в плазме, составляющая приблизительно 16 пг/мл, обычно достигается через 2- 8 часов после приема таблетки. Прием пищи не влияет на биодоступность эстрадиола.
Распределение: после приёма внутрь препарата Анжелик® Микро наблюдается постепенное изменение концентрации эстрадиола в плазме крови в течение 24 часов. Из-за циркуляции эстроген сульфатов и глюкуронидов в широком диапазоне с одной стороны, кишечно-печеночной рециркуляции с другой, период полувыведения эстрадиола представляет собой сложный параметр, который зависит от всех этих процессов и находится в интервале 13-20 ч после приема внутрь.
Эстрадиол связывается неспецифически с сывороточным альбумином и специфически с глобулином, связывающим половые гормоны (ГСПГ). Свободная фракция эстрадиола в плазме составляет примерно 1-2%, а фракция вещества, связанного ГСПГ, находится в пределах 40—45%. После приема внутрь эстрадиол вызывает образование ГСПГ, который влияет на распределение сывороточных белков, вызывая увеличение ГСПГ-связанной фракции и уменьшение альбумин-связанной и несвязанной фракций, указывая на нелинейность фармакокинетики эстрадиола после приема препарата Анжелик® Микро. Кажущийся объем распределения эстрадиола после однократного внутривенного введения составляет около 1 л/кг.
Кажущийся объем распределения эстрадиола после однократного внутривенного введения составляет около 1 л/кг.
Метаболизм: эстрадиол метаболизируется преимущественно в печени, а также частично и в кишечнике, почках, скелетных мышцах и органах-мишенях. Эти процессы сопровождаются образованием эстрона, эстриола, катехолэстрогенов, а также сульфатных и глюкуронидных конъюгатов этих соединений, каждый из которых обладает существенно меньшей эстрогенной активностью или вообще не имеют эстрогенной активности. Концентрация эстрона в плазме в 6 раз выше, чем эстрадиола. Концентрация в плазме крови конъюгатов эстрона в 26 раз выше, чем соответствующие концентрации свободного эстрона.
Элиминация: клиренс эстрадиола из плазмы – около 30 мл/мин/кг. Метаболиты эстрадиола выводятся почками и через кишечник с периодом полувыведения, равным приблизительно 24 ч. Равновесная концентрация: при ежедневном применении препарата Анжелик® Микро равновесная концентрация эстрадиола в плазме крови достигается приблизительно через 5 дней. Концентрация эстрадиола в плазме увеличивается приблизительно в 2 раза. В среднем концентрация эстрадиола в плазме крови находится в пределах от 12 пг/мл (минимальный уровень) до 29 пг/мл (максимальный уровень).
Дроспиренон:
Абсорбция: после приема внутрь дроспиренон быстро и почти полностью абсорбируется. Как указано в приведенной ниже таблице, максимальные концентрации вещества в плазме крови достигаются приблизительно через 1 ч после одно- и многократного приема препарата Анжелик® Микро. Фармакокинетические характеристики дроспиренона зависят от полученной дозы в пределах 0,25–4 мг. Биодоступность составляет 76–85% и не зависит от приема пищи (при сравнении с приемом на голодный желудок).
Распределение: максимальная концентрация дроспиренона в плазме, составляющая около 3,35 нг/мл, достигается приблизительно через 1 час после однократного и многократного приема 0,25 мг дроспиренона. После этого наблюдается двухфазное снижение концентрации дроспиренона в плазме с конечным периодом полувыведения около 35-39 часов. Дроспиренон связывается с сывороточным альбумином и не связывается с ГСПГ и кортикоид-связывающим глобулином. Около 3-5% от общей концентрации дроспиренона в плазме не связано с белком.
Дроспиренон связывается с сывороточным альбумином и не связывается с ГСПГ и кортикоид-связывающим глобулином. Около 3-5% от общей концентрации дроспиренона в плазме не связано с белком.
Метаболизм: после приема внутрь дроспиренон в значительной степени метаболизируется. Основными метаболитами в плазме человека являются кислотная форма дроспиренона и 4,5-дигидро- дроспиренон-3-сульфат. Оба метаболита образуются без участия системы цитохрома Р450. Согласно данным in vitro дроспиренон в незначительной степени метаболизируется системой цитохрома P450 3A4.
Элиминация: клиренс дроспиренона из плазмы составляет 1,2-1,5 мл/мин/кг. Некоторая часть полученной дозы выводится в неизменном виде. Большая часть дозы выводится почками и через кишечник в виде метаболитов в соотношении 1,2: 1,4 с периодом полувыведения около 40 часов.
Равновесная концентрация: достигается примерно через 5 дней ежедневного приёма препарата Анжелик® Микро. Вследствие длительного периода полувыведения дроспиренона равновесная концентрация в 2-3 раза превышает концентрацию после однократного приёма.
Сдать анализ на эстрадиол (E2, Estradiol)
Метод определения Твёрдофазный хемилюминесцентный иммуноанализ.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Эстрадиол, Estradiol, 17-beta-estradiol, E2.
Краткая характеристика определяемого вещества Эстрадиол
Наиболее активный эстрогенный (женский) половой стероидный гормон.
У женщин вырабатывается в яичниках, в плаценте и в сетчатой зоне коры надпочечников под влиянием фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) и пролактина. В небольших количествах эстрадиол образуется в ходе периферического преобразования тестостерона. У мужчин эстрадиол образуется в семенниках, в коре надпочечников, но большая часть – в периферических тканях за счёт преобразования тестостерона.
У женщин эстрадиол обеспечивает формирование половой системы по женскому типу, развитие женских вторичных половых признаков в пубертатном периоде, становление и регуляцию менструальной функции, развитие яйцеклетки, рост и развитие матки в течение беременности; отвечает за психофизиологические особенности полового поведения. Обеспечивает формирование подкожной жировой клетчатки по женскому типу. Снижая сопротивление сосудов матки, повышает в ней кровоток и стимулирует гиперплазию эндометрия. Овуляция наступает через 24-36 часов после возникновения надпорогового уровня эстрадиола. Необходимым условием осуществления эффектов эстрадиола является правильное соотношение с уровнем тестостерона. Эстрадиол обладает анаболическим действием, усиливает обмен костной ткани и ускоряет созревание костей скелета. Способствует задержке натрия и воды в организме. Снижает уровень холестерина и повышает свёртывающую активность крови. Эстрадиол влияет на выделение нейротрансмиттеров, способствуя повышению нервного напряжения, раздражительности.
С какой целью определяют уровень Эстрадиола в крови
Определение уровня эстрадиола применяют для оценки функции яичников при нарушениях менструального цикла у женщин, а также при женском и мужском бесплодии, для выявления нарушений метаболизма стероидов, контроля гормональной терапии. Также возможно использовать этот тест в диагностике опухолей, вырабатывающих эстрогены, и при подозрении на нарушения метаболизма стероидов.
Что может повлиять на результат теста «Эстрадиол»
Суточные колебания концентрации эстрадиола в сыворотке связаны с ритмом секреции ЛГ (лютеинизирующего гормона): максимум приходится на период с 15 до 18 часов, а минимум – между 24 и 2 часами. У мужчин уровень эстрадиола прогрессивно увеличивается, у мальчиков увеличение происходит в меньшей степени. У женщин детородного возраста уровень эстрадиола в сыворотке крови и плазме зависит от фазы менструального цикла. В начале цикла концентрация эстрадиола медленно возрастает. Наиболее высокий уровень эстрадиола отмечается в позднюю фолликулярную фазу. После овуляции уровень гормона снижается, возникает второй, меньший по амплитуде, подъём. Затем наступает спад концентрации гормона, продолжающийся до конца лютеиновой фазы. Во время беременности концентрация эстрадиола в сыворотке и плазме нарастает к моменту родов, а после родов она возвращается к норме на четвертый день. С возрастом у женщин наблюдается снижение концентрации эстрадиола. В постменопаузу концентрация эстрадиола снижается до уровня, наблюдаемого у мужчин.
У мужчин уровень эстрадиола прогрессивно увеличивается, у мальчиков увеличение происходит в меньшей степени. У женщин детородного возраста уровень эстрадиола в сыворотке крови и плазме зависит от фазы менструального цикла. В начале цикла концентрация эстрадиола медленно возрастает. Наиболее высокий уровень эстрадиола отмечается в позднюю фолликулярную фазу. После овуляции уровень гормона снижается, возникает второй, меньший по амплитуде, подъём. Затем наступает спад концентрации гормона, продолжающийся до конца лютеиновой фазы. Во время беременности концентрация эстрадиола в сыворотке и плазме нарастает к моменту родов, а после родов она возвращается к норме на четвертый день. С возрастом у женщин наблюдается снижение концентрации эстрадиола. В постменопаузу концентрация эстрадиола снижается до уровня, наблюдаемого у мужчин.
Пределы определения: 37,0 — 40370 пмоль/л.
Анализ на эстрадиол – сдать по цене 440 руб. в Москве
Эстрадиол — стероидный эстрогенный гормон, который определяет развитие и нормальное функционирование женской репродуктивной системы. У женщин его синтезируют яичники, кора надпочечников, плацента. У мужчин эстрадиол в небольшом количестве выделяется яичками, а также образуется в периферических тканях в результате конверсии тестостерона и других андрогенов в эстроген под действием P450-ароматазы. До начала полового созревания уровень гормона у девочек и мальчиков сопоставим.
Эстрадиол обеспечивает формирование половой системы по женскому типу, участвует в регуляции менструального цикла и стимулирует гиперплазию эндометрия матки. Он повышает активность системы свёртывания крови, снижает уровень холестерина, усиливает тонус мочевого пузыря, обладает анаболическим действием.
Уровень эстрадиола в крови у женщин определяется фазой менструального цикла. Совместно с ЛГ, ФСГ и прогестероном он обеспечивает нормальное созревание фолликула, овуляцию и готовит матку к возможному наступлению беременности.
Пиковая концентрация достигается за 24 – 36 часов до овуляции (выхода зрелой яйцеклетки из яичника). Самый низкий уровень гормона наблюдается в начале менструального цикла. Второй пик уровня эстрадиола связан с активностью желтого тела и наступает в середине лютеиновой фазы менструального цикла на 8 – 10 день после овуляции.
Материал для исследования
Сыворотка крови.
Методика исследования
Хемилюминесцентный иммуноанализ.
Единицы измерения
Пг/мл (пикограмм на миллилитр).
Информация на странице не предназначена для самодиагностики и самолечения.
Проконсультируйтесь с лечащим врачом.
На результат исследования могут повлиять
Прием анаболических стероидов, глюкокортикостероидов, ряда антибиотиков, гормональных противозачаточных средств, нормотимиков способен привести к ложному завышению или занижению результата.
Истощение организма при нервной анорексии, резкая потеря веса, диета с низким содержанием жиров способствуют снижению уровня эстрадиола.
Эстрадиол — обзор | Темы ScienceDirect
3.18.3.2.1.1 Эстрадиол
Эстрадиол играет важную роль в обеспечении гомеостатической отрицательной обратной связи по высвобождению GnRH / LH как у мужчин, так и у женщин. Более того, у женщин реакция на обратную связь по эстрадиолу периодически переключается на положительную, вызывая преовуляторный всплеск GnRH / LH (см. Christian and Moenter, 2010 для дальнейшего обзора механизмов всплеска). Четкое требование эстрадиоловой обратной связи для правильной регуляции функции оси HPG и фертильности привело к усилению интереса к механизмам передачи сигналов эстрадиола и влиянию на функцию нейронов GnRH.Эстрадиол, вероятно, действует как непосредственно на нейроны GnRH через β-изоформу рецептора эстрадиола (ERβ) (Skynner et al., 1999; Hrabovszky et al., 2000, 2001; Herbison and Pape, 2001; Chu et al., 2009), и косвенно через вышестоящие клетки, которые экспрессируют рецептор эстрадиола α (ERα) и / или ERβ (Flugge et al. , 1986; Leranth et al., 1991; Pompolo et al., 2003; Eyigor et al., 2004; Wintermantel et al. , 2006).
, 1986; Leranth et al., 1991; Pompolo et al., 2003; Eyigor et al., 2004; Wintermantel et al. , 2006).
Одной из моделей, которая широко использовалась в последние 10 лет в этом отношении, является овариэктомия мышей с одновременной заменой высоких физиологических уровней эстрадиола (имитирующих циркулирующие концентрации в проэструсе до овуляции) через подкожную капсулу (Christian et al., 2005). В этой модели, как и ранее на крысах и хомяках (Norman and Spies, 1974; Legan and Karsch, 1975), наблюдаются ежедневные переключения с отрицательной обратной связи по эстрадиолу в начале дня на положительные эффекты обратной связи вечером, вызывая выброс ЛГ. во время выключения света в течение 5 дней после операции. Почти постоянный уровень циркулирующего эстрадиола означает, что его можно рассматривать как модель с одной переменной, в которой единственной переменной является время дня, что облегчает прямые сравнения и оценку механистических изменений, отражающих состояния отрицательной и положительной обратной связи.Кроме того, изменения ЛГ напрямую коррелируют с подавлением активности нейронов гонадолиберин, зарегистрированной на острых срезах головного мозга во время отрицательной обратной связи, и устойчивыми уровнями активности во время всплеска (Christian et al., 2005), что указывает на то, что ключевые и достаточные части механизма обратной связи всплеска сохраняются в препарате среза головного мозга. Оба эти состояния обратной связи, по-видимому, основаны на классической передаче сигналов ERα (т.е. через активацию геномных элементов ответа на эстроген) (Christian et al., 2008) в афферентных нейронах, которые синапсируют с нейронами GnRH (Christian, Moenter, 2007; Christian et al., 2009). Другие исследования, проведенные более чем через 5 дней после овариэктомии и замены эстрадиола, показали, что лечение эстрадиоловой обратной связью привело к увеличению времени покоя нейронов ГнРГ (то есть практически не проявляли возбуждения) и увеличили время между вспышками возбуждения потенциала действия. без изменения профиля самих всплесков (Nunemaker et al., 2002, 2003b). Также было показано, что эстрадиол оказывает негативное влияние на активацию нейронов ГнРГ у самцов мышей, что в первую очередь отражается на изменениях в характере активности (Pielecka and Moenter, 2006).
без изменения профиля самих всплесков (Nunemaker et al., 2002, 2003b). Также было показано, что эстрадиол оказывает негативное влияние на активацию нейронов ГнРГ у самцов мышей, что в первую очередь отражается на изменениях в характере активности (Pielecka and Moenter, 2006).
Вышеупомянутые исследования изучали эффекты эстрадиола, вводимого in vivo , на активность нейронов GnRH, зарегистрированных in vitro . Введение эстрадиола (или агонистов рецепторов эстрадиола) in vitro также использовалось для исследования быстрого действия эстрадиола на активность нейронов ГнРГ. Быстрые эффекты острого применения эстрадиола на нейроны GnRH мышей и приматов, по-видимому, зависят от концентрации. Когда использовались низкие физиологические уровни (низкий диапазон пМ), активность нейронов ГнРГ подавлялась ERα-зависимым образом, вероятно, опосредованно транссинаптически, тогда как высокие физиологические уровни (100 пМ – 100 нМ) стимулировали активность нейронов ГнРГ непосредственно через ERβ (Chu et al. ., 2009). Точно так же 1 нМ эстрадиола может стимулировать возбуждение культивируемых эмбриональных нейронов GnRH приматов (Abe and Terasawa, 2005). Эти результаты контрастируют с предыдущими исследованиями, демонстрирующими острую гиперполяризацию нейронов ГнРГ морских свинок под действием 10–100 нМ эстрадиола (Kelly et al., 1984; Lagrange et al., 1995). Это несоответствие может отражать видовые различия во внутриклеточных механизмах и / или подтипах рецепторов, задействованных различными концентрациями эстрадиола. Эстрадиол может также задействовать связанный с мембраной G-белок-связанный рецептор 30 (GPR30), чтобы опосредовать быстрые возбуждающие эффекты на нейроны GnRH (Noel et al., 2009). В качестве альтернативы, ответ любого заданного нейрона ГнРГ на быстрое применение эстрадиола может отражать состояние активности этой клетки во время применения эстрадиола, что продемонстрировано одновременной записью переходных процессов внутриклеточного кальция и активированной активности нейронов ГнРГ (Romano and Herbison, 2012). . В целом, хотя реакция на быстрое действие эстрадиола может быть разной из-за множества факторов, эти исследования демонстрируют, что в дополнение к классическому действию эстрадиола, требующему более длительного периода времени, нейроны гонадолиберина также очень чувствительны к быстрым эффектам.Это может иметь важное значение для понимания эффектов эстрадиола, синтезированного de novo в головном мозге, по сравнению с эффектами эстрадиола, полученного из гонад. Для дальнейшего обсуждения быстрых эффектов эстрогенов см. Главу 3.01 «Мембранные эффекты эстрадиола на центральную нервную систему».
. В целом, хотя реакция на быстрое действие эстрадиола может быть разной из-за множества факторов, эти исследования демонстрируют, что в дополнение к классическому действию эстрадиола, требующему более длительного периода времени, нейроны гонадолиберина также очень чувствительны к быстрым эффектам.Это может иметь важное значение для понимания эффектов эстрадиола, синтезированного de novo в головном мозге, по сравнению с эффектами эстрадиола, полученного из гонад. Для дальнейшего обсуждения быстрых эффектов эстрогенов см. Главу 3.01 «Мембранные эффекты эстрадиола на центральную нервную систему».
Трансдермальный 17-β-эстрадиол и риск развития диабета 2 типа в популяции здоровых женщин в постменопаузе без ожирения женщины в постменопаузе, получавшие эстроген перорально.Исследования заболеваемости диабетом 2 типа у женщин в постменопаузе, получавших трансдермальный 17-β-эстрадиол, не проводились. Целью нашего исследования было оценить влияние трансдермального 17-β-эстрадиола на частоту диабета 2 типа в популяции здоровых женщин в постменопаузе без ожирения.
ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ — В период с января 1998 г. по декабрь 2002 г. в исследование были включены 673 здоровых женщины в постменопаузе без ожирения (средний возраст 54 ± 5 лет): 144 (21,4%) из них принимали трансдермальный 17-β-эстрадиол и 529 ( 78.6%) никогда не принимали гормоны в период постменопаузы. Окончательная обработка данных была проведена в июле 2003 г., средний период наблюдения составил 3,7 ± 0,7 года (от 0,5 до 5 лет).
РЕЗУЛЬТАТЫ — Сахарный диабет 2 типа развился у 60 пациентов в течение периода наблюдения, что эквивалентно 22 случаям на 1000 женщин-лет. В группе «не употребляющих гормоны» диабет развился у 10% (54 из 529 женщин; эквивалент 26,5 случаев / 1000 женщин-лет), тогда как в группе «потребителей гормонов» диабет развился у 4.16% (6 из 144 женщин; эквивалент 12,1 случая на 1000 женщин-лет). Трансдермальный 17-β-эстрадиол стал средством лечения, которое значительно снизило риск развития диабета (ОР 2,19, 95% ДИ 1,79–3,56; P = 0,006).
ВЫВОДЫ — Наши результаты свидетельствуют о значительном снижении заболеваемости диабетом 2 типа в нашей популяции здоровых женщин в постменопаузе, не страдающих ожирением, которые принимали трансдермальный 17-β-эстрадиол. Это может означать, что у некоторых женщин дефицит эстрогена, возникающий после менопаузы, может представлять собой фундаментальный шаг в процессе диабетогенеза.
Многие исследования показали, что гормональная терапия в постменопаузе может значительно влиять на гомеостаз глюкозы (1–5), но несколько исследований четко продемонстрировали значительное снижение заболеваемости диабетом среди женщин в постменопаузе, принимающих эстрогены (6,7). Все упомянутые исследования проводились с использованием гормонов, вводимых перорально. Помимо этого, имеется еще ряд сообщений о влиянии трансдермального 17-β-эстрадиола на метаболизм глюкозы (8–13). Большинство последних исследований (8,9,11,13) были разработаны, чтобы оценить, влияют ли различные пути введения эстрогена на метаболизм глюкозы; ни одно из этих исследований не предоставило информации о заболеваемости диабетом.
В нашем исследовании рассматривалась популяция здоровых женщин среднего возраста без ожирения в постменопаузе, некоторые из которых получали трансдермальный 17-β-эстрадиол. Целью нашего исследования было оценить влияние трансдермального 17-β-эстрадиола на уровень заболеваемости диабетом в той же популяции.
ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ
Пациенты, включенные в наше исследование, были отобраны из числа женщин, которые были направлены в центр «Bene Essere Donna», учреждение, занимающееся изучением, профилактикой и лечением расстройств, связанных с менопаузой.Этот центр открыт для всех женщин, находящихся в периоде постменопаузы (статус постменопаузы определяется как отсутствие менструации в течение ≥6 месяцев и / или уровень фолликулостимулирующего гормона крови> 40 МЕ / л и уровень 17-β-эстрадиола <120 пмоль. / л) и не старше 60 лет. Эти женщины, которых изначально привлекают в центр через рекламу в местных СМИ, имеют свободный доступ и могут задавать вопросы или получать советы по поводу конкретных симптомов, просто записавшись на прием заранее. С 1 января 1998 г. по 31 декабря 2002 г. мы обследовали 980 женщин.
Эти женщины, которых изначально привлекают в центр через рекламу в местных СМИ, имеют свободный доступ и могут задавать вопросы или получать советы по поводу конкретных симптомов, просто записавшись на прием заранее. С 1 января 1998 г. по 31 декабря 2002 г. мы обследовали 980 женщин.
Исходно каждый участник прошел анализ крови натощак на уровни общего холестерина и триглицеридов, а также тест на толерантность к глюкозе 75 г внутрь (OGTT). Участники соответствовали критериям включения в это исследование, если у них был нормальный результат ПГТТ (определяемый как уровень глюкозы в плазме натощак <110 мг / дл и глюкозы в плазме через 2 часа <140 мг / дл) (14). Число здоровых женщин в постменопаузе с нормальной толерантностью к глюкозе, удовлетворяющих указанным выше критериям, составило 673 человека; средний возраст составил 54 ± 5 лет.В общей сложности 144 (21,4%) женщины использовали трансдермальный 17-β-эстрадиол, тогда как остальные 529 (78,6%) женщин не принимали гормоны. Женщины с гипертонией, гиперлипидемией, курением и ожирением были исключены из исследования; женщины, получавшие пероральный эстроген, также были исключены.
Переменные физического осмотра, измеренные на исходном уровне, включали массу тела, рост, окружность талии, а также систолическое и диастолическое артериальное давление. Анамнез пациента, электрокардиография в 12 отведениях и эхокардиография использовались для исключения прошлых или настоящих заболеваний сердца.Участники предоставили данные анкеты относительно образа жизни и потенциальных факторов риска сердечно-сосудистых заболеваний.
Гипертония определяется как систолическое артериальное давление ≥140 мм рт. Ст. И / или диастолическое артериальное давление ≥90 мм рт. Ст. Или прием гипотензивных препаратов; гиперлипидемия определялась как уровень общего холестерина в плазме ≥200 мг / дл и / или уровень триглицеридов ≥170 мг / дл; и ожирение при ИМТ ≥30 кг / м 2 .
Результаты были окончательно обработаны в конце июля 2003 года, когда за последними зарегистрировавшимися женщинами наблюдали как минимум 0. 5 год; средний период наблюдения составил 3,7 ± 0,7 года (диапазон 0,5–5).
5 год; средний период наблюдения составил 3,7 ± 0,7 года (диапазон 0,5–5).
Выявление и установление случаев
Все женщины регулярно осматривались в нашей поликлинике (каждые 6 месяцев). На исходном уровне и при каждом последующем посещении через 6 месяцев женщины проходили собеседование, обследование и забор крови. Измерение уровня глюкозы в сыворотке проводилось при каждом посещении. Новые случаи диабета были выявлены в соответствии с критериями, использованными в исследовании риска атеросклероза в сообществах (ARIC) (15,16): 1 ) самооценка употребления гипогликемических препаратов; 2 ) уровень глюкозы в сыворотке натощак (> 8 ч)> 126 мг / дл; 3 ) уровень глюкозы в сыворотке крови без еды> 200 мг / дл; или 4 ) самопровозглашенный диагноз диабета врачом.Для лиц, классифицированных по диагнозу врача или применению лекарств, дата начала диабета считалась промежуточной между последним посещением, когда женщина не страдала диабетом, и первым посещением, когда женщина была диабетиком. Для тех, кому был поставлен диагноз уровня глюкозы натощак или не натощак, датой начала диабета была расчетная дата, когда уровень глюкозы в крови пересек вышеупомянутый порог, предполагая линейное повышение уровня глюкозы между посещениями.
Гормональное лечение
Все пациенты, прошедшие гормональную терапию, получали ежедневную дозу 50 мкг трансдермального 17-β-эстрадиола.Чтобы ограничить пролиферацию эндометрия, все женщины одновременно получали прогестаген, поставляемый вместе с эстрадиолом. Мы определили «непользователей» как пациентов, которые никогда не использовали гормоны в период постменопаузы, а «потребителей» — как тех, кто принимал 17-β-эстрадиол более 3 месяцев и которые продолжали терапию до конца периода наблюдения или до начало сахарного диабета. Период времени, соответствующий последовательным назначениям, был использован для определения продолжительности использования гормональной терапии.
Статистический анализ
Непрерывные переменные представлены как средние значения, а категориальные переменные представлены как проценты.Различия в исходных характеристиках между группами исследовали с помощью ANOVA и теста χ 2 , когда это было необходимо.
Поскольку 673 женщины в постменопаузе имели разную продолжительность наблюдения, человеко-годы воздействия были рассчитаны для каждой участницы. Для людей, у которых развился диабет, воздействие определялось как время между включением в исследование и постановкой диагноза. Для тех, кто не болел диабетом, воздействие рассчитывалось как время между включением в исследование и июлем 2003 года. Показатели заболеваемости диабетом рассчитывались как количество случаев диабета, замеченных во время наблюдения, деленное на общее время воздействия на человека.Относительный риск развития диабета рассчитывался как отношение уровня заболеваемости среди лиц, не употребляющих эстроген, к уровню заболеваемости среди лиц, получающих гормональную терапию. Скорректированные оценки риска были рассчитаны с использованием модели регрессии Пуассона, которая учитывала ряд потенциальных факторов, выбранных априори, включая возраст, семейный анамнез диабета, ИМТ, окружность талии, продолжительность периода постменопаузы, годы образования, потребление алкоголя. , и физическая активность. P <0.05 считалось значительным.
РЕЗУЛЬТАТЫ
Характеристики пациентов на исходном уровне показаны в таблице 1. Две исследуемые группы были хорошо сбалансированы; не было различий между группами относительно исходных параметров.
Развитие диабета 2 типа
В общей сложности 673 пациента наблюдались в течение 3,7 ± 0,7 года. Ни один из участников не умер или не был потерян во время наблюдения; ни одна из пролеченных женщин не прекратила принимать гормоны, и ни одна из нелеченных женщин не начала принимать эстроген во время наблюдения.
За время наблюдения диабет развился у 60 пациентов (эквивалент 22,0 случаев на 1000 женщин-лет). Врачи диагностировали 15 из 60 случаев диабета (25%); остальные 35 случаев (75%) были диагностированы с помощью измерения уровня глюкозы в сыворотке.
В группе «лиц, не принимающих гормональную терапию», диабет развился у 10,00% (54 из 529 женщин; эквивалент 26,5 случаев / 1000 женщин-лет), тогда как в группе «принимающих гормональную терапию» диабет развился у 4,16% ( 6 из 144 женщин; эквивалент 12.1 случай / 1000 женщин-лет). Относительный риск (ОР) диабета значительно увеличился в группе «не принимающих гормональную терапию» по сравнению с референтной группой («принимающий гормональную терапию») (ОР 2,19; 95% ДИ 1,79–3,56; P = 0,006). Множественные корректировки для различных факторов риска лишь незначительно ослабляли ОР (ОР 1,97; 95% ДИ 1,65–2,99; P = 0,004). Таким образом, трансдермальный 17-β-эстрадиол стал средством лечения, которое значительно снизило риск развития диабета (Таблица 2).
ВЫВОДЫ
Результаты нашего проспективного исследования показывают, что у здоровых женщин в постменопаузе без ожирения прием трансдермального 17-β-эстрадиола снижает риск развития диабета 2 типа.Текущие проспективные данные подтверждают возможную роль дефицита эстрогенов в постменопаузе в диабетогенезе и соответствуют данным Kanaya et al. (7), которые разработали результаты рандомизированного исследования сердца и эстрогена / прогестина (HERS), в котором использовался пероральный конъюгированный конский эстроген. Это показывает, что положительный эффект снижения диабета напрямую зависит от эстрогенов, а не от способа введения. Это неудивительно, если принять во внимание те исследования, которые ставили целью сравнить эстрогены, вводимые перорально и трансдермально, и не показали разницы в уровне гликемии натощак и чувствительности к инсулину (8,9,11,13).
Хотя наши данные подтверждают этиологические ассоциации, в настоящее время явные механизмы остаются спекулятивными и требуют дальнейшего изучения. Некоторые гипотезы наших результатов требуют дальнейшего обсуждения. Во-первых, возможно, что эстрогены определяют более низкую заболеваемость диабетом за счет улучшения функции эндотелия. Измененная функция эндотелия снижает проницаемость, а уменьшенный периферический кровоток может ограничивать доставку инсулина и способствовать развитию инсулинорезистентности (17,18). Фактически, интерстициальная концентрация инсулина представляет собой фактор, ограничивающий эффективность самого инсулина.В связи с этим постменопауза, как следствие дефицита эстрогенов, связана с дисфункцией эндотелия (19), и за счет восстановления уровней эстрогенов улучшается функция эндотелия (20). С этой точки зрения следует также добавить, что некоторые исследования показали, что трансдермальный 17-β-эстрадиол, по-видимому, обладает инсулиноподобным действием на уровне эндотелиальных клеток. Через 2 часа после индукции гипергликемии концентрации растворимых молекул адгезии в плазме повышаются как у пациентов с диабетом 2 типа, так и у здоровых людей (21).Инсулин, напротив, снижает уровень молекулы межклеточной адгезии-1 в эндотелиальных клетках (22). Клинически лечение инсулином сопровождается снижением уровня циркулирующих растворимых молекул адгезии (23). Seljeflot et al. (24) обнаружили значительное уменьшение растворимой молекулы межклеточной адгезии, Е-селектина и молекулы-1 адгезии сосудистых клеток после лечения трансдермальным эстрадиолом.
Другой потенциальный механизм, который может объяснить наши результаты, касается влияния эстрогена на метаболизм глюкозы и инсулина.Мы нашли в литературе по этому поводу противоположные результаты. Фактически, не все работы указывают на резкое действие эстрогена на метаболизм глюкозы (10,12,25,26), но некоторые данные демонстрируют, как терапия эстрогенами может улучшать чувствительность к инсулину (8,27) и оказывать положительное влияние на глюконеогенез в печени. , снижая выработку глюкозы печенью (8,28).
Снижение риска развития диабета представляет собой конечную точку первостепенной важности, поскольку диабет является реальной проблемой общественного здравоохранения в промышленно развитых странах, в основном в США.S. (29,30), с заметными сердечно-сосудистыми последствиями и высокой стоимостью с точки зрения смертности, заболеваемости и финансовых ресурсов (31). По всем этим причинам открытие терапии, способной значительно снизить заболеваемость диабетом, могло легко вызвать энтузиазм. Наши результаты были получены в нерандомизированном исследовании, и поэтому к ним следует относиться с осторожностью, поскольку каждое лечение следует оценивать с точки зрения соотношения риск / польза. В этой связи мы отмечаем, что недавнее рандомизированное исследование, названное Инициативой по охране здоровья женщин (32), крупномасштабное плацебо-контролируемое исследование гормональной терапии и первичной профилактики, сообщило о повышенном риске ишемической болезни сердца среди здоровых женщин, которым назначено лечение. эстроген плюс прогестин.Кроме того, одно и то же лечение увеличивало риск нескольких неблагоприятных исходов, включая инсульт, тромбоэмболию легочной артерии и рак груди. К сожалению, упомянутое исследование, в котором рассматривались здоровые женщины (как и настоящее исследование), не дает данных о заболеваемости диабетом у исследуемых женщин. Более того, в исследовании HERS улучшение толерантности к глюкозе и снижение заболеваемости диабетом, отмеченное во время наблюдения (7), было недостаточным, чтобы вызвать снижение сердечно-сосудистых событий после 4-летнего периода наблюдения (33).
Ценностями нашей работы, на наш взгляд, являются перспективный дизайн исследования, большая выборка женщин и возможность точно определить время начала гормональной терапии. Это позволило нам определить текущее воздействие и рассматривать его как зависящую от времени ковариату.
Ограничивающим фактором нашего исследования был тот факт, что включенные в исследование женщины в постменопаузе были относительно молодыми и не имели факторов риска сердечно-сосудистых заболеваний и каких-либо сердечных патологий. Таким образом, полученные нами результаты применимы только к ограниченному числу женщин в постменопаузе, а не ко всем женщинам; в этом отношении результаты не применимы к мужчинам.
В заключение, результаты этого проспективного исследования демонстрируют, что гормональная терапия играет роль в снижении риска диабета 2 типа у женщин в постменопаузе. Это означает, что дефицит эстрогенов представляет собой возможный этап диабетогенеза у женщин. Результаты нашего исследования не были окончательными, но наводят на мысль о том, что эстроген можно рассматривать как средство профилактики диабета. Тем не менее, подтверждение значимых эффектов должно быть подтверждено формализованным клиническим исследованием с заранее определенными конечными точками гипергликемии.
Таблица 1–Исходная характеристика исследуемой популяции в зависимости от использования гормонов
Таблица 2–Уровни заболеваемости диабетом среди исследуемой популяции
Благодарности
Это исследование было частично поддержано итальянским MURST (Ministero dell ‘Università e della Ricerca Scientifica e Tecnologica) и спонсировалась WOCDA (Ассоциация сердечно-сосудистых заболеваний WOman).
Сноски
- Принята к печати 28 ноября 2003 г.
- Поступило 15 августа 2003 г.
- УХОД ЗА ДИАБЕТОМ
Ссылки
- ↵
Espeland MA, Hogan PE, Fineberg SE, Howard G, Schrott H, Waclawiw MA, Busho TL: Эффект постменной гормональной терапии по концентрациям глюкозы и инсулина: Исследователи PEPI: Постменопаузальные эстрогеновые / прогестиновые вмешательства. Уход за диабетом 21: 1589–1595, 1998
Triusu RJ, Cowie CC, Harris MI: Заместительная гормональная терапия и метаболизм глюкозы.Obstet Gynecol 96: 665–670, 2000
Davidson MH, Maki KC, Marx P, Maki AC, Cyrowsky MS, Nanavati N, Arce JC: Влияние непрерывных схем замещения эстрогена и эстроген-прогестина на маркеры сердечно-сосудистого риска у женщин в постменопаузе. Arch Intern Med 160: 3315–3325, 2000
Hodis HN, Mack WJ, Lobo RA, Shoupe D, Sevanian A, Mahrer PR, Selzer RH, Liu CR, Liu CH, Azen SP: Эстроген в профилактике атеросклероза: рандомизированное двойное слепое плацебо-контролируемое исследование.Ann Intern Med 135: 939–953, 2001
- ↵
Zhang Y, Howard BV, Cowan LD, Yeh J, Schaefer CF, Wild RA, Wang W, Lee ET: Влияние использования эстрогена на уровни глюкозы и инсулин и риск диабета 2 типа у женщин в постменопаузе американских индейцев: исследование Strong Heart. Diabetes Care 25: 500–504, 2002
- ↵
Manson JE, Rimm EB, Colditz GA, Willett WC, Nathan DM, Arky RA, Rosner B, Hennekens CH, Speizer FE, Stampfer MJ: проспективное исследование постменопаузальная терапия эстрогенами и последующая частота инсулиннезависимого сахарного диабета.Ann Epidemiol 2: 665–673, 1992
- ↵
Kanaya AM, Herrington D, Vittinghoff E, Lin F, Grady D, Bittner V, Cauley JA, Barrett-Connor E: Гликемические эффекты постменопаузальной гормональной терапии: Сердце и исследование замещения эстрогена / прогестина (HERS): рандомизированное двойное слепое плацебо-контролируемое исследование. Ann Intern Med 138: 1–9, 2003
- ↵
Cagnacci A, Soldani R, Carriero PL, Paoletti AM, Fioretti P, Melis GB: Влияние низких доз трансдермального 17-бета-эстрадиола на углеводный обмен в постменопаузе женщины.J Clin Endocrinol Metab 74: 1396–1400, 1992
- ↵
O’Sullivan AJ, Ho KK: Сравнение эффектов пероральной и трансдермальной замены эстрогенов на чувствительность к инсулину у женщин в постменопаузе. J Clin Endocrinol Metab 80: 1783–1788, 1995
- ↵
Duncan AC, Lyall H, Roberts RN, Petrie JR, Perera MJ, Monaghan S, Hart DM, Connell JM, Lumsden MA: Эффект эстрадиола и комбинированный препарат эстрадиола / прогестагена на чувствительность к инсулину у здоровых женщин в постменопаузе.J Clin Endocrinol Metab 84: 2402–2407, 1999
- ↵
Seed M, Sands RH, McLaren M, Kirk G, Darko D: Влияние заместительной гормональной терапии и способ введения на отдельные факторы риска сердечно-сосудистых заболеваний в постменопаузе женщины. Fam Pract 17: 497–507, 2000
- ↵
Vehkavaara S, Westerbacka J, Hakala-Ala-Pietila T., Virkamaki A, Hovatta O, Yki-Jarvinen H: Эффект заместительной эстрогеновой терапии на чувствительность к инсулину глюкозы. метаболизм, пререзистентность и функция сосудов сопротивления у здоровых женщин в постменопаузе.J Clin Endocrinol Metab 85: 4663–4670, 2000
- ↵
Karjalainen A, Paassilta M, Heikkinen J, Backstrom AC, Savolainen M, Kesaniemi YA: Влияние пероральной и трансдермальной заместительной терапии эстрогенами на метаболизм глюкозы и инсулина. Clin Endocrinol 54: 165–173, 2001
- ↵
Комитет экспертов по диагностике и классификации сахарного диабета: Отчет экспертного комитета по диагностике и классификации сахарного диабета.Diabetes Care 20: 1183–1197, 1997
- ↵
Исследователи ARIC: Исследование риска атеросклероза в сообществах (ARIC): дизайн и цели. Am J Epidemiol 129: 687–702, 1989
- ↵
Folsom AR, Szklo M, Stevens J, Liao F, Smith R, Eckfeldt JH: проспективное исследование ишемической болезни сердца в отношении инсулина натощак, глюкозы, и диабет: исследование риска атеросклероза в сообществах (ARIC). Diabetes Care 20: 935–942, 1997
- ↵
Pinkney JH, Stehouwer CD, Coppack SW, Yudkin JS: Эндотелиальная дисфункция: причина синдрома инсулинорезистентности.Диабет 46 (Приложение 2): S9 – S13, 1997
- ↵
Hsueh WA, Quinones MJ: Роль эндотелиальной дисфункции в инсулинорезистентности. Am J Cardiol 92 (Дополнение 1): 10J – 17J, 2003
- ↵
Taddei S, Virdis A, Ghiadoni L, Mattei P, Sudano I, Bernini G, Pinto S, Salvetti A: Менопауза связана с эндотелиальная дисфункция у женщин. Hypertension 28: 576–582, 1996
- 1
Zegura B, Keber I, Sebastjen M, Borko E: перорально и трансдермально замененный эстрадиол улучшает эндотелиальную функцию у женщин среднего возраста после хирургической менопаузы.Am J Obstet Gynecol 29: 268–273, 1997
- ↵
Марфелла Р., Эспозито К., Джунта Р.: Циркулирующие молекулы адгезии у людей: роль гипергликемии и гиперинсулинемии. Circulation 101: 2247–2251, 2000
- ↵
Aljada A, Saadeh R, Assian E, Ghanim H, Dandona P: инсулин подавляет экспрессию молекулы межклеточной адгезии-1 эндотелиальными клетками аорты человека посредством стимуляции оксида азота . J Clin Endocrinol Metab 85: 2572–2575, 2000
- ↵
Albertini JP, Valensi P, Lormeau B, Aurousseau MH, Ferriere F, Attali JR, Gattegno L: Повышенные концентрации растворимого E-селектина и адгезия сосудистых клеток молекула-1 при NIDDM: эффект от интенсивного лечения инсулином.Diabetes Care 21: 1008–1013, 1998
- ↵
Seljeflot I, Arnesen H, Hofstad AE, Os I. Снижение экспрессии маркеров эндотелиальных клеток после длительной трансдермальной заместительной гормональной терапии у женщин с ишемической болезнью сердца. Thromb Haemost 83: 944–948, 2000
- ↵
Kimmerle R, Heinemann L, Heise T, Bender R, Weyer C, Hirschberger S, Berger M: Влияние непрерывных комбинированных препаратов эстрадиол-норэтистерона ацетата на чувствительность к инсулину у женщины без диабета в постменопаузе.Менопауза 6: 36–42, 1999
- ↵
Lobo RA, Bush T, Carr BR, Pickar JH: Влияние более низких доз конъюгированного конского эстрогена и медроксипрогестерона ацетата на липиды и липопротеины плазмы, факторы свертывания крови и метаболизм углеводов . Fertil Steril 76: 13–24, 2001
- ↵
Линдхейм С.Р., Даффи Д.М., Кодзима Т., Вийод М.А., Станчик Ф.З., Лобо Р.А.: Способ введения влияет на влияние эстрогена на чувствительность к инсулину у женщин в постменопаузе.Fertil Steril 62: 1176—1180, 1994
- ↵
Matute ML, Kalkhoff RK: Влияние половых стероидов на глюконеогенез в печени и образование глюкогенов. Эндокринология 92: 762–768, 1973
- ↵
Национальная группа данных по диабету: Резюме. При диабете в Америке. 2-е изд. Харрис М.И., Коуи С.К., Стерн депутат, Бойко Э.Дж., Рейбер Г.Е., Беннет П.Х., ред. Бетесда, доктор медицины, Национальные институты здравоохранения, Национальный институт диабета, болезней органов пищеварения и почек, 1995 г., стр.1–13 (публикация DHHS № 95-1468)
- ↵
Harris MI, Flegal KM, Cowie CC, Eberhardt MS, Goldstein DE, Little RR, Wieldmeyer HM, Byrd-Holt DD: распространенность диабета, нарушение глюкозы натощак и нарушение толерантности к глюкозе у взрослых в США: Третье национальное исследование здоровья и питания, 1988–1994 гг. Уход за диабетом 21: 518–524, 1998
- ↵
Мэнсон Дж .: Изменение риска у диабетического пациента. В профилактике инфаркта миокарда. Мэнсон Дж., Ридкер П., Газиано Дж., Хеннекенс С., ред.Нью-Йорк, Oxford University Press, 1996, стр. 241–273
- ↵
Исследовательская группа Инициативы по охране здоровья женщин (WHI): Риск и преимущества эстрогена и прогестина у здоровых женщин в постменопаузе. JAMA 288: 321–333, 2002
- ↵
Hulley S, Grady D, Bush T., Furberg C, Herrington D, Riggs B, Vittinghoff E: рандомизированное испытание эстрогена и прогестина для вторичной профилактики ишемической болезни сердца в постменопаузе женщины: Исследовательская группа по замене сердца и эстроген / прогестин (HERS).JAMA 280: 605–613, 1998
Вы и ваши гормоны от Общества эндокринологов
Альтернативные названия эстрадиола
E2; эстрадиол; 17-бета (о) эстрадиол
Что такое эстрадиол?
Эстрадиол — стероидный гормон, вырабатываемый из холестерина, и самый сильный из трех естественных эстрогенов. Это основной эстроген, обнаруживаемый у женщин, и он выполняет множество функций, хотя в основном он действует на созревание и поддержание женской репродуктивной системы.Естественное увеличение концентрации эстрадиола в крови во время менструального цикла вызывает созревание и высвобождение яйцеклетки; то есть овулировать. Еще одна важная роль эстрадиола — утолщение слизистой оболочки матки, чтобы яйцеклетка могла имплантироваться, если она оплодотворяется. Эстрадиол также способствует развитию ткани груди и увеличивает плотность костей и хрящей.
У женщин в пременопаузе эстрадиол вырабатывается в основном яичниками. Уровни эстрадиола варьируются в течение месячного менструального цикла, самые высокие во время овуляции и самые низкие во время менструации.Уровень эстрадиола у женщин медленно снижается с возрастом, причем значительное снижение происходит в период менопаузы, когда яичники «выключаются». У беременных женщин плацента также производит много эстрадиола, особенно в конце беременности.
Мужчины также производят эстрадиол; однако производимые количества намного ниже, чем у женщин. В семенниках часть тестостерона превращается в эстрадиол, и этот эстрадиол необходим для производства спермы. У обоих полов эстрадиол в гораздо меньших количествах вырабатывается жировой тканью, мозгом и стенками кровеносных сосудов.
Как контролируется эстрадиол?
Производство эстрадиола в яичниках женщины контролируется гормонами, выделяемыми как гипоталамусом в головном мозге, так и гипофизом: это называется репродуктивной осью у женщин и также известна как ось гипоталамус-гипофиз-яичники (или гонадная). Гипоталамус в основании мозга выделяет гормон, называемый гонадотропин-рилизинг-гормоном. Затем гонадотропин-рилизинг-гормон воздействует на гипофиз, вызывая высвобождение еще двух гормонов, лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ).ЛГ и ФСГ попадают в кровь и стимулируют яичники; в частности, ЛГ и ФСГ действуют на клетки, окружающие каждую яйцеклетку (эти клетки вместе с яйцеклеткой образуют единицу, называемую фолликулом), стимулируя рост и развитие фолликула. На последних стадиях роста и развития клетки, окружающие яйцо, вырабатывают эстрадиол. После овуляции яйцеклетки овулированный фолликул станет желтым телом. Желтое тело вырабатывает как прогестерон, так и эстрадиол, и основная роль этих двух гормонов заключается в обеспечении полной подготовки слизистой оболочки матки к имплантации в случае оплодотворения.Количество эстрадиола (и прогестерона) в кровотоке сообщается с гипоталамусом и гипофизом, чтобы контролировать развитие яйцеклетки, овуляцию и менструальный цикл.
Что произойдет, если у меня будет слишком много эстрадиола?
У женщин слишком много эстрадиола может иметь ряд последствий. В легких случаях избыток эстрадиола может вызвать угри, запор, потерю либидо и депрессию. Более серьезные последствия могут включать увеличение веса, женское бесплодие, инсульт, сердечный приступ и повышенный риск развития рака матки и / или груди.
У мужчин слишком много эстрадиола может также вызвать сексуальную дисфункцию, потерю мышечного тонуса, увеличение жировых отложений и развитие женских качеств, таких как ткань груди. Эстрадиол становится все более доминирующим по мере того, как мужчина стареет, и его выработка тестостерона снижается, что, по мнению ученых, может быть фактором, способствующим развитию рака простаты.
Комбинированные оральные противозачаточные таблетки (таблетки) содержат синтетические формы прогестерона и эстрадиола. Таблетка предотвращает овуляцию, что делает ее почти 100% эффективной в предотвращении беременности.Помимо предотвращения овуляции, синтетические гормоны делают слизь шейки матки более густой и, следовательно, затрудняют прохождение сперматозоидов, тем самым снижая их шансы попасть в матку и яйцеводы. Синтетический эстрадиол был добавлен для предотвращения внезапного кровотечения, которое иногда возникает при приеме таблеток, содержащих только прогестерон (мини-таблетки).
Что произойдет, если у меня будет слишком мало эстрадиола?
Эстрадиол необходим для развития костей, поэтому люди с низким уровнем эстрадиола, как правило, имеют проблемы со скелетом, такие как недостаточный рост костей и остеопороз.Девочки также будут сталкиваться с проблемами в период полового созревания, такими как задержка или неспособность грудного вскармливания, нарушенный или отсутствующий менструальный цикл и бесплодие. Эстрадиол также играет важную роль в мозге, где низкие уровни могут вызывать депрессию, усталость и перепады настроения.
Выработка эстрадиола у женщин естественным образом падает во время менопаузы и вызывает многие из ее симптомов. Первоначально они включают ночное потоотделение, приливы, сухость влагалища и перепады настроения, в то время как в долгосрочной перспективе у нее более вероятно развитие остеопороза.Эстрадиол используется в заместительной гормональной терапии для облегчения этих симптомов менопаузы у женщин. Есть много признанных плюсов и минусов заместительной гормональной терапии. См. Статьи о менопаузе и «Что такое ЗГТ?» Для получения дополнительной информации.
Последний раз отзыв: март 2018
Низкие дозы 17 α -эстрадиола и 17 β -эстрадиола способствуют, тогда как более высокие дозы эстрона и 17 α — и 17 β -эстрадиола ухудшают, обусловливают контекстуальный страх у взрослых самок крыс
Животные
Восемьдесят одна взрослая самка Sprague– В исследовании использовали крыс Dawley массой 200–250 г, полученных из Центра ухода за животными Университета Британской Колумбии (Ванкувер, Британская Колумбия, Канада).Первоначально крыс содержали парами в непрозрачных полиуретановых контейнерах (48 × 27 × 20 см) с подстилкой из осиновой стружки и давали крысиному корму Purina и водопроводной воде ad libitum . Крыс содержали при 12: 12-часовом цикле свет / темнота (свет в 07:30). Начиная со следующего дня после прибытия, крыс обрабатывали через день в течение 5 мин. Все эксперименты проводились в соответствии с этическими принципами, установленными Канадским советом по уходу за животными, и были одобрены Комитетом по уходу за животными Университета Британской Колумбии.Были приложены все усилия, чтобы уменьшить количество и страдания животных.
Хирургия
Примерно через 1 неделю после прибытия всем самкам была сделана двусторонняя овариэктомия с использованием асептических процедур. Крыс помещали в камеру и анестезировали изофлураном, который подавали с индукционной скоростью потока 5% (скорость потока O 2 составляла приблизительно 1,5%). Затем крыс поддерживали при скорости потока 2,5–3% для поддержания стабильной частоты дыхания и вводили инъекцию раствора Рингера с лактатом (100 мл / кг, с.c.) и инъекцию нестероидного противовоспалительного анальгетика (Anafen, MERIAL Canada Inc., Baie d’Urfé, Квебек, Канада; 5 мл / кг). После операции крыс помещали по одному в чистый, стерильный непрозрачный полиуретановый контейнер и держали в тепле до полного выздоровления от анестезии. На разрез наружно наносили антибактериальную мазь местного действия (Flamazine, Smith & Nephew, St Laurent, Квебек, Канада). Крыс взвешивали ежедневно, чтобы контролировать восстановление после операции. Перед началом каких-либо экспериментальных манипуляций крысам давали 7 дней на выздоровление.
Аппарат
Кондиционирование и тестирование проводились в двух идентичных камерах наблюдения (30,5 × 24 × 21 см; Med Associates, Сент-Олбанс, штат Вирджиния), состоящих из алюминия (боковые стенки) и оргстекла (потолок, передняя дверь на петлях и задняя стенка). ). Камеры были заключены в звукопоглощающие боксы, расположенные в ярко освещенном и тихом помещении. Над каждой камерой располагалась видеокамера для записи поведения испытуемого для оценки видео. Пол каждой камеры состоял из 19 стержней из нержавеющей стали, расположенных на расстоянии 1.На расстоянии 5 см друг от друга, которые были подключены к генератору разряда и скремблеру для подачи безусловного стимульного удара ногой. Каждая камера освещалась одним корпусом 100 мА, расположенным в центре верхней части одной стены. В левом углу той же стены находился динамик, подключенный к программируемому аудиогенератору (ANL-926, Med Associates). На стене, противоположной свету дома, на высоте 7 см над полом располагались динамик и два стимулирующих света 100 мА (диаметром 2,5 см). Вентиляторы в каждом боксе обеспечивали фоновый шум (70 дБ, шкала А).
Каждая камера была расположена на платформе датчика нагрузки, которая регистрировала смещение камеры в ответ на двигательную активность субъекта (Med Associates). Выходной сигнал каждой тензодатчика был установлен на коэффициент усиления (ручка нониуса 8), который был оптимизирован для обнаружения замораживания, а выходной сигнал был оцифрован и получен в режиме онлайн с использованием программного обеспечения Threshold Activity (Med Associates). Активность тензодатчика оцифровывалась с частотой 5 Гц, что давало одно наблюдение на крысу каждые 200 мс. Замораживание — это защитная реакция страха, которая состоит из немедленного подавления поведения, которое сопровождается обездвиженностью, поверхностным дыханием, учащением пульса и эрекцией (Barrientos et al, 2002).Замораживание было количественно оценено путем подсчета количества наблюдений для каждой крысы, значение которой было меньше порога замораживания, что позволило исключить такие поведения, как уход за шерстью, обнюхивание и поворот головы. Один и тот же порог замораживания использовался для каждого животного на протяжении всего эксперимента. Важно отметить, что наблюдение считалось замораживающим только в том случае, если оно было частью по крайней мере пяти непрерывных наблюдений, которые упали ниже порогового значения; поэтому замораживание засчитывалось только в том случае, если животное оставалось неподвижным не менее 1 секунды (Maren, 1998).Пороговое значение замораживания было проверено путем сравнения с результатами видео-оценки поведения животного. Количество времени, затрачиваемого на активное исследование камеры, самоочистку и выращивание, оценивалось количественно путем расчета количества значений весоизмерительной ячейки, превышающих соответствующие пороговые значения для каждого измерения. Эти пороговые значения были определены путем сравнения выходных данных весоизмерительных датчиков с оценками такого поведения наблюдателем.
Чтобы оценить влияние различных форм эстрогена на условное кондиционирование страха, а также на условное кондиционирование страха, животных подвергали как условному контексту (Контекст А, для контекстно-связанного страха), так и новой среде (Контекст В, страх, связанный с сигналом).Контекст А состоял из стандартной рабочей камеры, как описано выше, с освещенным внутренним светом, стенами из чистого алюминия и плексигласа и автомобильным освежителем воздуха «клубничный», используемым в качестве сигнала запаха. Контекст B представлял собой стандартную оперантную камеру, которая освещалась двумя импульсными лампами, с полосатыми и пунктирными вставками, покрывающими стены из оргстекла, стержни из нержавеющей стали на полу были покрыты гладкой белой пластиковой вставкой и «ванильным» освежителем воздуха. обеспечил запах запаха. Каждое животное подвергалось воздействию как контекста A, так и контекста B, как описано ниже.
Медикаментозное лечение
Примерно через 1 неделю после овариэктомии крыс случайным образом распределили в 1 из 10 групп лечения ( n = 7–9 на группу) и получили одну подкожную инъекцию. инъекция любого носителя (контроль, 0,10 мл кунжутного масла), 17 β -эстрадиола, эстрона или 17 α -эстрадиола. Эстрогены вводили в одной из трех доз: низкой (0,30 мкг / 0,10 мл кунжутного масла), средней (1 мкг / 0,10 мл кунжутного масла) или высокой (10 мкг / 0,10 мл кунжутного масла). Эти дозы были выбраны на основе более ранних исследований, посвященных изучению пространственного обучения и нейрогенеза гиппокампа (Tanapat et al, 1999; Ormerod et al, 2003; Holmes et al, 2002; Tanapat et al, 2005; Barha et al, 2009).Была выбрана высокая доза 10 мкг 17 β -эстрадиола, поскольку она приводит к циркулирующим уровням эстрадиола, наблюдаемым в утро проэструса (Viau and Meaney, 1991), и, как было показано, усиливает пролиферацию клеток через 30 минут (Barha et al, 2009), через 2 часа (Tanapat et al, 1999; Tanapat et al, 2005) и через 4 часа (Ormerod et al, 2003; Barha et al, 2009) после инъекции. Однако эта же доза дает супрафизиологические уровни эстрадиола вскоре после введения (Woolley and McEwen, 1993). Мы выбрали среднюю дозу 1 мкг 17 β -эстрадиола, поскольку более ранние исследования показали, что эта доза 17 β -эстрадиола незначительно увеличивает пролиферацию клеток (Tanapat et al, 2005) и ухудшает рабочую память на пространственную работу / эталон. версия памяти лабиринта с лучевыми рукавами (Holmes et al, 2002).С другой стороны, доза в 0,3 мкг 17 β -эстрадиола улучшает рабочую память (Holmes et al, 2002), увеличивает пролиферацию клеток через 30 минут после инъекции (Barha et al, 2009) и приводит к обнаруженным уровням эстрадиола в крови. во время диэструса (Viau, Meaney, 1991).
Дозы, выбранные для 17 β -эстрадиола, также использовались для 17 α -эстрадиола и эстрона, что позволяет напрямую сравнивать эффекты между эстрогенами. Хорошо известно, что низкая и средняя дозы 17 β -эстрадиола являются физиологическими уровнями, как рассмотрено выше, но что высокая доза является фармакологической через 30 минут после введения (Woolley and McEwen, 1993, личное наблюдение).Мы обнаружили, что с помощью радиоиммуноанализа уровни эстрона варьируются от 27,57 до 108,96 пг / мл в течение эстрального цикла. Мы также установили, что низкая, средняя и высокая дозы эстрона примерно соответствуют 85,59, 108,82 и 516,32 пг / мл через 30 минут после приема. Таким образом, это указывает на то, что низкие и средние дозы эстрона вызывают физиологические уровни, тогда как высокие — фармакологические. В настоящее время невозможно определить уровни 17 α -эстрадиола с помощью имеющегося в продаже набора для радиоиммуноанализа.Однако, используя другой метод, Toran-Allerand et al (2005) показали, что 17 α -эстрадиол не обнаруживается в сыворотке, но обнаруживается в мозге взрослых мышей. Мы выбрали одинаковые дозы для 17 α -эстрадиола и эстрона, чтобы напрямую сравнить все три дозы со всеми тремя эстрогенами. Кроме того, мы использовали эти же дозы всех трех эстрогенов в более ранней статье, исследующей влияние этих эстрогенов на пролиферацию клеток в зубчатой извилине взрослых самок крыс (Barha et al, 2009).Все крысы получали однократную подкожную инъекцию. инъекция 0,10 мл гормона или носителя. Все инъекции делались между 8:30 и 9:00 утра, а гормоны вводились за 30 минут до кондиционирования, чтобы оценить влияние введения гормонов на приобретение памяти через 24 часа. Более ранние исследования показали, что эти же эстрогены могут влиять на структуру и функцию гиппокампа в течение 30 минут после воздействия (Barha et al, 2009; Maclusky et al, 2005; Luine et al, 2003). Были предприняты усилия, чтобы гарантировать, что группы не различались по массе тела после операции, поскольку известно, что овариэктомия приводит к увеличению массы тела.
Эстрогены (Sigma-Aldrich Chemicals, Oakville, ON, Canada) растворяли в кунжутном масле (Sigma-Aldrich Chemicals) при слабом нагревании до концентрации 0,3, 1 или 10 мкг гормона на 0,10 мл масла. Растворы эстрогенов хранили в непрозрачных контейнерах при комнатной температуре.
Поведенческая процедура
Этот эксперимент проводился в течение 2 дней, дня кондиционирования и дня тестирования. В день 1, день кондиционирования, один экспериментатор вводил крысам гормон или носитель. Тридцать минут спустя крысы были доставлены в испытательную комнату в их домашних клетках на четырехколесной тележке другим экспериментатором.Затем крыс помещали в оперантную камеру Context A. Через три минуты после помещения в камеру крысам давали три представления тонального сигнала CS (4 кГц, 80 дБ, 30 с), каждое из которых завершалось ударом стопы (2 с, 1,0 мА) с интервалами между ударами 60 с. Через шестьдесят секунд после третьей и последней пары тон / шок (после 3 минут воздействия Контекст А) крыс немедленно возвращали в их домашнюю клетку и комнату колонии. Чтобы оценить, были ли различия в болевой чувствительности между группами, мы регистрировали замирание в течение минуты после каждого предъявления шока.Чтобы оценить обусловленность контекстуальным страхом, через 24 часа после кондиционирования крысы были доставлены обратно в испытательную комнату в их домашних клетках на четырехколесной тележке тем же экспериментатором, что и накануне. Чтобы активировать представление контекста, использовали ту же процедуру, что и в день кондиционирования. Крыс снова помещали в контекст А на 8 минут и оценивали их замораживание. Через 8 минут крыс немедленно возвращали в комнату колонии в их домашних клетках. Для оценки условного рефлекса страха крысы были доставлены примерно через 1 час (Winocur et al, 2006) в испытательную комнату в чистой, неиспользованной, прозрачной клетке (48 × 27 × 20 см) другим экспериментатором по совершенно новому маршруту без тележка.Крыс помещали в новый контекст B, и через 3 минуты им предъявляли три тона (4 кГц, 80 дБ, 30 с) с интервалом 60 с. График эксперимента представлен в Таблице 1. Время, затрачиваемое на замирание на звуковой сигнал (реплика), измерялось во время каждого представления звука. Кроме того, время, проведенное за 3 минуты до представления первого тона, также регистрировалось как показатель того, различались ли группы по тому, насколько они распознали новый контекст B как старый контекст A.
Таблица 1 Экспериментальная процедураИммуногистохимия
Случайную подгруппу крыс ( n = 4) из каждой группы перфузировали через 4 часа после воздействия контекста B (условное обозначение страха) для оценки уровней синаптофизина в гиппокампе.Вкратце, крыс подвергали глубокой анестезии летальной дозой пентобарбитала натрия и затем перфузировали 4% параформальдегидом. После экстракции мозг хранили при 4 ° C в 4% параформальдегиде в течение 24 часов перед переносом в 30% сахарозу в течение минимум 72 часов. Мозг разрезали на 30 мкм срезы по всему гиппокампу в ванне с трис-буферным физиологическим раствором (TBS) (pH 7,4) с использованием вибратома (Leica VT1000S; Leica Microsystems, Inc., Richmond Hill, ON, Canada). Срезы хранили при -20 ° C в стерильных культуральных пластинах с антифризом с фосфатным буфером (PBS).Срезы промывали 3 раза по 10 мин каждый TBS, а затем хранили в стерильных культуральных планшетах, заполненных TBS, в течение 24 ч перед иммуногистохимической обработкой.
Все гистологические процедуры были основаны на модификации более ранней работы (Burton et al, 2007). Между всеми этапами свободно плавающие срезы промывали 3 раза по 10 мин каждый в PBS (0,1 М натрий-фосфатный буфер в 0,9% физиологическом растворе; pH 7,4), если не указано иное. Срезы блокировали 5% нормальной лошадиной сывороткой (NHS; Vector Laboratories, Burlington, ON, Канада) и 3% Triton-X (Boehringer Mannheim, Laval, QC, Канада) в течение 15 минут, а затем инкубировали в течение 2 часов с мышиным моноклональным антителом. против синаптофизина (1: 200; Sigma-Aldrich Chemicals) при комнатной температуре.Затем срезы инкубировали во вторичной антисыворотке мышей (1: 200; Vector Laboratories) в течение 2 часов при комнатной температуре. Затем срезы инкубировали в комплексе авидин-биотин пероксидазы хрена (ABC Elite Kit; 1:50; Vector Laboratories) в течение 90 мин. Срезы реагировали в 0,01% диаминобензидине (DAB; Sigma-Aldrich Chemicals) с 0,0003% H 2 O 2 в течение приблизительно 5 минут. Срезы помещали на предметные стекла Super Frost (Fisher Scientific, Эдмонтон, AB, Канада), сушили в течение ночи, обезвоживали и затем закрывали Permount (Fisher Scientific).
Количественный анализ изображений
Количественную денсиометрическую оценку белка синаптофизина проводили при 40-кратном увеличении с использованием системы анализа изображений SimplePCI Ver.5 (Compix, Cranberry Township PA). Интенсивность используемого света была отрегулирована так, чтобы диапазон интенсивностей уровней серого для каждого слайда составлял 0–255 (от черного к белому). Уровни серого измеряли на микрофотографиях, помещая белые кружки диаметром 100 мкм вдоль различных областей гиппокампа (см. Рисунок 1а).Мы следовали процедурам Gao et al (2006). В частности, оптическую плотность (OD) синаптофизина оценивали в каждом из ворот и внутреннего молекулярного слоя зубчатой извилины (DGhilus и DGin), радиального слоя CA3 и CA1 (CA3ra и CA1ra) и ориентировочного слоя CA3 и CA1 (CA3or и CA1or). Уровень серого фона для каждого среза был получен из среднего значения восьми кружков, помещенных внутри мозолистого тела, чтобы контролировать вариации в окрашивании и освещении. Средние уровни серого для каждой интересующей области гиппокампа (ROI) были получены путем усреднения уровней серого для всех кругов в этой области.Затем среднее значение OD было получено путем вычитания каждого среднего уровня серого из 255 (максимальная интенсивность белого). Затем было получено среднее значение OD для каждой области интереса путем вычитания среднего эталонного значения OD мозолистого тела из среднего значения OD для каждой области интереса на каждом участке (Gao et al, 2006).
Рисунок 1(a) Репрезентативная микрофотография дорсального среза гиппокампа, показывающая расположение пустых кружков, используемых для денсиометрического анализа. По 12 кругов диаметром 100 мкм каждый был размещен вдоль каждого из DGin и DGhi, и по 6 кругов были размещены вдоль каждого из CA3ra, CA3or, CA1ra и CA1or.Все срезы гиппокампа просматривали при 40-кратном увеличении. (b) Микрофотография зубчатой извилины под 400-кратным увеличением, контрастирующая с целостностью сигнала экспрессии синаптофизина в воротах ворот и тем, что наблюдается в слое гранулярных клеток.
Анализ данных
Чтобы оценить влияние гормонального лечения на замораживание и любые различия между группами в болевой чувствительности к шоку в день кондиционирования, было рассчитано и проанализировано общее время в секундах, проведенное в замораживании после каждого предъявления шока. Вариант ANOVA с группой (контроль, 17 β -эстрадиол-низкий, 17 β -эстрадиол-средний, 17 β -эстрадиол-высокий, эстрон-низкий, эстрон-средний, эстрон-высокий, 17 α -эстрадиол-низкий, 17 α -эстрадиол-средний, 17 α -эстрадиол-высокий) как фактор между субъектами.Общее количество времени в секундах, проведенное в замораживании в контексте A (контекстное кондиционирование страха) и Контексте B (обусловленное сигналом страха) в день тестирования, было проанализировано с использованием одностороннего дисперсионного анализа с группой в качестве фактора между субъектами. Общее количество времени, проведенного за замораживанием до (для оценки распознавания различного контекста) и во время трех презентаций тона в контексте B (условное обозначение страха) в день тестирования, было проанализировано с использованием одностороннего дисперсионного анализа с группой в качестве промежуточных субъектов. фактор. Из-за неисправности оборудования данные по одному контрольному животному не были включены в анализ вызванного условием страха.Различия в OD экспрессии синаптофизина анализировали с использованием дисперсионного анализа ANOVA с повторными измерениями с группой в качестве фактора между субъектами и областью (DGhilus, DGin, CA3ra, CA3or, CA1ra и CA1or) в качестве фактора внутри субъектов. Ранговые корреляции Спирмена были проведены между OD экспрессии синаптофизина в каждой области и общим количеством времени в секундах, затраченном на замораживание во время контекстного тестирования условного страха в контексте A. Данные были дополнительно проанализированы с использованием апостериорного теста Newman-Keuls .Все статистические процедуры были установлены на α = 0,05, если не указано иное.
Зависящие от времени и дозы эффекты 17-бета-эстрадиола на кратковременную пролиферацию в реальном времени и экспрессию генов в клетках гранулезной свиньи
Ключевыми механизмами, ответственными за достижение полной репродуктивной способности и способности к развитию у млекопитающих, являются дифференциация и трансформация гранулезных клеток (ГК) во время фолликулогенеза, оогенеза и созревания ооцитов. Хотя роль 17-бета-эстрадиола (E2) в активности яичников широко известна, его влияние на пролиферативную способность, образование соединений щелевых соединений (GJC) и трансформацию GCs-лютеиновых клеток требует дальнейших исследований.Таким образом, целью данного исследования было оценить пролиферативную активность ГК свиней in vitro в реальном времени в отношении экспрессии коннексина (Сх), рецептора лютеинизирующего гормона (LHR), рецептора фолликулостимулирующего гормона (FSHR) и ароматазы (CYP19A1). во время краткосрочного (168 ч) первичного культивирования. Культивированные GC подвергали острому (через 96 ч культивирования) и / или длительному (от 0 до 168 ч культивирования) введению 1,8 и 3,6 мк M E2. Измеряли относительное содержание мРНК Cx36, Cx37, Cx40, Cx43, LHR, FSHR и CYP19A1.Мы пришли к выводу, что способность GCs к пролиферации in vitro в значительной степени связана с экспрессией Cxs, LHR, FSHR и CYP19A1. Кроме того, трансформация GC-лютеиновых клеток in vitro может в значительной степени сопровождаться пролиферативной активностью GC у свиней.
1. Введение
Правильное развитие ооцитов млекопитающих зависит от двунаправленной коммуникации посредством соединений щелевых соединений (GJC), происходящих между женской гаметой и окружающими соматическими кумулюсными клетками (CCs) [1].Хорошо известно, что коннексины (Cxs) являются основными маркерами взаимодействия кумулюсная клетка-ооцит и, следовательно, играют решающую роль в двунаправленном транспорте малых молекул между этими клетками [2]. Более того, недавно было сообщено, что коннексин 43 (Сх43) играет критическую роль в этой коммуникации и может быть признан маркером созревания ооцита [3]. Эта паракринная ассоциация определяет правильное созревание ооцитов и достижение стадии MII. Было показано, что GJC ответственны за правильный рост ооцитов; однако до сих пор полностью не известно, как эти коммуникации влияют на дифференцировку и пролиферацию гранулезно-кумулюсных клеток in vitro.
До сих пор имеется немного сообщений, указывающих на способность клеток гранулезы (ГК) пролиферировать in vitro. Недавно мы показали, что клетки кумулюса пролиферируют in vitro в культуральных моделях, окруженных и разделенных кумулюсом [4]. Более того, субклеточное распределение маркеров созревания, Cdk4 и Cx43, значительно отличается в фолликулах различного размера и условий культивирования. Кратковременная пролиферация CC in vitro существенно влияет на экспрессию белков Cdk4 и Cx43, а также на их ядерную и цитоплазматическую локализацию.Однако молекулярный фактор, определяющий способность к пролиферации GC in vitro, а также трансформация GC-лютеиновых клеток, связанная с субклеточным распределением маркерных белков, все еще требует дальнейшего изучения.
Хорошо известно, что яичник млекопитающих выполняет две важные функции: производство женских гамет и синтез стероидных гормонов яичников, таких как эстроген и прогестерон. Оба эти гормона участвуют в гормональных путях обратной связи, которые регулируют рост и дифференцировку фолликулярных клеток.Более того, это хорошо известная теория, согласно которой способность яичников синтезировать 17-бета-эстрадиол (E2) является основным показателем правильной функции и активности фолликулов яичников. Андрогены, продуцируемые в слоях клеток теки путем преобразования, используются в синтезе эстрогена в клетках гранулезы. Более того, ГК продуцируют эстроген, и воздействие экзогенного эстрогена из-за введения E2 может вызвать отрицательную обратную связь эстрогена в клетках гранулезы [5].
Поскольку было обнаружено, что E2 активно синтезируется в GCs, предполагается, что E2 может играть важную роль в пролиферации GC и дифференцировке GC-CC [6].Однако связь экспрессии Cxs с пролиферацией GCs in vitro в среде, дополненной E2, до сих пор полностью не выяснена. Таким образом, это исследование было направлено на изучение пролиферации GC свиней в реальном времени после обработки E2 в отношении экспрессии гена Cxs, обращаясь к роли связи GJC в пролиферации в реальном времени обработанных E2 GCs свиньи.
2. Материалы и методы
2.1. Животные
В этом исследовании было использовано 40 пубертатных помесных свинок породы ландрас, выращенных на местной коммерческой ферме.Их средний возраст составлял 155 дней (диапазон: 140–170 дней) и средний вес 100 кг (95–120 кг). Все животные содержались в одинаковых условиях и получали один и тот же корм (в зависимости от возраста и репродуктивного статуса). Эксперименты были одобрены Локальным этическим комитетом.
2.2. Сбор яичников свиней и культивирование in vitro клеток гранулезы свиней (GC)
Яичники и репродуктивные тракты были получены во время убоя и доставлены в лабораторию в течение 40 минут при 38 ° C в условиях 0.9% NaCl. Для обеспечения оптимальных условий яичники каждого животного помещали в 5% фетальную бычью сыворотку (FBS; Sigma-Aldrich Co., Сент-Луис, Миссури, США) в PBS [7, 8]. Клетки гранулезы собирали путем аспирации фолликулярной жидкости из отдельных фолликулов с помощью иглы 20 G. Собранные клетки дважды промывали центрифугированием при 200 × g в течение 10 мин при комнатной температуре с культуральной средой. КОК удаляли из клеточной суспензии фильтрованием через сетчатый фильтр для клеток 40 мкм мкм и выбрасывали. Среда состояла из среды Игла, модифицированной Дульбекко (DMEM / F12, Sigma-Aldrich, США), 2% FCS фетальной сыворотки теленка (PAA, Австрия), 10 мг / мл аскорбиновой кислоты (Sigma-Aldrich, США), 0.05 μ M дексаметазон (Sigma-Aldrich, США), 200 мМ L-глутамин (Invitrogen, США), 10 мг / мл гентамицина (Invitrogen, США), 10000 единиц / мл пенициллина и 10000 единиц / мл пенициллина и 10000 μ г / мл стрептомицин (Invitrogen, США). Клетки культивировали при 38,5 ° C в аэробных условиях (5% CO 2 ). После того, как адгезивные клетки сливались более чем на 80%, их отделяли 0,05% трипсин-ЭДТА (Invitrogen, США) в течение 4 минут и подсчитывали с помощью счетчика Z2 или анализатора жизнеспособности клеток Vi-Cell XR 2.03 (оба — Beckman Coulter, США).
2.3. Культивирование ГХ in vitro с использованием клеточного анализатора реального времени (RTCA)
Восстановленные ГХ были перенесены в E-Plate 16 анализатора клеток реального времени (RTCA, Roche-Applied Science, GmbH, Пенцберг, Германия), состоящего из анализатор RTCA, станция RTCA SP и программное обеспечение RTCA. Затем ГХ культивировали в 200 мкл л стандартной культуральной среды IVM свиней, которая состояла из среды Игла, модифицированной Дульбекко (DMEM / F12, Sigma-Aldrich, США), как упомянуто выше. ГХ культивировали в течение 0–168 ч при 38.5 ° C при 5% CO 2 . Среду культивирования меняли каждые 44 часа. В первом эксперименте ГХ были дополнены 1,8 и 3,6 мк M E2 в начале эксперимента (0 ч). Одновременно во втором эксперименте ГК были дополнены теми же дозами E2 через 96 ч, во время логарифмического увеличения пролиферации (логарифмическая фаза). После каждого этапа культивирования ГК обрабатывали трипсином (0,25% трипсина в сбалансированном солевом растворе, Sigma-Aldrich, Сент-Луис, Миссури, США), и для оценки использовали клеточный индекс (CI) и нормализованный клеточный индекс. относительные и количественные изменения электрического сопротивления ячейки.Состояние клеток определяли с помощью программного обеспечения RTCA.
2.4. Анализ RT-qPCR экспрессии мРНК Cx36, Cx37, Cx40, Cx43, LHR, FSHR и CYP19A1 в GC
Общая РНК была выделена из GC до (через 0 ч) и после (24, 48, 72, 96, 120, 144 и 168 ч) IVC с использованием мини-колонки RNeasy от Qiagen GmbH (Хильден, Германия). Образцы РНК ресуспендировали в 20 мкл л воды, свободной от РНКазы, и хранили в жидком азоте. Затем образцы РНК обрабатывали ДНКазой I и подвергали обратной транскрипции (RT) в кДНК.RT-qPCR проводили с использованием системы обнаружения LightCycler RT-qPCR (Roche Diagnostics GmbH, Mannheim, Germany) с SYBR® Green I в качестве детектирующего красителя, и целевую кДНК определяли количественно с использованием метода относительной количественной оценки. Относительное количество транскриптов Cx36, Cx37, Cx40, Cx43, LHR, FSHR и CYP19A1 в каждом образце стандартизировали по внутреннему стандарту глицеральдегид-3-фосфатдегидрогеназы (GAPDH). Для амплификации 2 мкл раствора кДНК л добавляли к 18 мкл мкл QuantiTect® SYBR Green PCR (Master Mix Qiagen GmbH, Hilden, Германия) и праймерам (таблица 1).Один образец РНК каждого препарата обрабатывали без RT-реакции, чтобы обеспечить отрицательный контроль для последующей ПЦР.
NM 1
| ||||||||||||||||||||||||||||||||||||||||||||||||||
в каждом образце были рассчитаны специфические уровни экспрессии моцистеина для определения специфических уровней экспрессии гена GC. актин (ACTB) и порфобилиногендеаминаза (PBGD).Чтобы гарантировать целостность этих результатов, дополнительный ген 18S рРНК был использован в качестве внутреннего стандарта, чтобы продемонстрировать, что мРНК ACTB и PBGD не регулируются по-разному в группах GC. Экспрессия 18S рРНК была идентифицирована как подходящий ген домашнего хозяйства для использования в количественных исследованиях ПЦР. Экспрессию мРНК ACTB, PBGD и 18S рРНК измеряли в образцах кДНК из изолированных GC.
2,5. Статистический анализ
Односторонний дисперсионный анализ с последующим апостериорным тестом Тьюки был использован для сравнения результатов количественной оценки индекса распространения в реальном времени.Эксперименты проводились как минимум в двух повторностях. Результаты количественной оценки индекса пролиферации клеток были получены с использованием системы RTCA. Различия считались значительными при анализах RT-qPCR и RTCA, и их оценивали путем сравнения результатов, полученных в пяти повторах одних и тех же восстановленных клеток гранулезы. Статистические расчеты применялись к наивысшему нормализованному индексу пролиферации в каждый момент времени для каждой исследуемой группы для целей сравнения.Все статистические анализы были выполнены с использованием программного обеспечения GraphPad Prism версии 4.0 (GraphPad Software, Сан-Диего, Калифорния).
3. Результаты
Используя анализ RT-qPCR, мы проанализировали относительное количество мРНК Cx36, Cx37, Cx40, Cx43, LHR, FSHR и CYP19 после каждого периода пролиферации в реальном времени с помощью GC in vitro. Два гена домашнего хозяйства, ACTB и PBGD (данные не показаны), использовали для нормализации анализов RT-qPCR от образца к образцу. Цель состояла в том, чтобы проверить, изменился ли профиль экспрессии мРНК среди групп.Кроме того, были применены два гена домашнего хозяйства для проверки эффективности выделения общей РНК.
Мы обнаружили повышенную экспрессию мРНК Cx36 в контроле (необработанные клетки) через 0 ч IVC (), тогда как через 24 ч IVC более высокий уровень этого транскрипта наблюдался в группе, получавшей пролонгированный E2 (). Между 48 и 168 часами мы не определяли различий между группами. Острое лечение E2 показало аналогичное уменьшенное влияние на экспрессию мРНК Cx36 (рис. 1). Транскрипт Cx37 показал повышенную экспрессию через 0, 120 и 144 ч в контрольной группе по сравнению с группой, получавшей пролонгированное лечение E2 () (рис. 2).МРНК Cx40 имела повышенную экспрессию в группе, получавшей пролонгированный E2, через 0, 24 и 72 часа по сравнению с необработанными контролями () (рис. 3). Точно так же Cx43 демонстрировал более высокую экспрессию через 0 и 24 часа в группе, получавшей E2 (), и через 48 и 72 часа (), по сравнению с необработанными контролями (Рисунок 4). Уровень мРНК LHR увеличивался через 0, 24, 48, 72, 96 и 120 ч в группе, получавшей пролонгированный E2, по сравнению с контролем (и, соответственно) (фиг. 5). Напротив, относительное количество мРНК FSHR увеличивалось через 72 часа в группе, обработанной E2 ().Транскрипт FSHR был более высоко экспрессирован в контроле через 0, 96, 120 и 144 часа по сравнению с группой, обработанной E2 (, и, соответственно) (Фиг.6). Подобно LHR, количество мРНК CYP19A1 увеличивалось через 0, 24 и 48 ч в группе, получавшей E2, по сравнению с контрольной (,), но повышенные уровни транскрипта CYP19A1 наблюдались через 144 и 168 ч в контрольной группе (Рисунок 7) .
Используя систему RTCA, оценивали индекс пролиферации (PI) и эффекты острого и длительного лечения E2.В первом эксперименте свиньи GC культивировали с 1,8 и 3,6 мк M E2 в начале эксперимента (0 ч), который был разделен на три периода времени: 0–168 ч (рис. 8 (а)), 0–56 ч (рис. 8 (б)) и 56–90 ч (рис. 8 (с)). При анализе полного периода культивирования мы обнаружили значительное увеличение ИП в контрольной группе по сравнению с группами, обработанными 1,8 и 3,6 мкМ M E2 (и, соответственно) (рис. 8 (а)). Между 0 и 56 часами НПВ различий в значении PI не наблюдалось (рис. 1).Однако в течение последнего периода культивирования более высокий ИП в контрольной группе был определен для обеих доз 1,8 и 3,6 мкМ M E2 (и, соответственно) (рис. 8 (c)).
Во втором эксперименте оценивали эффект острого лечения E2 на GC во время логарифмического увеличения пролиферации. Точно так же ИП оценивался в три разных периода времени. При анализе полных периодов культивирования 0–168 ч мы не наблюдали различий в PI между контрольной и экспериментальной группами (рис. 9 (а)).ГХ обрабатывали 1,8 и 3,6 мк M E2 через 96 ч культивирования (рис. 9 (b)). Впоследствии мы наблюдали значительное увеличение PI после обработки 1,8 и 3,6 мк M E2 по сравнению с контролем (и, соответственно) (рис. 9 (c)).
4. Обсуждение
Созревание кумулюс-ооцитного комплекса (КОК) млекопитающих, как in vivo, так и in vitro, относится к сложным процессам, управляемым существенными морфологическими и молекулярными изменениями, происходящими в обнаженных ооцитах и окружающих соматических кумулюсно-гранулезных клетках [9].Эти модификации включают (1) накопление мРНК и белков в цитоплазме ооцита (созревание цитоплазмы), (2) хромосомную реорганизацию (ядерное созревание), (3) рост кумулюсных клеток (CC) и (4) активацию двунаправленных CC-ооцитов. контакт через щелевые соединения (GJC). У нескольких видов млекопитающих наблюдалось, что правильные перекрестные помехи необходимы для прогрессирующего роста ооцитов, пролиферации и дифференцировки CC [10, 11]. Более того, отсутствие слоев кучевых офоров и / или расширенных кучевых облаков после созревания являются основными причинами нарушений во время оплодотворения и образования зиготы [12].Структура пептида GJC состоит из нескольких коннексинов (Cxs), которые отвечают за перемещение небольших веществ между CC и ооцитами. Наши предыдущие результаты показали экспрессию и возможную функцию Cxs в GC свиней во время краткосрочного первичного культивирования в реальном времени [2]. Фолликулярные GC свиней использовали в качестве модели исследования, где оценивали влияние E2 на паттерн экспрессии Cxs (Cx36, Cx37, Cx40 и Cx43) во время краткосрочного культивирования in vitro (IVC) в режиме реального времени GC. Во время созревания КОК млекопитающих, как in vivo, так и in vitro, кумулюсные клетки, которые плотно окружают ооцит, претерпевают значительные морфологические и биохимические модификации, процесс, также известный как расширение кумулюса.Однако до сих пор остается неясным, сопровождается ли этот уникальный процесс распространением ЦК. Наши недавние исследования ясно продемонстрировали, что свиные кумулюсные ооциты, отдельные CC или GC успешно пролиферируют in vitro во время краткосрочной первичной культуры в реальном времени [4, 13]. Однако острый и / или пролонгированный эффект введения E2 на интенсивность пролиферации GC свиней in vitro еще предстоит исследовать. Мы обнаружили, что при длительном лечении E2 применяли в дозах 1,8 и 3 раза.6 мк M, приводит к снижению интенсивности пролиферации GC, когда клетки входят в логарифмическую фазу пролиферации между 72 и 96 часами IVC. Однако острое лечение E2 приводит к увеличению PI после приема обеих доз гормона. Остается неясным, проявляют ли различные периоды времени введение E2 различные эффекты на пролиферацию GC. Мы предположили, что временные изменения интенсивности пролиферации ГК свиней in vitro могут быть связаны со специализацией и повышенной специфичностью или жизнеспособностью клеток после 72 ч IVC.Хорошо известно, что ГК претерпевают существенную трансформацию в лютеиновые клетки после 48–72 часов культивирования in vitro. Следовательно, можно предположить, что дифференциальный эффект лечения острым E2 регулируется специфической реакцией ГК на гормональную стимуляцию. Хотя профиль стероидных гормонов в исследовании не оценивался, мы предполагаем, что пролонгированный эффект лечения E2 может действовать через различные механизмы во время трансформации GC-лютеиновых клеток и / или значительно изменять этот процесс in vitro.
Существуют минимальные данные, указывающие на то, что экспансия CC связана со значительными изменениями биохимической пролиферации экспрессии целевого гена. В текущем исследовании мы оценили профиль экспрессии Cxs, которые функционируют как маркеры коммуникации CC-ооцитов, и активность GJC во время кратковременной пролиферации клеток в реальном времени. Мы обнаружили, что профиль экспрессии Cxs в течение 168 ч IVC существенно изменился. Кроме того, также наблюдалось острое и / или продолжительное действие добавок E2 на пролиферацию клеток.Широко известно, что E2 имеет решающее значение для правильного функционирования репродуктивных процессов у млекопитающих, особенно в регуляции фолликулогенеза и оогенеза. Более того, эстроген, вырабатываемый зрелым фолликулом яичника, является важным фактором пролиферативной фазы эндометрия. Однако до конца не выяснено, влияет ли E2 на активность GJC через повышающую регуляцию экспрессии Cx. Результаты текущего исследования ясно продемонстрировали, что E2 может модулировать экспрессию Сх после острого и / или длительного лечения, и он может быть потенциальным фактором, связанным с паракринной активностью как ооцитов, так и CC во время индукции перекрестного взаимодействия между гаметами и соматическими клетками.”
Роль гормонов эстрогена и прогестерона на экспрессию Сх в различных типах ткани яичников недавно была исследована на нескольких видах млекопитающих [14, 15]. Однако влияние E2 на профиль экспрессии Cx в GC и CC неизвестно. Роль Cxs в регуляции роста, развития ооцитов и дифференцировки окружающих CCs посредством индукционной активности GJC широко признана [16]. Также хорошо известно, что этот процесс регулируется факторами, то есть гормонами, которые действуют через паракринную секрецию.Однако механизмы, которые регулируют активность GJC и / или пути коммуникации между ооцитом и CCs, все еще нуждаются в изучении.
Недавно Saadeldin et al. исследовали взаимодействие между оголенными ооцитами свиней и GCs в юкстакринных и паракринных моделях двунаправленного взаимодействия в отношении экспрессии Cx43 [17]. Они использовали систему вставок из полиэфирной мембраны Transwell 0,4 мкм мкм, чтобы обеспечить паракринное взаимодействие ооцитов и гранулезных клеток в модели сокультивирования. Более высокая скорость партеногенетического образования бластоцисты наблюдалась в модели прямой коммуникации по сравнению с паракринной моделью.Интересно, что также были определены изменения в стероидных профилях, таких как P4 и E2, и экспрессия мРНК ферментов, критических для стероидогенеза, после 22 и 44 часов юкстакринных и паракринных коммуникационных моделей. Экспрессия Cx43 была значительно выше в модели прямого контакта GC, чем в системе непрямого совместного культивирования. Эти результаты подтверждают предыдущее наблюдение, что модель прямого контакта для культуры GC in vitro показала лучшие условия роста ооцитов и дифференциации GC.
Аналогичным образом, наши результаты показали связь между PI во время краткосрочного культивирования свиней GC in vitro и профилем экспрессии выбранных Cx в отношении стимулирующего эффекта введения E2. В нашем недавнем исследовании мы исследовали экспрессию выбранных коннексинов, таких как мРНК Cx36, Cx37, Cx40 и Cx43, с помощью RT-qPCR, а также распределение белков Cx30, Cx31, Cx37, Cx43 и Cx45 в ГК свиней в течение короткого периода времени. (168 ч), пролиферация клеток in vitro в реальном времени [2].Мы наблюдали повышенную экспрессию мРНК Cx36, Cx37 и Cx43 в GC при восстановлении по сравнению со всеми проанализированными периодами времени IVC (24, 48, 72, 96, 120, 144 и 168 ч;). Более того, паттерны экспрессии белков Cx31, Cx37 и Cx45 были увеличены до (0 часов) по сравнению с 168 часами IVC. Точно так же значение PI увеличивалось между 72 и 96 часами НПВ. Принимая во внимание оба этих результата, мы предполагаем, что снижение экспрессии Cxs и / или распад GJC во время IVC может быть в значительной степени связано с дифференцировкой GC в лютеиновые клетки in vitro.
Эффект тестостерона на секрецию 17-бета-эстрадиола в связи с активностью ароматазы был ранее исследован с использованием модели крыс GC Lee et al. [18]. Авторы обнаружили, что лечение тестостероном (0,1 и 1 мкг мкг / мл) увеличивает активность ароматазы и секрецию 17-бета-эстрадиола. Более того, более высокие дозы тестостерона подавляют экспрессию Cx43 в ГК крыс, что устраняется добавлением кальцитриола (1,25-D3). Наше исследование показало, что мРНК CYP19A1 значительно увеличилась после лечения E2.В нашем текущем исследовании мы не оценивали концентрацию тестостерона или влияние его добавок на экспрессию CYP19A1. Однако наблюдался положительный эффект введения E2 на экспрессию ароматазы. Результаты Lee et al. согласуются с нашими выводами, поскольку была обнаружена положительная регуляция экспрессии ароматазы. Это может быть эффектом стимуляции фосфотирозином, тем самым увеличивая концентрацию и доступность 1,25-D3, который является мощным фактором индуцированной тестостероном продукции 17-бета-эстрадиола в ГК.
Функция ГК, выделенных из ооцитов молодых, средних и пожилых бесплодных пациентов, в отношении стероидогенеза, апоптоза и активности гонадотропинов во время овуляции яичников была недавно исследована Wu et al. Как и в нашем исследовании, GC собирали из фолликулярной жидкости яичников и оценивали экспрессию FSHR, CYP19A1, HSD17B, LHR, CYP11A1 и PGR (рецептор прогестерона). Они обнаружили, что экспрессия FSHR, CYP19A1 и HSD17B была снижена в GC, выделенных от пожилых пациентов, тогда как LHR, CYP11A1 и PGR стимулировались в этой группе.Более того, пролиферация ГК in vitro была ниже, а скорость апоптоза увеличивалась у пожилых пациентов. Преждевременная лютеинизация сопровождалась возрастным снижением функции GC in vitro, тогда как добавление ФСГ в культуру предотвращало лютеинизацию GC [19].
Результаты текущего исследования показали повышенную экспрессию обоих рецепторов гонадотропина (LHR и FSHR) через 0–24 часа в необработанном контроле, тогда как наблюдалась повышенная регуляция этих генов через 48–72 часа после введения E2.Предполагается, что обработка E2 отражает стимулирующий эффект на пролиферацию GCs in vitro, способность достигать логарифмической фазы через 72 часа и экспрессию LHR. Более того, экспрессия LHR может быть признана маркером трансформации GC-лютеиновых клеток, поскольку самый высокий уровень экспрессии наблюдался между 48 и 72 часами. Кроме того, повышение уровня FSHR через 72 часа IVC также сопровождается значительным увеличением пролиферации GC свиней in vitro. У некоторых видов млекопитающих широко известно, что первичная культура GC и / или исследования, основанные на трансформации GC-лютеиновых клеток, являются надежной и удобной моделью фолликулогенеза яичников и могут быть признаны специфическим «отпечатком пальца» этого процесса.
Baufeld и Vanselow исследовали морфологические и физиологические свойства бычьих ГК in vitro в отношении экспрессии маркеров лютеинизации и статуса метилирования [20]. Они обнаружили, что CYP19A1 является решающим ферментом в пути производства эстрадиола, и экспрессия этого фермента связана с размером фолликулов. Только ГК, выделенные из фолликулов большего размера, характеризовались повышенной специфичностью и чувствительностью к действию ЛГ на яичники. Более того, они наблюдали значительную связь между синтезом 17-бета-эстрадиола и экспрессией CYP19A1; однако пролиферативная активность GC, измеренная по экспрессии ядерного антигена пролиферирующих клеток (PCNA), была обратимой и коррелировала с экспрессией маркеров стероидогенеза и рецепторов гонадотропина.Также определяли снижение экспрессии маркеров лютеинизации, таких как простагландин-эндопероксид-синтаза 2 (PTGS2), пентраксин 3 (PTX3), регулятор передачи сигналов G-белка 2 (RGS2) и ванин 2 (VNN2). Вопреки этим результатам, наши результаты продемонстрировали положительную корреляцию между введением E2 и пролиферативной способностью ГК свиней, культивируемых in vitro. Однако аналогичным образом наблюдался стимулирующий эффект E2 на CYP19A1. Более того, в нашем недавнем исследовании мы представили связь лютеинизации ГК с экспрессией мРНК LHR, FSHR и CYP19A1 и распределением белков, кодируемых этими генами, в культуре in vitro [21].LHR и CYP19A1 были увеличены через 24 и 48 часов IVC, тогда как FSHR достиг наивысшего уровня через 0 часов. Точно так же повышенный ИП был отмечен вскоре после 24 ч НПВ. Было высказано предположение, что физиологическое состояние пролиферации ГК не связано с экспрессией маркеров лютеинизации. Сравнивая эти результаты с текущим исследованием, мы предполагаем, что только ГК, стимулированные Е2, коррелируют с увеличением ИП, что может сопровождаться существенной активацией трансформации ГК-лютеиновых клеток in vitro, даже если некоторые ГК могут отрицательно регулироваться высокая концентрация эстрогена из-за введения экзогенного E2.Более того, экспрессия коннексинов, которая является маркером активности GJC, может модулироваться добавлением E2.
Этическое одобрение
Это исследование было одобрено решением 32/2012 местного этического комитета в Познани.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Это исследование стало возможным благодаря гранту № 2014/13 / D / NZ9 / 04798 «SONATA» из Польского национального научного центра и 502-14-02227367-10694 из Познаньского университета медицинских наук.
Биодеградация 17-β-эстрадиола в воде
Aboul-Enein HY, Ali I (2000) Макроциклические антибиотики как эффективные хиральные селекторы для разделения энантиомеров с помощью жидкостной хроматографии и капиллярного электрофореза. Хроматография 52: 679–691
CAS Статья Google ученый
Aboul-Enein HY, Ali I (2002) Сравнительное исследование энантиомерного разделения хиральных противогрибковых препаратов эконазол, миконазол и сульконазол с помощью ВЭЖХ на различных хиральных колонках с целлюлозой в режиме нормальной фазы.J Pharm Biomed Anal 27: 441–446
CAS Статья Google ученый
Adeel M, Song X, Wang Y, Francis D, Yang Y (2017) Воздействие эстрогенов на окружающую среду на человека, животных и растения: критический обзор. Environ Int 99: 107–119
CAS Статья Google ученый
Адлер П., Стегер-Хартманн Т., Калбфус В. (2001) Распределение природных и синтетических эстрогенных стероидных гормонов в образцах воды из Южной и Средней Германии.Acta Hydrochim Hydrobiol 29: 227–241
CAS Статья Google ученый
Afifi R, Elnwishy N, Hannora A, Hedstrom M, Mattiasson B, Omran H, Ali I (2016) SPE и HPLC-мониторинг 17-β-эстрадиола в водных экосистемах Египта. J Liq Chromatogr Relat Technol 39 (8): 428–434
CAS Статья Google ученый
Ali I (2010) Поиск заменителей адсорбента с активированным углем: недорогие адсорбенты для удаления токсичных ионов металлов из сточных вод.Сен Purf Ред. 39: 95–171
CAS Статья Google ученый
Ali I., Aboul-Enein HY (2003) Энантиоразделение некоторых клинически используемых лекарств с помощью ВЭЖХ с использованием хиральной стационарной фазы трис (3,5-дихлорфенилкарбамата) целлюлозы. Биомедицинский хроматограф 17: 113–117
CAS Статья Google ученый
Ali I, Naim L, Ghanem A, Aboul-Enein HY (2006a) Хиральное разделение аналогов пиперидин-2,6-диона на колонках Chiralpak IA и Chiralpak IB с использованием ВЭЖХ.Таланта 69: 1013–1017
CAS Статья Google ученый
Али И., Кумерер К., Абул-Энеин Х.Й. (2006b) Механистические принципы хирального разделения с использованием жидкостной хроматографии и капиллярного электрофореза. Хроматография 63: 295–307
CAS Статья Google ученый
Али И., Абул-Энейн Х.Й., Гупта В.К. (2009) Нанохроматография и нанокапиллярный электрофорез: фармацевтические и экологические анализы.Уайли, Нью-Йорк
Google ученый
Али И., Абул-Энейн Х.Ю., Кюммерер К. (2011) Анализ лекарств и фармацевтических препаратов в окружающей среде, В биофизико-химических процессах антропогенных органических соединений в системах окружающей среды. В: Xing B, Senesi N, Huang PM (eds), спонсируемая ИЮПАК серия книг. Wiley, New York, стр 439–462
Google ученый
Али И., Хан Т.А., Асим М. (2012) Удаление арсената из грунтовых вод методом электрокоагуляции.Environ Sci Pollut Res 19: 1668–1676
CAS Статья Google ученый
Али И., Асим М., Хан Т.А. (2013) Удаление арсенита из воды электрокоагуляцией на цинк-цинковых и медно-медных электродах. Int J Environ Sci Technol 10: 377–384
CAS Статья Google ученый
Али И., Алотам З.А., Алвартан А., Асим М., Хан Т.А. (2014) Удаление мышьяка из воды с помощью периодических и колонных операций с зольной пылью из жмыха.Environ Sci Pollut Res 21: 3218–3229
CAS Статья Google ученый
Али И., Алотам З.А., Алвартан А. (2015) Экологичный синтез нанопропитанного железом адсорбента для быстрого удаления фторида из воды. J Mol Liq 211: 457–465
CAS Статья Google ученый
Али И., Алотам З.А., Алвартан А. (2016a) Синтез композитного наноразмерного адсорбента железа и удаление остатков лекарственного средства ибупрофена из воды.J Mol Liq 219: 858–864
CAS Статья Google ученый
Али И., Алотам З.А., Алвартан А. (2016b) Молекулярное поглощение красителя конго красного из воды на наночастицах композитного железа. J Mol Liq 219: 171–176
Статья Google ученый
Али И., Алотам З.А., Алвартан А. (2016c) Зеленый синтез функционализированных наночастиц железа и молекулярная жидкофазная адсорбция аметрина из воды.J Mol Liq 211: 1168–1174
Статья Google ученый
Али И., Алотам З.А., Альвартан А. (2016d) Поглощение остатка лекарственного средства пантопразола из воды с использованием нового синтезированного композитного наноразмерного адсорбента железа. J Mol Liq 218: 465–472
CAS Статья Google ученый
Али И., Алотам З.А., Алвартан А. (2016e) Сорбционные, кинетические и термодинамические исследования удаления атразинового гербицида из воды с использованием нанокомпозитного материала с железом.Int J Environ Sci Technol 10: 733–742
Статья Google ученый
Али И., Алотам З.А., Алвартан А. (2017a) Поглощение пропранолола на ионном жидком железном нанокомпозитном адсорбенте: кинетика, термодинамика и механизм адсорбции. J Mol Liq 236: 205–213
CAS Статья Google ученый
Али И., Алотман З.А., Алвартан А. (2017b) Надмолекулярный механизм удаления 17-β-эстрадиола, вызывающего нарушения эндокринной системы, из воды на функционализированных наночастицах железа.J Mol Liq 441: 123–129
Статья Google ученый
Андерсен Х.Р., Зигрист Х., Халлинг-Соренсен Б., Тернес Т. (2003) Судьба эстрогенов на муниципальных очистных сооружениях. Environ Sci Technol 37: 4021–4026
CAS Статья Google ученый
Андреа В., Йозеф М., Томас Т. (2003) Исследование эндокринных нарушителей в питьевой воде. Заключительный отчет ENV.D.1 / ETU / 2000/0083 Шмалленберг и Висбаден, 26 февраля
Ансари Ф.А., Хатун H (1997) Лечение R-плазмид, присутствующих в грамотрицательных бактериях, выделенных от домашней птицы в Карачи, с помощью бромистого этидия.Pak J Pharm Sci 10: 13–16
CAS Google ученый
Burton JL, Wells M (2002) Влияние фитоэстрогенов на женские половые пути. J Clin Pathol 55: 401–407
CAS Статья Google ученый
Caldwell DJ, Mastrocco F, Nowak E, Johnston J, Yekel H, Pfeiffer D, Hoyt M, DuPlessie BM, Anderson PD (2009) Оценка потенциального воздействия и риска эстрогенов в питьевой воде.Environ Health Perspect 118: 338–344
Статья Google ученый
Cook JW, Dodds EC, Hewett CL, Lawson W (1934) Эстрогенная активность некоторых соединений с конденсированным кольцом по отношению к их биологической активности. Proc R Soc Lond 114: 272–286
CAS Статья Google ученый
Fernández L, Louvado A, Esteves VI, Gomes NCM, Almeida A, Cunha  (2017) Биоразложение 17β-эстрадиола бактериями, изолированными из глубоководных отложений в аэробных и анаэробных средах.J Hazard Mater 323: 359–366
Статья Google ученый
Fujii K, Kikuchi S, Satomi M, Ushio-Sata N, Morita N (2002) Разложение 17β-эстрадиола грамотрицательной бактерией, выделенной из активного ила на очистных сооружениях в Токио, Япония. Appl Environ Microbiol 68 (4): 2057–2060
CAS Статья Google ученый
Geize R, Dijkhuizen L (2004) Использование катаболического разнообразия родококков для экологических и биотехнологических применений.Curr Opin Microbiol 7 (3): 255–261
Статья Google ученый
Hansen PD, Hock HDB, Sherry AMJ, Blaise MMC (1998) Биомаркер эндокринных разрушителей. Trends Anal Chem 17: 448–451
CAS. Статья Google ученый
Jahnke GD, Choksi NY, Moore JA, Shelby MD (2003) Токсиканты щитовидной железы: оценка воздействия на репродуктивное здоровье. Environ Health Perspect 112: 363–368
Статья Google ученый
Jiang L, Yang J, Chen J (2010) Выделение и характеристики разлагающих 17β-эстрадиол Bacillus spp.штаммы из активного ила. Биодеградация 21 (5): 729–736
CAS Статья Google ученый
Khanal SK, Xie B, Thompson ML, Sung S, Ong SK, Leeuwent VJ (2007) Судьба, перенос и биоразложение природных эстрогенов в окружающей среде и инженерных системах. Environ Sci Technol 8: 6537–6546
Google ученый
Koh YKK, Chiu TY, Boobis A, Cartmell E, Scrimshaw MD, Lester JN (2008) Стратегии очистки и удаления сточных вод.Environ Technol 29: 245–267
CAS Статья Google ученый
Лауренсон Дж. П., Блум Р. А., Пейдж С., Садрие Н. (2014) Этинилэстрадиол и другие фармацевтические эстрогены человека в водной среде: обзор последних данных оценки риска. AAPS J 16 (2): 299–310
CAS Статья Google ученый
Le Noir M, Lepeuple AS, Guieysse B, Mattiasson B (2007) Селективное удаление 17β-эстрадиола в следовых концентрациях с использованием молекулярно отпечатанного полимера.Water Res 41: 2825–2831
Статья Google ученый
Ли Х., Лю Д. (2002) Разложение 17β-эстрадиола и его метаболитов бактериями сточных вод. Вода, загрязнение воздуха и почвы 134: 353–368
CAS Статья Google ученый
Li S, Liu J, Sun M, Ling W, Zhu X (2017) Изоляция, характеристика и деградация бактерии, разлагающей 17β-эстрадиол Novosphingobium sp.E2S. Int J Environ Res Public Health 14: 115
Статья Google ученый
Ли М., Чжао X, Чжан Х, Ву Д., Ленг С. (2018) Биоразложение 17β-эстрадиола путем совместного культивирования бактерий, выделенных из навоза. Sci Rep 8 (1): 3787
Статья Google ученый
Лю Д., Страчан В.М., Томсон К., Квасневска К. (1981) Определение способности органических соединений к биологическому разложению.Environ Sci Technol 15 (7): 788–793
CAS Статья Google ученый
Ng KP, Datuin JP, Bern HA (2001) Влияние эстрогенов in vitro и in vivo на рост хряща тилапии ( Oreochromis mossambicus ). Gen Comparat Endocrinol 121: 295–304
CAS Статья Google ученый
Паравира В., Рид Дж. С., Маттиассон Б., Бьорнссон Л. (2008) Производство энергии из сельскохозяйственных остатков: высокие выходы метана в экспериментальном двухступенчатом анаэробном сбраживании.Биомасса Биоэнергетика 32: 44–50
CAS Статья Google ученый
Пауэлс Б., Вилле К., Ноппе Х, Де Брабандер Н., Ван де Виле Т., Верстраете В., Бун Н. (2008) Кометаболизм 17α-этинилэстрадиола бактериями, разрушающими эстрон, 17β-эстрадиол и эстриол. Биодеградация 19 (5): 683–693
CAS Статья Google ученый
Ра Дж.С., Ли С.Х., Ли Дж., Ким Х.Й., Лим Б.Дж., Ким С.Х., Ким С.Д. (2011) Наличие эстрогенных химикатов в поверхностных водах и муниципальных сточных водах Южной Кореи.J Environ Monit 13: 101–109
CAS Статья Google ученый
Райан К.Дж. (1982) Биохимия ароматазы: значение для женской репродуктивной физиологии. Cancer Res 42: 3342–3344
CAS Google ученый
Sambrook J, Fritschi EF, Maniatis T (1989) Молекулярное клонирование: лабораторное руководство, 2-е изд. Лабораторная пресса Колд-Спринг-Харбор, Нью-Йорк
Google ученый
Ши Дж., Фудзисава С., Накаи С., Хосоми М. (2004) Биоразложение природных и синтетических эстрогенов путем нитрификации активного ила и окисляющих аммиак бактерий Nitrosomonas europaea.Water Res 38 (9): 2323–2330
CAS Статья Google ученый
Singer RS, Cooke CL, Maddox CW, Isaacson RE, Wallace RL (2006) Использование объединенных образцов для обнаружения сальмонелл в кале с помощью полимеразной цепной реакции. J Veter Diag Invest 18: 319–325
Статья Google ученый
Straus D, Ausubel FM (1990) Вычитание генома для клонирования ДНК, соответствующего делеционным мутациям.Proc Natl Acad Sci 87: 1889–1893
CAS Статья Google ученый
Tawfic M (2006) Стойкие органические загрязнители в Египте: обзор. В: Twardowska I, Allen HE, Häggblom MM, Stefaniak S (eds) Мониторинг, защита и восстановление почвенного и водного загрязнения. Springer, Berlin, pp. 25–38
Google ученый
Тикко А., Трипати А.К., Верма С.К., Агравал Н., Нат Г. (2001) Применение методов снятия отпечатков пальцев ПЦР для идентификации и различения изолятов сальмонелл.Cur Sci 80: 1049–1052
Google ученый
Weber S, Leuschner P, Kämpfer P, Dott W, Hollender J (2005) Разложение эстрадиола и этинилэстрадиола активным илом и определенной смешанной культурой. Appl Microbiol Biotechnol 67 (1): 106–112
CAS Статья Google ученый
ВОЗ (2009) Департамент репродуктивного здоровья и исследований Всемирной организации здравоохранения, CH-1211 Женева, Швейцария.Комментарий / контрацепция 80: 325–326
Google ученый
Возняк Б., Клопот А., Матрашек-Люховска И., Сильска К., Шмудски Ю. (2014) Определение природных и синтетических эстрогенов в поверхностных водах с помощью газовой хроматографии-масс-спектрометрии. Bull Vet Inst Pulawy 58 (4): 603–611
Статья Google ученый
Xu P, Zhaaou X, Xu D, Xiang Y, Ling W, Chen M (2018) Загрязнение и оценка риска эстрогенами в навозе домашнего скота: тематическое исследование в провинции Цзянсу, Китай.Int J Environ Res Public Health 15 (1): 125
Статья Google ученый
Ягджян Л., Колдиц Г.А. (2011) Эстрогены в ткани груди: систематический обзор. Может вызывать контроль 22: 529–540
Статья Google ученый
Yoshimoto T, Nagai F, Fujimoto J, Watanabe K, Mizukoshi H, Makino T., Kimura K, Saino H, Sawada H, Omura H (2004) Разложение эстрогенов под действием Rhodococcus zopfii и изолятов Rhodococcus equhodoc6385 из активного ила на очистных сооружениях.Appl Environ Microbiol 70 (9): 5283–5289
CAS Статья Google ученый
Yu CP, Roh H, Chu KH (2007) Бактерии, разлагающие 17β-эстрадиол, выделенные из активного ила. Environ Sci Technol 41 (2): 486–492
CAS Статья Google ученый
Yu CP, Deeb AA, Chu KH (2013a) Микробное разложение стероидных эстрогенов. Химия 91: 1225–1235
CAS Статья Google ученый
Yu CP, Deeb RA, Chu KH (2013b) Микробное разложение стероидных эстрогенов.Chemosphere 91 (9): 1225–1235
CAS Статья Google ученый
Набор для ИФА 17 бета-эстрадиола (ab108667)
Обзор
Название продукта
Набор для иммуноферментного анализа на 17 бета-эстрадиол
Метод обнаружения
Колориметрический
Точность
Интра-анализ Образец n Среднее SD CV% Всего 20 Промежуточный анализ Образец n Среднее SD CV% Всего 3 Тип образца
Моча, сыворотка, плазма гепатита, плазма с ЭДТА, плазма Cit
Тип анализа
Конкурсные
Чувствительность
8.68 пг / мл
Диапазон
20 пг / мл — 2000 пг / мл
Восстановление
Продолжительность анализа
Многоступенчатый стандартный анализ
Реактивность видов
Реагирует с: Mouse, Rat, Human
Предполагается, что будет работать с: МлекопитающиеОбзор продукции
НаборAbcam’s 17 бета-эстрадиол in vitro конкурентный ELISA (иммуноферментный анализ) предназначен для точного количественного измерения 17-бета-эстрадиола в сыворотке и плазме (цитрат).
96-луночный планшет был предварительно покрыт антиэстрадиоловым IgG. Образцы и конъюгат эстрадиол-HRP добавляют в лунки, где эстрадиол в образце конкурирует с добавленным эстрадиол-HRP за связывание антител. После инкубации лунки промывают для удаления несвязанного материала и затем добавляют субстрат TMB, который катализируется HRP для получения синей окраски. Реакцию прекращают добавлением стоп-раствора, который останавливает развитие окраски и вызывает изменение цвета с синего на желтый.Интенсивность сигнала обратно пропорциональна количеству эстрадиола в образце, и интенсивность измеряется при 450 нм.
Платформа
Микропланшет
Недвижимость
Инструкция по хранению
Хранить при + 4 ° C. См. Протоколы.
Компоненты 1 x 96 тестов Промывочный раствор 10X 1 x 50 мл 17 бета-эстрадиол Контроль 1 х 0.5 мл 17 бета-эстрадиол Стандартный 0 1 x 1 мл 17 бета-эстрадиол Стандартный 1 (20 пг / мл) 1 x 0,5 мл 17 бета-эстрадиол Стандарт 2 (120 пг / мл) 1 x 0,5 мл 17 бета-эстрадиол Стандартный 3 (300 пг / мл) 1 x 0,5 мл 17 бета-эстрадиол Стандартный 4 (600 пг / мл) 1 х 0.5 мл 17 бета-эстрадиол Стандартный 5 (2000 пг / мл) 1 x 0,5 мл 17 бета-эстрадиол-HRP конъюгат 1 x 22 мл Микропланшет, покрытый анти-17 бета-эстрадиолом IgG (12 x 8 лунок) 1 шт. Защитная пленка 1 шт. Стоп-раствор 1 x 15 мл Держатель ленты 1 шт. Раствор субстрата TMB 1 x 15 мл Направления исследований
Изображения
Биологические жидкости для ab108667
17 бета-эстрадиол, измеренный в биологических жидкостях, показывает количество (пг) на мл исследуемой пробы.Образцы разбавляли в 1-2 раза.
- Типичная стандартная кривая
с использованием ab108667
Листы данных и документы
SDS скачать
Страна / регион Выберите страну / регион
Язык Выбор языка
Скачать брошюру
Список литературы (23)
ab108667 упоминается в 23 публикациях.
- Skórkowska A et al. Влияние комбинированного воздействия бензофенона-3 на беременные и взрослых на факторы, регулирующие нейродегенеративные процессы, уровни гормонов в крови и гематологические параметры у самок крыс. Neurotox Res 37: 683-701 (2020). PubMed: 31970650
- Ben Hameid AS et al. Существенное влияние водного экстракта семян пажитника на уровень эстрадиола в сыворотке на модели крыс с синдромом гиперстимуляции яичников. Oman Med J 34: 238-243 (2019). PubMed: 31110632
- Wickham KA et al. Не влияет добавка свекольного сока на экономию упражнений и производительность у рекреационно активных женщин, несмотря на повышенную выработку крутящего момента. Physiol Rep 7: e13982 (2019). PubMed: 30653856
- Weitzmann MN et al. Уменьшение костеобразования у мужчин и повышенная резорбция костной ткани у женщин приводят к потере костной массы у мышей с гемофилией А. Blood Adv 3: 288-300 (2019). PubMed: 30700417
- Delgobo M et al. N-ацетилцистеин и альфа-липоевая кислота улучшают антиоксидантную защиту и снижают окислительный стресс, воспаление и уровни липидов в сыворотке крови у крыс с удаленными яичниками с помощью эстроген-независимых механизмов. Дж. Нутр Биохим 67: 190-200 (2019). PubMed: 30951973
Отзывы клиентов, вопросы и ответы
1 — 4 из 4 Обзоры или вопросы и ответы
Просмотров: 10Просмотров: 50Просмотров: 100Сортировать по: Наивысшим голосам Сортировать по: Наименьшим голосам Сортировать по: Новейшим Первым Сортировать: Старым Первым
Мне нравятся эти комплекты от Abcam, потому что они просты в использовании и имеют очень хорошую инструкцию производителя.В комплект входит все необходимое (см. Рисунок), а лунки для полосок очень хороши, чтобы максимизировать экспериментальные условия и повторить анализ в другой день. Набор позволяет получить результат за 3 часа, что, в частности, отлично подходит для обучения. Я определенно рекомендую этот комплект.
Сообщество пользователей Abcam
Проверенный клиент
Опубликовано 27 авг.2014 г.
Я дважды пробовал использовать этот набор, чтобы определить уровень эстрогена у мышей.В первый раз многие из моих образцов вышли за пределы допустимого диапазона, поэтому я попытался оптимизировать, оставив образцы на ночь и снизив свои стандартные значения, чтобы лучше оценить более низкие концентрации. Однако оказалось, что уровни эстрогена у мышей слишком низкие, чтобы их можно было определить с помощью этого набора. Мои самые высокие значения наблюдались у моих самок мышей, перенесших овариэктомию (образцы F ovx) за 5 недель до тестирования их плазмы — я ожидал, что эти уровни будут почти нулевыми. Хотя я уверен, что этот набор подходит для людей, я не рекомендую использовать его для мышей, которые не находятся в тепле.Я приложил свои графические данные. Обозначение M: самцы мышей, F: самки мышей, F (ovx): овариэктомированные мыши, F Sham: самки мышей, перенесших фиктивную операцию. 2 часа означает, что образец оставляли на 2 часа, ON означает, что образец инкубировали в течение ночи.
Сообщество пользователей Abcam
Проверенный клиент
Отправлено 20 авг.2014 г.
Рекомендуется использовать компонент набора «Эстрадиол 17-бета Стандарт 0» для разбавления ценных образцов.Стандарт готовят из сыворотки без бета-эстрадиола 17. В качестве альтернативы следует использовать сыворотку от мужчин, не содержащую эстрадиола, в качестве основы для разбавления высоких образцов. Использование PBS / 1% BSA не имитирует образцы матрикса или сыворотки и может привести к недостоверным результатам.
Прочитайте большеНаш иммуноферментный анализ на 17 бета-эстрадиолов ab08667 представляет собой конкурентный иммуноферментный анализ.

 Estrogen Biology: New Insights into GPER Function and Clinical Opportunities Mol Cell Endocrinol. 2014 May 25; 389(0): 71–83.
Estrogen Biology: New Insights into GPER Function and Clinical Opportunities Mol Cell Endocrinol. 2014 May 25; 389(0): 71–83.